皮肤、深部组织以及内脏的伤害性刺激可使伤害性感受器产生神经冲动并传至中枢,当伤害性刺激达到一定程度就会引起疼痛。临床上,疼痛诊疗的关键在于准确地评估伤害性刺激,并合理制定镇痛方案。一直以来,小儿以及全麻患者围手术期的疼痛管理是麻醉医师面临的难题。目前临床上经典的疼痛评估工具都以主观表达为基础,而小儿以及全麻患者的主观表达能力不足, 使得麻醉医师不能做到准确、及时有效的疼痛管理[1-4]。因此,为了更好地进行疼痛管理,有必要以客观生理指标为基础描记患者伤害性刺激强度的变化。
光电容积脉搏波(photoplethysmography, PPG)描记法是一种借助光电手段在活体组织中监测血流容积变化的方法[5],该方法记录的PPG已被应用于评估成年患者的术后急性疼痛[6-8]。PPG因具有客观性、实时性、无创性以及量化伤害性刺激强度等特点,在儿科患者围手术期疼痛管理中具有潜在的应用价值,但目前尚无儿科患者术中应用PPG监测伤害性刺激强度变化的相关报道。本研究旨在探讨应用PPG监测小儿术中伤害性刺激程度变化的可行性。
1 资料和方法 1.1 病例选择本研究由重庆医科大学附属儿童医院伦理委员会审批通过。全部受试者的监护人术前均签署麻醉与监测知情同意书。病例纳入标准:(1) 美国麻醉医师学会(ASA)分级为Ⅰ~Ⅱ级;(2) 年龄2~4岁,性别不限。排除标准:(1) 心血管系统病变;(2) 自主神经系统病变;(3) 正在接受任何血管活性药物。根据纳入标准和排除标准,共纳入择期接受腹腔镜疝修补术的患儿90例。根据麻醉诱导后是否接受舒芬太尼以及接受舒芬太尼的时间顺序将患儿分为A、B、C 3组,每组30例。A组于常规全麻诱导气管插管后、放置气腹针前5 min接受0.1 μg/kg舒芬太尼;B组于全麻诱导气管插管后、放置气腹针后即刻接受0.1 μg/kg舒芬太尼;C组于全麻诱导气管插管后仅放置气腹针,未接受舒芬太尼。
1.2 试验方法患儿进入手术室后,由多功能监护仪(B650 GE Healthcare)监测心电图、无创血压以及血氧饱和度。麻醉诱导时,所有患儿经左手外周静脉通路推注咪达唑仑0.1 mg/kg、戊乙奎醚0.01 mg/kg、舒芬太尼0.6 μg/kg、顺式阿曲库铵0.15 mg/kg,经口插入气管导管行机械通气,呼吸机参数设置:潮气量8 mL/kg,呼吸频率22~26次/min,呼气末正压(positive end expiratory pressure,PEEP) 4 cmH2O (1 cmH2O=0.098 kPa)。全麻诱导气管插管后,通过该监护仪的脉搏氧饱和度探头(Datex-Ohmeda S/5,GE Healthcare)连续采集患儿右手示指处PPG,使用Datex-Ohmeda S/5 Collect Software (GE Healthcare)对采集的数据进行处理。采用Viking Quest表面肌力分析系统(美国尼高力公司)采集腹部肌肉的表面肌电图(surface electromyography,sEMG)。于右侧肘部正中静脉穿刺埋留置针,以备采血。术中麻醉维持采用1%~2%的七氟烷,手术结束前10 min停止使用吸入麻醉药。围手术期液体治疗使用复方电解质,手术室温度维持在22~24 ℃。
A组患儿于气腹针置入前5 min接受舒芬太尼0.1 μg/kg,并将接受舒芬太尼前1 min (即置入气腹针前约6 min,舒芬太尼注射时间短未计入)记为T1,同时B组和C组也将置入气腹针前这一时间点记为T1;A、B、C 3组将置入气腹针后即刻记为T2;B组患儿于置入气腹针后即刻接受舒芬太尼0.1 μg/kg,并将接受舒芬太尼后5 min记为T3,同时A组和C组也将置入气腹针后这一时间点记为T3。
1.3 观察指标监测并记录各组患儿在T1、T2、T3时刻的平均动脉压(MAP)、心率(HR)、肾上腺素和去甲肾上腺素(NE)的血浆浓度、右手示指处的PPG波幅(PPGA;每一时间点采集时间为10 s)。同步记录3组患儿各时间点sEMG最大波幅值,结果取2次检测的平均值。
1.4 统计学处理采用SPSS 17.0软件进行数据分析。计量资料以x±s表示;组内不同时间点间数据的比较用重复测量方差分析,组内两两比较采用SNK检验;同一时间点不同组别间数据的比较采用单因素方差分析,组间两两比较采用SNK检测;直线相关性分析采用Pearson相关分析。计数资料以率表示,组间比较采用χ2检验。检验水准(α)为0.05。
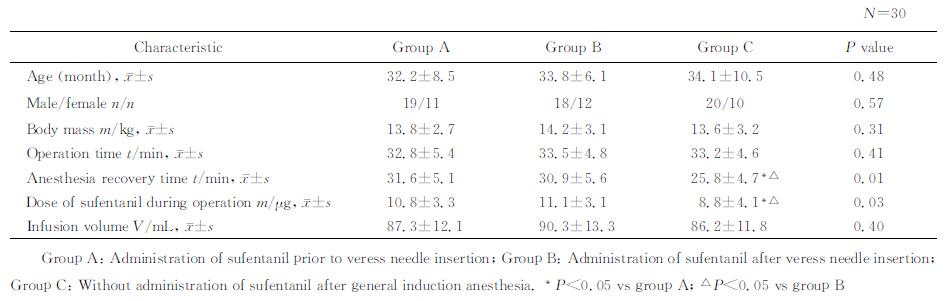
2 结果 2.1 各组患儿一般情况由表 1可见,3组患儿的年龄、性别、体质量、手术时间、输液量差异均无统计学意义。A、B两组患儿术中舒芬太尼用量高于C组(P<0.05),且麻醉复苏时间较C组延长(P<0.05)。
|
|
表 1 纳入研究的3组患儿的临床资料 Tab 1 Characteristics of included child patients in each group |
2.2 各组患儿各时间点PPGA的比较
由表 2可见,A组患儿于放置气腹针前后3个时间点(T1、T2、T3) 的PPGA差异均无统计学意义(P>0.05);B组患儿于放置气腹针后(T2) 的PPGA较放置前(T1) 降低(P<0.05),而给予舒芬太尼后(T3) 的PPGA较T2时间点增加(P<0.05);C组患儿于放置气腹针后(T2和T3) 的PPGA较放置前(T1) 均降低(P<0.05)。B、C两组患儿T2时间点的PPGA均低于A组(P<0.05),C组患儿T3时间点的PPGA低于A、B两组(P<0.05)。
|
|
表 2 各组患儿PPGA、MAP、HR、肾上腺素、NE和sEMG在不同时间点的变化 Tab 2 Changes of PPGA, MAP, HR, epinephrine, NE, and sEMG at different time points in each group |
2.3 各组患儿各时间点MAP和HR的比较
由表 2可见,A组患儿于放置气腹针前后3个时间点(T1、T2、T3) 的MAP及HR差异均无统计学意义(P>0.05);B组患儿的MAP在T1、T2、T3 3个时间点无明显变化(P>0.05),而HR在T2、T3时间点均高于T1时间点(P<0.05);C组患儿T3时间点的MAP高于T2、T1时间点(P<0.05),HR在T2、T3时间点较T1时间点均增高(P<0.05)。B、C两组患儿T2时间点的HR均高于A组(P<0.05),C组T3时间点的MAP及HR均较A、B两组增高(P<0.05)。
2.4 各组患儿各时间点肾上腺素和NE的血浆浓度比较由表 2可见,A组患儿放置气腹针前后3个时间点(T1、T2、T3) 的肾上腺素和NE血浆浓度无明显变化(P>0.05);B组患儿放置气腹针后(T2) 的肾上腺素和NE血浆浓度较放置前(T1) 增高(P<0.05),而接受舒芬太尼后(T3) 肾上腺素和NE血浆浓度较T2降低(P<0.05);C组患儿T2、T3时间点的肾上腺素和NE血浆浓度较T1时间点的增高(P<0.05)。B、C两组患儿T2时间点的肾上腺素和NE血浆浓度均高于A组(P<0.05),C组患儿T3时间点的肾上腺素和NE血浆浓度高于A、B两组(P<0.05)。
2.5 各组患儿各时间点sEMG的比较由表 2可见,A组患儿放置气腹针前后3个时间点(T1、T2、T3) 的sEMG差异无统计学意义(P>0.05);B组患儿于放置气腹针后(T2) 的sEMG较放置前(T1) 增高(P<0.05),而接受舒芬太尼后(T3) 的sEMG较T2时间点均降低(P<0.05);C组患儿T2、T3时间点的sEMG较T1时间点均增高(P<0.05)。B、C两组患儿T2时间点的sEMG均高于A组(P<0.05),C组患儿T3时间点的sEMG高于A、B两组(P<0.05)。
2.6 PPGA与sEMG的相关性Pearson相关分析显示,A、B、C 3组患儿术中PPGA均分别与同组sEMG呈负相关(r=-0.601、-0.512、-0.613,P<0.05)。
3 讨论PPG信号反映被检测部位的血流灌注情况。根据琅伯-比尔定律,PPGA的大小随采集部位血管内血液容积变化而变化[5, 8-9]。术中放置气腹针对患儿是一种伤害性刺激,该刺激可引起术中急性疼痛,而疼痛诱发的神经内分泌应激反应可导致机体释放应激性激素,从而使血管收缩、血容量下降,PPGA也相应减小[10]。本研究通过记录B、C两组患儿在放置气腹针前后的PPGA,发现放置气腹针前的PPGA高于放置气腹针后。舒芬太尼是一种强效的阿片类镇痛药,能有效减轻伤害性刺激导致的应激反应,减少应激性激素的释放,给药后其在体内到达药峰效应的时间约为5 min[11]。在本研究中,A组患儿给予舒芬太尼前后的PPGA与应激性激素肾上腺素和NE的血浆浓度没有明显变化;B、C两组患儿放置气腹针前后的PPGA与应激性激素肾上腺素和NE血浆浓度变化差异有统计学意义,给予舒芬太尼5 min后的PPGA较放置气腹针即刻升高,而应激性激素肾上腺素和NE血浆浓度变化则与之相反。说明在未追加舒芬太尼镇痛的情况下,B、C两组患儿的PPGA与应激性激素肾上腺素、NE的血浆浓度在气腹针放置前后的差异有统计学意义。A组患儿在追加舒芬太尼后,放置气腹针所引起的伤害性刺激对PPGA与应激性激素肾上腺素、NE血浆浓度的影响小于B、C两组。B组患儿在追加舒芬太尼后,患儿的伤害性刺激强度减轻,刺激强度的减轻使应激性激素释放减少、交感神经张力下降以及血管舒张、血容量增加,PPGA又会随着采集部位血管内血液对PPG信号吸收的增加而变大。上述分析结果表明放置气腹针与使用舒芬太尼可以引起应激性激素肾上腺素和NE血浆浓度的变化,而应激性激素水平变化导致的血流动力学改变可以通过量化的PPGA呈现。
肌电活动的平均波幅主要用来描述特定时间内肌电活动的平均水平,肌肉的收缩强度越大肌电图的幅度越大。肌电图的平均波幅在一定程度上可以反映患儿的疼痛程度[12]。在本研究中,我们对腹部肌肉的sEMG与PPGA进行直线相关分析,结果表明PPGA分别与同组sEMG呈负相关(P<0.05)。
在临床上,麻醉医师常常把血压和HR作为间接评价术中疼痛程度的基本指标。本研究中,B、C两组患儿T1与T2时间点的MAP差异无统计学意义,B组患儿T3时间点与T2时间点HR差异也无统计学意义。这些结果表明各组患儿的血压和HR在放置气腹针前后以及追加镇痛药物前后的部分时间点并没有表现出相应的变化,其原因可能是,除了疼痛本身外,还有其他因素影响血压和HR。而在本研究中,各组PPGA在放置气腹针前后以及追加舒芬太尼前后都发生了变化,表明PPG技术在监测术中伤害性刺激强度时具有更好的准确性和实时性。
本研究中,A、B两组患儿舒芬太尼的用量与麻醉恢复时间均高于C组。这个结果正好反映了目前麻醉医师在围手术期阿片类药物使用时面临的难点。由于目前缺乏实时监测患者术中伤害性刺激强度的相关工具以及阿片类药物使用的个体差异,麻醉医师在围手术期使用镇痛药物时更多依靠临床经验。阿片类药物使用过量,虽然获得满意的术后镇痛效果,但其不良反应会延长患者的麻醉苏醒时间并导致其他相关并发症;相反,镇痛不足则导致患者术后急性疼痛并影响其麻醉苏醒质量甚至术后康复时间[13-14]。患儿术中的PPG信号本身就是实时的生物信号,其在各时间点的动态变化能够向麻醉医师及时反馈患儿术中的伤害性刺激强度,为围手术期目标化疼痛管理提供参考。
综上所述,在小儿腹腔镜疝修补术中,PPG信号可以量化患儿术中伤害性刺激强度的变化,有潜在的临床应用前景。PPG信号是来自人体血管内的生物电信号,易受到各种外界因素的影响,如环境温度、术中电刀的使用以及心血管系统疾病等。本研究在样本和手术类型的选择上受限较多,使试验结果有一定的局限性。然而本研究首次将PPG技术用于监测小儿围手术期伤害性刺激强度的变化,为疼痛的精确化诊疗提供了一个新的方向,随着PPG信号稳定性以及分析技术的不断进步,围手术期PPG信号的变化还可以指导麻醉医师制定合理的镇痛方案。
| [1] | CONG X, MCGRATH J M, CUSSON R M, ZHANG D. Pain assessment and measurement in neonates: an updated review[J]. Adv Neonatal Care, 2013, 13: 379–395. DOI: 10.1097/ANC.0b013e3182a41452 |
| [2] | KOST-BYERLY S, CHALKIADIS G. Developing a pediatric pain service[J]. Paediatr Anaesth, 2012, 22: 1016–1024. DOI: 10.1111/pan.2012.22.issue-10 |
| [3] | RUSSELL P, VON UNGERN-STERNBERG B S, SCHUG S A. Perioperative analgesia in pediatric surgery[J]. Curr Opin Anaesthesiol, 2013, 26: 420–407. DOI: 10.1097/ACO.0b013e3283625cc8 |
| [4] | TWIJNSTRA A R H, DAHAN A, KUILE M M T, JANSEN F W. Nociceptive and stress hormonalstate during abdominal laparoscopic and vaginal hysterectomy as predictors of ostoperative pain perception[J]. Gynecol Surg, 2012, 10: 45–50. |
| [5] | COLOMBO R, MARCHI A, BORGHI B, FOSSALI T, RECH R, CASTELLI A, et al. Pulse photoplethysmographic analysis estimates the sympathetic activity directed to heart and vessels[J]. Anesthesiology, 2015, 123: 336–345. DOI: 10.1097/ALN.0000000000000712 |
| [6] | PENG L, YU S Y, WEI W, GONG Q, GAO B. Assessment of postoperative pain intensity by using photoplethysmography[J]. J Anesth, 2014, 28: 846–853. DOI: 10.1007/s00540-014-1837-3 |
| [7] | HAMUNEN K, KONTINEN V, HAKALA E, TALKE P, PALOHEIMO M, KALSO E. Effect of pain on autonomic nervous system indices derived from photoplethysmography in healthy volunteers[J]. Br J Anaesth, 2012, 108: 838–844. DOI: 10.1093/bja/aes001 |
| [8] | KORHONEN I, YLI-HANKALA A. Photoplethysmography and nociception[J]. Acta Anaesthesiol Scand, 2009, 53: 975–985. DOI: 10.1111/aas.2009.53.issue-8 |
| [9] | BLANIÉ A, SOUED M, BENHAMOU D, MAZOIT J X, DURANTEAU J. A comparison of photoplethysmography versus esophageal doppler for the assessment of cardiac index during major noncardiac surgery[J]. Anesth Analg, 2016, 122: 430–436. DOI: 10.1213/ANE.0000000000001113 |
| [10] | TAKEYAMA M, MATSUNAGA A, KAKIHANAL Y, MASUDA M, KYNIYOSHI T, KANMURA Y. Impact of skin incision on the pleth variability index[J]. J Clin Monit Comput, 2011, 25: 215–221. DOI: 10.1007/s10877-011-9298-9 |
| [11] | DEUTZ P, LYONS D I. Opioid analgesia for acute abdominal pain in children: a systematic review and meta-analysis[J]. Acad Emerg Med, 2014, 21: 1183–1192. DOI: 10.1111/acem.2014.21.issue-11 |
| [12] | 张杰, 李进让, 刘涛. 吞咽表面肌电图评估扁桃体切除术后患者疼痛程度[J]. 山东大学耳鼻喉眼学报, 2014, 28: 57–60. DOI: 10.6040/j.issn.1673-3770.0.2014.153 |
| [13] | EDRY R, RECEA V, DIKUST Y, DIKUST Y, SESSLER D I. Preliminary intraoperative validation of the nociception level index[J]. Anesthesiology, 2016, 125: 193–203. DOI: 10.1097/ALN.0000000000001130 |
| [14] | WORLEY A, FABRIZI L, BOYD S, SLATER R. Multi-modal pain measurements in infants[J]. J Neurosci Methods, 2012, 205: 252–257. DOI: 10.1016/j.jneumeth.2012.01.009 |
 2017, Vol. 38
2017, Vol. 38