2. 河北医科大学附属哈励逊国际和平医院重症医学科, 衡水 053000
2. Department of Critical Care Medicine, Harrison International Peace Hospital Affiliated to Hebei Medical University, Hengshui 053000, Hebei, China
脓毒症(sepsis)是由感染引起的全身炎性反应综合征(systemic inflammatory response syndrome, SIRS),是严重创伤、感染、休克、大手术后常见的并发症,进一步发展可导致脓毒性休克及多脏器功能障碍综合征(multiple organ dysfunction syndrome, MODS)。心肌损伤是脓毒症的常见并发症,合并心功能障碍的脓毒症患者的病死率高达70%[1-2]。N-末端脑钠肽前体(N-terminal pro-brain natriuretic peptide, NT-proBNP)水平是危重病患者发生死亡事件的独立危险因素[3]。近年来,氧化应激作为脓毒症心肌损伤的发病机制之一,引起临床医师的广泛关注[4]。舒血宁是一种较强的自由基清除剂,它可以清除体内的氧自由基,抑制细胞脂质发生过氧化反应而保护细胞膜[5]。本研究通过比较舒血宁治疗前后严重脓毒症心肌损伤患者血NT-proBNP及氧化应激水平的变化,评价舒血宁在脓毒症患者心肌损伤保护中的早期应用价值。
1 资料和方法 1.1 研究对象及分组选择我院重症医学科和急诊重症监护病房(EICU) 2013年3月至2016年6月收治的102例严重脓毒症伴心肌损伤患者作为研究对象,其中男性54例、女性48例,年龄45~68岁,平均(58.04±7.32) 岁,所有入组患者诊断标准均符合中华医学会重症医学分会(2014版)有关脓毒症、严重脓毒症及脓毒性休克诊断标准[6]和存在心肌损伤的诊断标准[7]。排除标准:(1) 住院时间<72 h;(2) 严重肝肾功能损伤;(3) 症状性心力衰竭;(4) 瓣膜性心脏病;(5) 急性冠状动脉综合征;(6) 心肺复苏术后;(7) 心脏手术后;(8) 肿瘤晚期、妊娠、外伤、免疫缺陷病及近3个月内使用过激素或免疫抑制剂的患者。所有患者按照随机数字表法分为两组。对照组51例,其中男性26例、女性25例,年龄45~68岁,平均(57.32±6.87) 岁,其中死亡5例(第4天1例,第5天1例,第8天2例,第11天1例);治疗组51例,男性28例、女性23例,年龄50~62岁,平均(58.76±7.77) 岁,其中死亡1例(第10天)。
入选患者均被告知本研究目的和治疗方案,且自愿参加;本研究方案经医院伦理委员会批准,符合伦理学相关要求,并获得患者家属知情同意。
1.2 治疗方法入院后对照组患者按严重脓毒症/脓毒性休克治疗指南(2014) 行常规治疗,包括治疗原发病,早期应用抗菌药物、液体复苏、脏器功能支持(不包括与舒血宁相同或拮抗作用的药物)、5%葡萄糖注射液250 mL,每天1次静脉滴注等治疗;治疗组在对照组治疗基础上加用舒血宁注射液(黑龙江省珍宝岛药业有限公司,国药准字Z23022004)20 mL,加入5%葡萄糖注射液250 mL,每天1次静脉滴注,连用14 d。
1.3 检测指标及检测方法入院时采用全数字心脏彩色多普勒超声诊断仪(GE公司VIVID7型,美国)检测患者的左室射血分数(left ventricular ejection fraction, LVEF),并在治疗前(入院时)及治疗后(入院后)6 h、72 h检查患者全导心电图,明确有无心肌缺血改变;患者均于治疗前(入院时)及治疗后(入院后)6 h、72 h采肘静脉血10 mL,3 310×g离心10 min,并分离提取血清后置于-80 ℃冰箱备用,检测肌钙蛋白Ⅰ (cardiac troponin Ⅰ,cTnⅠ)变化(日立公司7600型全自动生化分析仪,日本);酶联免疫分析法检测丙二醛(malondialdehyde, MDA)水平及超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性(南京建成生物工程研究所生产的试剂盒);检测NT-proBNP和血心型脂肪酸结合蛋白(heart-type fatty acid binding protein,hFABP)变化(ReLIA生物科技公司SSJ-2型多功能免疫检测仪,美国),试剂盒选择配套产品,检测范围分别为200~15 000 pg/mL和2~60 ng/mL,严格按试剂盒说明书操作。记录治疗前和治疗后14 d患者急性生理学和慢性健康状况评分Ⅱ(APACHE Ⅱ)、ICU住院时间及28 d患者生存情况。
1.4 统计学处理应用SPSS 17.0统计软件进行数据分析,计量资料以x±s表示,用重复测量的方差分析或单因素方差分析,组间比较采用t检验及χ2检验。检验水准(α)为0.05。
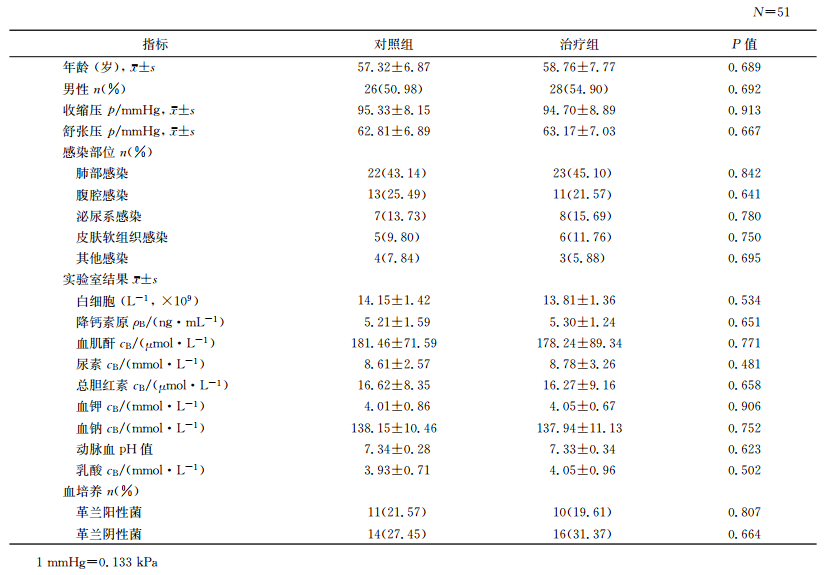
2 结果 2.1 两组脓毒症患者一般资料比较两组患者的年龄、性别、血压、感染部位、血常规、降钙素原、肝肾功能、电解质、动脉血pH值、血乳酸和血培养等差异无统计学意义(P>0.05,表 1)。
|
|
表 1 两组脓毒症患者一般资料比较 |
2.2 两组脓毒症患者观察指标比较
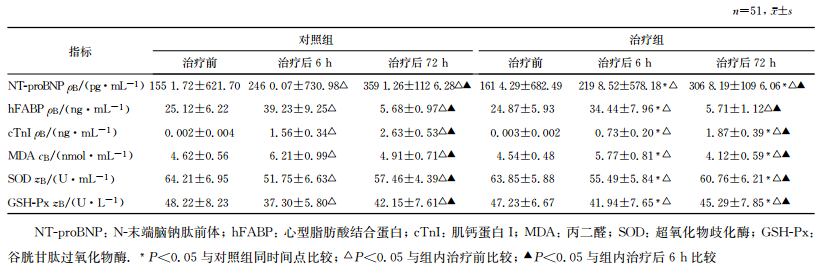
治疗前两组患者NT-proBNP、hFABP、cTnⅠ、MDA、SOD及GSH-Px各指标比较,差异无统计学意义(P>0.05)。治疗后6 h,治疗组患者NT-proBNP、hFABP、cTnⅠ和MDA水平均低于对照组,SOD和GSH-Px活性均高于对照组,差异有统计学意义(P<0.05);两组患者NT-proBNP、hFABP、cTnⅠ和MDA水平均较组内治疗前升高,SOD和GSH-Px活性均较组内治疗前降低(P<0.05)。治疗后72 h,两组hFABP和MDA水平均较治疗后6 h降低,NT-proBNP、cTnⅠ水平和SOD、GSH-Px活性均较治疗后6 h升高,差异有统计学意义(P<0.05)。治疗后72 h,对照组NT-proBNP、cTnⅠ和MDA水平均高于治疗组,SOD和GSH-Px活性均低于治疗组,差异有统计学意义(P<0.05),两组hFABP水平比较差异无统计学意义(P>0.05)。见表 2。
|
|
表 2 两组脓毒症患者观察指标比较 |
2.3 两组脓毒症患者治疗前后APACHEⅡ评分、LVEF、ICU住院时间及28 d病死率比较
治疗前两组患者APACHEⅡ评分及LVEF比较在两组间的差异无统计学意义(P>0.05)。两组患者治疗后APACHEⅡ评分均较治疗前改善(P<0.05),治疗组优于对照组(P<0.05);而两组的LVEF在治疗后比较,差异无统计学意义(P>0.05)。两组间ICU住院时间的差异也无统计学意义(P>0.05)。治疗组患者28 d病死率低于对照组,差异有统计学意义(P<0.05)。见表 3。
|
|
表 3 两组脓毒症患者APACHEⅡ评分、LVEF、ICU住院时间及28 d病死率比较 |
3 讨论
脓毒症具有很高的发病率和病死率,心脏是最易受损的器官之一,随着病情的进展,可出现心功能障碍、LVEF降低、心肌抑制等并发症,其发生率约为50%[4, 8]。心肌损伤是导致脓毒症休克和多器官功能衰竭的重要原因,是影响脓毒症患者预后的重要因素。因此,早期实施有效的干预措施,做到早诊断早治疗成为降低脓毒症患者病死率的关键。舒血宁注射液是为银杏叶提取物制剂,主要成分为银杏黄酮苷、银杏内酯和白果内酯等,具有清除自由基,降低毛细血管通透性、抑制血小板聚集、增加红细胞的变形能力、改善微循环、增加血流量作用[9]。此外,它还有调节机体细胞免疫活性及抑制炎性细胞因子的释放、降低细胞因子水平等作用[10],目前被广泛用于脑血管疾病和心肌缺血疾病等的治疗,因此,理论上舒血宁注射液可以减轻脓毒症诱发的心肌损伤。本研究观察了给予舒血宁治疗后早期心肌损伤指标及氧化应激水平的变化,结果显示脓毒症心肌损伤患者在早期给予舒血宁治疗后,治疗组患者NT-proBNP、hFABP、cTnⅠ、MDA水平及APACHEⅡ评分较对照组降低(P<0.05),SOD、GSH-Px活性较对照组升高(P<0.05)。LVEF较治疗前有改善(P<0.05)。
研究发现,临床上严重感染和感染性休克患者血浆中NT-proBNP的水平普遍升高,是早期心功能损害的敏感标志物[11]。近年来的研究认为,NT-proBNP可以作为脓毒症病情严重程度判定的实验室指标[12]。hFABP是存在于心肌细胞胞质内的可溶性蛋白质,当心肌细胞受损时,hFABP可快速释放至血液中,1~3 h即开始升高,4~8 h达到峰值,12~24 h恢复正常水平,是评估心肌受损的良好指标[13]。本研究亦发现,在患者发病3 h内(治疗前)hFABP已经升高,治疗6 h高于治疗前,治疗72 h即降至正常水平。cTnⅠ在缺血性心肌中是公认的最敏感和最特异的心肌损伤标志物,亦可以用来评价脓毒症患者的心肌损伤程度和左室功能[14]。脓毒症心肌损伤发病早期便可检测出NT-proBNP和hFABP的表达,这对提高脓毒症心肌损伤的诊断率有重要意义。
脓毒症心肌损伤表现为心肌收缩力下降、LVEF降低、外周血管扩张、可逆性的双心室扩张[15],关于脓毒症时心肌损伤的许多机制已经阐明[4],如炎症因子作用、活性氧(reactive oxygen species, ROS)的产生、心肌能量代谢障碍、肾素-血管紧张素-醛固酮系统(RAAS)、补体系统激活等,其中氧自由基损伤是重要的机制之一。SOD是存在于细胞内的天然抗氧化剂,能清除超氧阴离子、自由基,其活性能间接反映机体清除自由基的能力。MDA是脂质过氧化的共同产物,可反映机体内的脂质过氧化的程度,间接反映细胞损伤的程度。GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解的酶,可判断机体抗过氧化的能力[16],所以在脓毒症心肌损伤的治疗过程中,加强抗氧化应激治疗有助于改善患者心功能,提高临床治疗效果。本研究结果显示,在治疗后6 h和72 h,治疗组患者MDA水平明显低于对照组,SOD及GSH-Px活性均高于对照组(P<0.05),提示舒血宁注射液能抑制严重脓毒症患者体内氧自由基的释放,增强清除氧自由基的酶的活性,对心肌细胞起到保护作用。目前APACHEⅡ评分系统是国际上反映危重症病情严重程度的良好指标之一,在危重病的病情评估和预后判断中已广泛应用,多进行APACHEⅡ评分动态变化来预测患者病死率[17],心脏超声(ultrasonic cardiography, UCG)是评估脓毒症心肌损伤的金标准,UCG获得的LVEF是反映脓毒性心功能不全的主要指标[18]。故本研究通过检测治疗前后LVEF和APACHEⅡ评分的变化评价舒血宁注射液在脓毒症心肌损伤中的作用,结果显示,给予舒血宁治疗能降低APACHEⅡ评分,可改善LVEF。
综上所述,严重脓毒症心肌损伤患者早期给予舒血宁治疗,能改善组织缺氧,使NT-proBNP、hFABP、cTnⅠ水平及APACHEⅡ评分降低明显,从而进一步改善患者LVEF,改善心功能,这种心脏保护作用机制可能与其降低氧化应激水平有关,一方面,通过增加ROS清除酶SOD和GSH-Px的活性从而增强机体清除氧自由基的能力,另一方面,通过减少MDA的生成从而减轻其对心肌的损伤作用。因此,常规治疗基础上加用舒血宁注射液治疗能对严重脓毒症患者的心功能起到改善作用,在脓毒症心肌损伤不可逆损伤出现之前,改善心肌供血,使受损心肌细胞尽早恢复,降低心肌损伤程度,能改善心功能,防止恶性事件发生,提高患者生存率、运动耐力及生存质量,值得临床推广应用。但本研究病例数量有限,仍需增加样本量、多中心的临床研究进一步证实。
| [1] | KAKIHANA Y, ITO T, NAKAHARA M, YAMAGUCHI K, YASUDA T. Sepsis-induced myocardial dysfunction: pathophysiology and management[J]. J Intensive Care, 2016, 4: 22. DOI: 10.1186/s40560-016-0148-1 |
| [2] | CIMOLAI M C, ALVAREZ S, BODE C, BUGGER H. Mitochondrial mechanisms in septic cardiomyopathy[J]. Int J Mol Sci, 2015, 16: 17763–17778. DOI: 10.3390/ijms160817763 |
| [3] | 刘娟, 张熙春, 刘运东, 王兵, 王勇强. 重症监护病房患者血清N末端B型利钠肽水平对预后评估的意义[J]. 中华危重病急救医学, 2014, 26: 489–492. DOI: 10.3760/cma.j.issn.2095-4352.2014.07.009 |
| [4] | 张晓凡, 李莉. 脓毒症心肌损伤机制研究及治疗进展[J]. 中华急诊医学杂志, 2015, 24: 339–341. DOI: 10.3760/cma.j.issn.1671-0282.2015.03.027 |
| [5] | 李伟, 李敬, 王霞, 李佳, 刘晓婷, 褚永果, 等. 舒血宁对急性重度一氧化碳中毒患者心型脂肪酸结合蛋白水平的影响[J]. 中国全科医学, 2016, 19: 545–548. DOI: 10.3969/j.issn.1007-9572.2016.05.012 |
| [6] | 中华医学会重症医学分会. 中国严重脓毒症/脓毒性休克治疗指南(2014)[J]. 中华危重病急救医学, 2015, 27: 401–426. DOI: 10.3760/j.issn.2095-4352.2015.06.001 |
| [7] | LEVY M M, FINK M P, MARSHALL J C, ABRAHAM E, ANGUS D, COOK D, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J]. Crit Care Med, 2003, 31: 1250–1256. DOI: 10.1097/01.CCM.0000050454.01978.3B |
| [8] | JACOB J A. New Sepsis diagnostic guidelines shift focus to organ dysfunction[J]. JAMA, 2016, 315: 739–740. DOI: 10.1001/jama.2016.0736 |
| [9] | 李敬, 李颖, 王荣霞, 朱保月, 刘晓婷, 孔繁托, 等. 舒血宁联合磷酸肌酸钠对一氧化碳中毒患者缺血修饰白蛋白的影响[J]. 中国药物与临床, 2015, 15: 1402–1404. |
| [10] |
毛燕飞, 孙璐璐, 廖兴志, 邓小明. 舒血宁对脓毒症大鼠心肌的保护作用[J]. 第二军医大学学报, 2011, 32: 175–178.
MAO Y F, SUN L L, LIAO X Z, DENG X M. Protective effects of Shuxuening injection on myocardial injury in rats with sepsis[J]. Acad J Sec Mil Med Univ, 2011, 32: 175–178. |
| [11] | JENSEN J, MA L P, BJURMAN C, HAMMARSTEN O, FU M L. Prognostic values of NT-proBNP/BNP ratio in comparison with NT-proBNP or BNP alone in elderly patients with chronic heart failure in a 2-year follow-up[J]. Int J Cardiol, 2012, 155: 1–5. DOI: 10.1016/j.ijcard.2011.01.083 |
| [12] | 苏琴, 张宪, 姚亚宾, 陈丽萍, 高诗博, 刘东昇, 等. 老年脓毒症患者血浆氨基末端脑钠肽前体和肌钙蛋白Ⅰ的临床价值[J]. 中华急诊医学杂志, 2013, 22: 1379–1382. DOI: 10.3760/cma.j.issn.1671-0282.2013.12.018 |
| [13] | 张健, 李春盛. 心型脂肪酸结合蛋白在心梗患者行介入治疗中的意义[J]. 中华急诊医学杂志, 2013, 22: 612–615. DOI: 10.3760/cma.j.issn.1671-0282.2013.06.014 |
| [14] | 郭俊, 王夜明. 脓毒症患者血清降钙素原与心肌肌钙蛋白Ⅰ的水平的相关性研究[J]. 中国中西医结合急救杂志, 2015, 22: 527–530. DOI: 10.3969/j.issn.1008-9691.2015.05.019 |
| [15] | RUDIGER A, SINGER M. The hear in sepsis: from basic mechanisms to clinical management[J]. Curr Vasc Pharmacol, 2013, 11: 187–195. |
| [16] | 寇秋野, 管向东, 王丽纯, 张晓菲, 陈雷, 胡文利, 等. ω-3鱼油脂肪乳对脓毒症患者氧化应激指标的影响[J]. 中国急救医学, 2011, 31: 238–240. |
| [17] | NAVED S A, SIDDIGUI S, KHAN F H. APACHE-Ⅱ score correlation with mortality and length of stay in an intensive care unit[J]. J Coll Physicians Surg Pak, 2011, 21: 4–8. |
| [18] | 李真玉, 陈兵, 李广平. 脓毒症心肌抑制的诊治进展[J]. 中国循环杂志, 2015, 30: 705–707. DOI: 10.3969/j.issn.1000-3614.2015.07.021 |
 2017, Vol. 38
2017, Vol. 38