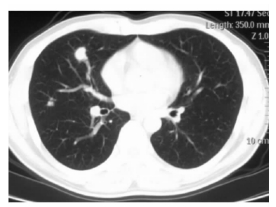
患者,男,38岁。因“体检发现右肺结节6 d”于2016年1月8日入住我院。患者于2年前因右侧胸痛于当地医院就诊,胸部CT提示双肺结节进行性增大,考虑肺部真菌感染,予以口服抗真菌药物治疗2个月,复查肺部结节无进一步发展,故每隔半年复查1次。2016年1月2日于当地医院复查CT提示右中肺结节。2016年1月6日至另一医院检查CT提示:肺窗示右肺中叶内侧段有一分叶状肿块,截面大小约1.5 cm×1.6 cm,密度均匀,边缘呈毛刺状,纵隔窗示肿块平扫CT值60 HU,病灶内下缘见血管影相连,灶内未见钙化灶,两肺同时见多发大小不一的小结节(图 1),诊断为右肺中叶周围型肺癌并两肺多发转移瘤。入我院后体格检查未见明显体表淋巴结肿大,未见皮肤红斑等异常体征。入院检查:血常规及肺功能均正常,B超检查示肝脏、胆囊、胰腺、肾脏及肾上腺未见明显异常,头颅CT平扫未见明显异常。自发病以来,患者偶有胸痛、干咳,无咯血、胸闷、气急,精神状态良好,体力情况良好,食欲、食量及睡眠情况正常,体质量无明显变化,大、小便正常。自述无吸烟、饮酒史,无二手烟接触史,职业中有粉尘接触史。2016年1月12日于全麻胸腔镜下行右肺中叶切除术。
|
图 1 CT扫描示双肺多发结节 |
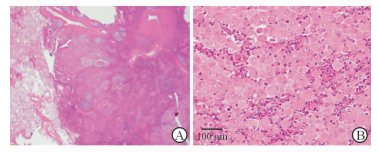
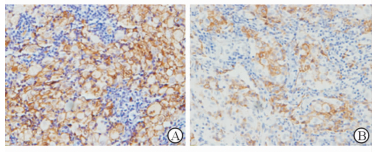
术后病理检查:(1) 大体观察见右肺中叶切除标本1个,大小12 cm×7 cm×2 cm,距支气管断端2 cm紧邻胸膜下见一灰白色结节,直径1.5 cm,另距支气管断端3 cm、胸膜下0.3 cm处见另一灰白色结节,直径0.6 cm,两结节切面均为灰白色、实性、质硬,与周围组织界限尚清。(2) H-E染色镜下观察可见右肺中叶肺组织内界限尚清、呈结节状生长的肿瘤组织,肿瘤细胞中等大小,胞质丰富,微嗜酸性,细胞核扭曲,可见核沟、折叠、凹陷或呈分叶状,核膜较薄,染色质细腻,部分细胞可见小核仁,背景中可见嗜酸粒细胞、中性粒细胞、组织细胞、小淋巴细胞浸润,局部可见纤维化(图 2A、2B)。(3) 免疫组织化学染色示肿瘤细胞S-100(图 3A)、CD1α(图 3B)、Langerin(CD207)、CD68、Lysozyme、CD11c、CD163阳性,Ki-67指数约10%,细胞角蛋白(CK)5/6、抗CK单克隆抗体(CAM)5.2、上皮膜抗原(EMA)、甲状腺转录因子1(TTF-1)、Chromogranin A、Synaptophysin、CD21、CD35阴性。病理诊断:(右肺中叶)朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)。患者术后随访12个月,未发现复发与转移。
|
图 2 H-E染色示肺部朗格汉斯细胞大量增殖并形成肉芽肿(A),部分朗格汉斯细胞核可见核沟(B) Original magnification: ×20 (A) |
|
图 3 免疫组织化学染色结果显示肿瘤细胞S-100(A)和CD1α(B)阳性(SP法) Original magnification: ×400 |
2 讨论
1868年,Langerhans首先描述了在表皮中存在一种非色素性细胞,这种细胞来源于骨髓并在免疫反应中发挥重要作用,是一种树突状细胞[1]。LCH患者朗格汉斯细胞过度活化、异常增殖,可累及多个系统器官,包括骨、皮肤、肝、脾和淋巴结等[2-3]。肺朗格汉斯细胞组织细胞增生症(pulmonary Langerhans cell histiocytosis,PLCH)为LCH的一种类型,可以仅发生于肺部,也可是全身系统病变的一部分[4]。迄今为止,我国单独肺受累的LCH报道少见,患者多伴发其他系统相关损害[5]。儿童及成年人均可发病,以儿童发病多见,发生在成人肺部的LCH发病高峰年龄段为20~40岁,约90%与吸烟有关[6]。患者可有咳嗽、呼吸困难、胸痛、乏力、发热、消瘦等临床表现,常由于呼吸系统症状接受影像学检查,显示为肺部的囊腔及结节状病变。在本例中,患者为38岁男性,起病症状不甚典型,仅有干咳、胸痛的表现,以“肺部真菌感染”在外院治疗,无明显肺部体征,仅胸部有结节样的影像学表现,尚未发现其他脏器受累。患者自诉无吸烟及二手烟接触史,但职业有粉尘接触史。有研究认为吸烟相关性PLCH是一种对刺激的反应性增生性病变[7],在此我们认为该患者对粉尘的接触可能是导致其发病的重要因素之一。
PLCH患者的影像学检查对其诊断有重要意义。有文献报道,在疾病的初期,影像学常显示为肺部的多发小结节,随着病变的进展,逐渐出现厚壁囊腔及薄壁囊腔,薄壁囊腔可相互融合,晚期肺组织内可发生纤维化或形成肺大泡,有时可呈肺气肿或蜂窝肺样表现,各期病变可同时存在[8-10]。本例患者病程较长,影像学表现呈双肺多发结节,未见明显囊腔形成,易误诊为恶性肿瘤,需经病理活检确诊。
1983年Colby等[11]对该病的组织学特点作了详尽的描述,光镜发现朗格汉斯细胞大量增生并形成肉芽肿,是PLCH的特征性改变。光镜观察可将病变分为3期:富于细胞期、增生期、愈合或纤维化期。肉芽肿早期往往以细支气管为中心,并见多少不等的嗜酸性粒细胞、淋巴细胞、浆细胞、中性粒细胞浸润,部分病例可见合体多核巨细胞,甚至形成嗜酸性脓肿。随着疾病的进展,肉芽肿逐渐破坏细支气管壁,形成囊腔,朗格汉斯细胞减少,肺间质可见纤维化及慢性炎症细胞浸润,最终形成纤维瘢痕,朗格汉斯组织细胞少见,细支气管可以阻塞并继发性扩张形成囊腔,间质可有纤维化及肺气肿、肺大泡甚至形成蜂窝肺[12-13]。在大多数PLCH病例中,细胞温和,具有不规则扭曲的细胞核,可见核沟或“咖啡豆样”核,免疫组织化学染色CD1α、Langerin(CD207)、S-100染色阳性可证实[14-15],电镜下发现朗格汉斯细胞胞质内棒状、网球拍状Birbeck颗粒或冰冻切片OKT6抗原阳性,更能充实诊断[16]。
本病需要与以下疾病相鉴别。(1) 巨细胞癌(giant cell carcinoma):镜下肿瘤由多形性巨细胞组成,瘤细胞多巨大,胞质丰富、嗜酸性,核奇异,呈多核或多叶状,肿瘤细胞失去黏附性,可见大量的中性粒细胞浸润,常见白细胞伸入运动现象。免疫组化CK、vimentin、癌胚抗原(CEA)阳性,TTF-1也可阳性。(2) 朗格汉斯细胞肉瘤(Langerhans cell sarcoma, LCS):可为原发,亦可由LCH进展而来,镜下可见明确恶性细胞学特征的大细胞,染色质显著异常,核仁清晰,偶可见LCH样的核沟。免疫表型与LCH一致,均表达S-100和CD1α,Ki-67指数为10%~60%,较LCH表达高。(3) Rosai-Dorfman病:镜下可见较多的S-100阳性的组织细胞,细胞有淡嗜酸性丰富的胞质,核圆形或卵圆形,核仁清楚,有时可见双核及异型核,胞质内常见淋巴细胞吞噬现象及伸入运动,嗜酸粒细胞少见。CD-1α阴性,电镜下无Birbeck颗粒。(4) 嗜酸性肺炎(eosinophlic pneumonia, EP):镜下见肺泡腔内渗出物中含大量嗜酸粒细胞,间质内除嗜酸粒细胞浸润外还可有淋巴细胞和浆细胞浸润。免疫组化染色嗜酸性肺炎巨噬细胞S-100阴性。(5) 脱屑性间质性肺炎(desquamative interstitial pneumonia, DIP):镜下见肺泡腔内巨噬细胞聚集,呈弥漫均匀一致分布,肺泡间隔轻-中度纤维性增厚,炎症轻微,仅有少量炎性细胞浸润并以淋巴细胞为主,Ⅱ型肺泡上皮增生,沿增厚的肺泡间隔分布,有时可见细支气管纤维化和轻度炎症。
对PLCH的治疗首先劝诫患者戒烟,尽管个别文献报道部分患者在未戒烟的状态下CT检查显示其病变有所缓解[17],但大部分患者是在戒烟后症状趋于稳定或好转,影像学示病变部分或完全缓解[18-19]。肺部病变持续存在或病情进展者予以激素治疗,激素治疗6个月后若病情进展者予以全身化疗[20]。成人PLCH患者的生存率较正常人群降低,经数年的病程进展,最终发生呼吸衰竭死亡。
综上,PLCH罕见,当其胸部CT检查影像学不典型时容易误诊,若见多发肺部结节及囊腔时,应该引起足够的重视,联想到本病的可能,确诊本病需做病理学活组织检查,结合组织学形态及免疫组织化学结果,以早期诊断和给予患者适当的治疗。
| [1] | LANGERHANS P. Uber die Nerven der menschlichen Haut[J]. Arch Pathol Anat, 1868, 44: 325–337. DOI: 10.1007/BF01959006 |
| [2] | ARICÓ M, EGELER R M. Clinical aspects of Langerhans cell histiocytosis[J]. Hematol Oncol Clin North Am, 1998, 12: 247–258. DOI: 10.1016/S0889-8588(05)70508-6 |
| [3] | NÉEL A, ARTIFONI M, DONADIEU J, LORILLON G, HAMIDOU M, TAZI A. Langerhans cell histiocytosis in adults[J]. Rev Med Interne, 2015, 36: 658–667. DOI: 10.1016/j.revmed.2015.04.015 |
| [4] | ARICÒ M, GIRSCHIKOFSKY M, GÉNÉREAU T, KLERSY C, McCLAIN K, GROIS N, et al. Langerhans cell histiocytosis in adults. Report from the International Registry of the Histiocyte Society[J]. Eur J Cancer, 2003, 39: 2341–2348. DOI: 10.1016/S0959-8049(03)00672-5 |
| [5] | 魏建国, 赵芳, 孙爱静, 孟春琴. 单独肺受累的成人肺朗格汉斯细胞组织细胞增生症1例[J]. 国际呼吸杂志, 2014, 34: 635–636. DOI: 10.3760/cma.j.issn.1673-436X.2014.08.017 |
| [6] | VASSALLO R, RYU J H, SCHROEDER D R, DECKER P A, LIMPER A H. Clinical outcomes of pulmonary Langerhans'-cell histiocytosis in adults[J]. N Engl J Med, 2002, 346: 484–490. DOI: 10.1056/NEJMoa012087 |
| [7] | CAMINATI A, HARARI S. Smoking-related interstitial pneumonias and pulmonary Langerhans cell histiocytosis[J]. Proc Am Thorac Soc, 2006, 3: 299–306. DOI: 10.1513/pats.200512-135TK |
| [8] | 夏秀梅, 范丽, 张明贵. 肺朗格汉斯细胞组织细胞增生症的CT表现并文献复习[J]. 临床放射学杂志, 2013, 32: 1830–1833. |
| [9] | NAIR A, HANSELL D M. High-resolution computed tomography features of smoking-related interstitial lung disease[J]. Semin Ultrasound CT MR, 2014, 35: 59–71. DOI: 10.1053/j.sult.2013.10.005 |
| [10] | CASTOLDI M C, VERRIOLI A, DE JULI E, VANZULLI A. Pulmonary Langerhans cell histiocytosis: the many faces of presentation at initial CT scan[J]. Insights Imaging, 2014, 5: 483–492. DOI: 10.1007/s13244-014-0338-0 |
| [11] | COLBY T V, LOMBARD C. Histiocytosis X in the lung[J]. Hum Pathol, 1983, 14: 847–856. DOI: 10.1016/S0046-8177(83)80160-9 |
| [12] | KAMBOUCHNER M, BASSET F, MARCHAL J, UHL J F, HANCE A J, SOLER P. Three-dimensional characterization of pathologic lesions in pulmonary Langerhans cell histiocytosis[J]. Am J Respir Crit Care Med, 2002, 166: 1483–1490. DOI: 10.1164/rccm.2201050 |
| [13] | SUNDAR K M, GOSSELIN M V, CHUNG H L, CAHILL B C. Pulmonary Langerhans cell histioeytosis: emerging concepts in pathobiology, radiology, and clinical evolution of disease[J]. Chest, 2003, 123: 1673–1683. DOI: 10.1378/chest.123.5.1673 |
| [14] | BEVERLEY P C, EGELER R M, ARCECI R J, PRITCHARD J. The Nikolas Symposia and histiocytosis[J]. Nat Rev Cancer, 2005, 5: 488–494. DOI: 10.1038/nrc1632 |
| [15] | SHOLL L M, HORNICK J L, PINKUS J L, PINKUS G S, PADERA R F. Immunohistochemical analysis of langerin in Langerhans cell histiocytosis and pulmonary inflammatory and infectious diseases[J]. Am J Surg Pathol, 2007, 31: 947–952. DOI: 10.1097/01.pas.0000249443.82971.bb |
| [16] | VALLADEAU J, DEZUTTER-DAMBUYANT C, SAELAND S. Langerin/CD207 sheds light on formation of birbeck granules and their possible function in Langerhans cells[J]. Immunol Res, 2003, 28: 93–107. DOI: 10.1385/IR:28:2 |
| [17] | SHTEINBERG M, YEREMEKNO D, ADIR Y. Spontaneous resolution of pulmonary Langerhans cell histiocytosis despite smoking[J]. Lung, 2016, 194: 331–332. DOI: 10.1007/s00408-016-9845-8 |
| [18] | MOGULKOC N, VERAL A, BISHOP P W, BAYINDIR U, PICKERING C A, EGAN J J. Pulmonary Langerhans cell histiocytosis: radiologic resolution following smoking cessation[J]. Chest, 1999, 115: 1452–1455. DOI: 10.1378/chest.115.5.1452 |
| [19] | TAZI A, DE MARGERIE C, NACCACHE J M, FRY S, DOMINIQUE S, JOUNEAU S, et al. The natural history of adult pulmonary Langerhans cell histiocytosis: a prospective multicentre study[J]. Orphanet J Rare Dis, 2015, 14: 30. |
| [20] | NG-CHENG-HIN B, O'HANLON-BROWN C, ALIFRANGIS C, WAXMAN J. Langerhans cell histiocytosis: old disease new treatment[J]. QJM, 2011, 104: 89–96. DOI: 10.1093/qjmed/hcq206 |
 2017, Vol. 38
2017, Vol. 38


