胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm, IPMN)是一种少见的胰腺外分泌肿瘤,以胰腺导管内上皮乳头状异常增生并产生大量黏液为特征,伴有分支胰管的囊状扩张或主胰管局限性或弥漫性扩张[1-2]。IPMN约占胰腺囊性肿瘤的20%,其发病率呈逐年上升趋势[3]。按照病理学分型将该病分为低、中、高级别异型增生及浸润癌,低、中级别异型增生定义为良性,高级别异型增生、浸润癌定义为恶性。不同类型IPMN诊治方法差异较大,对其进行准确的良恶性评估可以指导临床决策。影像学检查作为可疑IPMN患者的首选检查方式,较其他检查方式具有安全、无创、快捷等优势,不仅可明确肿瘤与主胰管的关系,而且可以清楚地观察囊腔内容物特征。主胰管扩张、壁结节、囊腔大小等影像学表现可帮助鉴别IPMN的良恶性,其中壁结节的影像学特征对该病恶性程度的预测起着关键作用。目前国内外研究表明存在壁结节与IPMN恶性相关,但尚无研究阐明壁结节的影像学表现与良恶性的关系[2, 4]。本研究通过回顾性分析61例病理证实存在壁结节IPMN患者的影像学、病理和临床资料,将壁结节的大小、位置、个数、边界、强化程度等影像学特征与病理检查结果进行比较,以期提高对IPMN诊断和良恶性评估的准确度,为临床治疗方案的制定及患者预后评估提供参考。
1 资料和方法 1.1 临床资料回顾性分析2012年1月至2016年6月在第二军医大学长海医院诊治的IPMN患者的病理和影像学(CT、MRI)资料。检查前患者均签署CT、MRI检查注意事项知情同意书,确保患者无妊娠、过敏史、肾功能不全、幽闭恐惧症、体内铁磁性物质等。本研究获得第二军医大学长海医院医学伦理委员会审查批准。纳入研究患者均签署患者知情同意书。
1.2 仪器与方法CT扫描设备为德国Siemens 64层螺旋CT,扫描条件:120 kV,180 mA;扫描参数:准直0.6 mm,层厚0.6 mm,重建间隔3.0 mm,螺距为1.0,矩阵512×512,视野(field of view, FOV) 348 mm×348 mm。造影剂为碘海醇(含碘300 mg/mL),总量1.25 mL/kg,注射流率3.0~4.0 mL/s,经前臂静脉由高压注射器团注,之后注射98 mL生理盐水以同样流率冲洗。注射造影剂后20~25、60~70、110~130 s分别行动脉期、门脉期和延迟期扫描。
MRI扫描设备为美国GE Signa EXCITE 3.0T超导型核磁共振扫描仪。扫描序列:(1) 横断面T1WI采用基于肝脏容积加速采集(liver acquisition with volume acceleration, LAVA)序列,重复时间(repetition time, TR)4.25 ms,回波时间(echo time, TE)1.94 ms,层厚5 mm,无层间距,FOV 320 mm×320 mm~440 mm×440 mm,矩阵224×320。造影剂为钆喷酸(Gd-DTPA),0.1 mL/kg,注射流率2 mL/s,经前臂静脉由高压注射器注入,之后注射20 mL生理盐水以同样流率冲洗。注射造影剂后18、26、38 s分别行动脉期、门脉期和延迟期扫描。(2) 横断面抑脂呼吸触发T2WI序列,TR 2 833 ms,TE 86.74 ms,层厚6 mm,层间距6 mm,FOV 440 mm×440 mm,矩阵224×288。(3) 厚层块二维磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)序列,TR 7 000 ms,FOV 300 mm×300 mm,矩阵288×288。
1.3 图像分析与数据测量由2位从事影像诊断的主治医师在对患者所有资料不知情的情况下共同进行诊断和测量,阅片结果不一致时互相协调取得一致。(1) 壁结节大小:选择病灶中最大的壁结节,大小测量在3个标准平面(横断面、矢状面和冠状面)上进行,以其最大径记录为壁结节大小。(2) 壁结节位置:以肠系膜上静脉左侧壁为界将胰腺划分为头部及体尾部,并相应记录壁结节所在位置。(3) 壁结节个数:观察病灶中壁结节个数,记录为单个或多个。(4) 壁结节边界:观察壁结节轮廓、与周围组织分界是否清晰。(5) 壁结节强化:在CT图像上分别测量平扫、动脉期及门脉期中最大壁结节与周围胰腺组织的CT值,具体方法如下:① 增强扫描门脉期,在横断面测量壁结节CT值,记录为vn;② 平扫和动脉期所选壁结节感兴趣区(region of interest, ROI)的位置及范围均与门脉期所选位置一致,分别记录为n、an;③ 尽量远离所测壁结节的边缘,以避免部分容积效应的影响;④ 胰腺ROI选择质地均匀的胰腺实质,避开主胰管和增强扫描上可见的血管以及胰腺小叶间脂肪组织,其动脉期、门脉期所选ROI位置一致,CT值分别记录为ap、vp。然后计算如下参数:动脉期壁结节绝对强化程度(A)=an-n;门脉期壁结节绝对强化程度(V)=vn-n;动脉期壁结节相对强化程度(A’)=an-ap;门脉期壁结节相对强化程度(V’)=vn-vp。
1.4 统计学处理应用SPSS 20.0软件进行数据分析。所有数据行正态检验和方差齐性检验。计量资料连续性变量若符合正态分布则用x±s表示。良、恶性病变影像学表现比较,计量资料的两组间比较采用独立样本t检验,样本率的组间比较采用Fish确切概率法。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,测量曲线下面积(area under curve, AUC)评价壁结节直径、个数、边界在IPMN良恶性鉴别中的作用,并确定壁结节直径的最佳诊断值及其敏感度、特异度和准确度。运用Spearman相关分析检验壁结节影像学特点与IPMN良恶性的相关性。检验水准(α)为0.05。
2 结果 2.1 患者的基本资料回顾性分析2012年1月至2016年6月在长海医院诊治且病理和影像学资料完整的IPMN患者112例,排除病理未发现明确壁结节或实性成分的IPMN患者34例和病理证实存在壁结节但影像学中未明确观察其存在的患者17例,最终纳入研究患者共61例,其中男性42例、女性19例,年龄40~81岁,平均年龄(62±10) 岁。IPMN确诊以病理结果为金标准,良性36例,包括低级别异型增生25例、中级别异型增生11例,平均年龄(63±7) 岁;恶性25例,包括高级别异型增生15例、浸润癌10例,平均年龄(61±11) 岁。良、恶性患者的性别、年龄、IPMN壁结节位置差异均无统计学意义。见表 1。
|
|
表 1 IPMN壁结节患者基本临床资料 Tab 1 Clinical characteristics of patients with mural nodules of IPMNs |
2.2 IPMN壁结节的影像学表现
IPMN患者中主胰管型15例、分支型13例、混合型33例;良、恶性患者的分型差异有统计学意义(P=0.01)。良、恶性患者的IPMN壁结节大小、个数、边界差异均有统计学意义(P<0.05,P<0.01);所有患者最大壁结节强化程度均为渐进性强化,良、恶性患者的强化程度差异均无统计学意义。见表 2。
|
|
表 2 IPMN壁结节的影像学表现 Tab 2 Imaging features of mural nodules of IPMN patients |
2.3 壁结节影像学表现鉴别良、恶性IPMN的价值
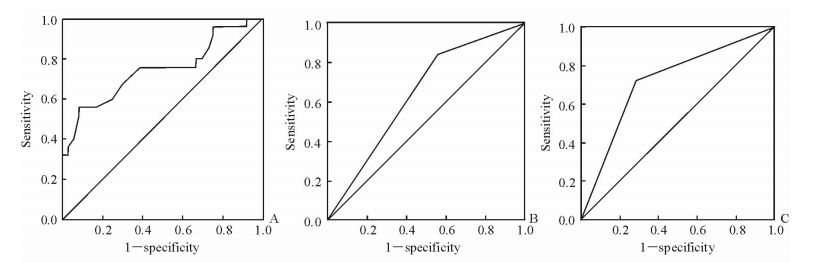
壁结节大小鉴别良、恶性IPMN的最佳诊断界值为1.35 cm,即良性病变壁结节多表现为最大径<1.35 cm、单发、边界清楚(图 1),而恶性病变壁结节最大径多≥1.35 cm、多发、边界不清(图 2)。壁结节大小鉴别良、恶性IPMN的AUC为74.7%,敏感度56.0%,特异度91.7%,准确度77.5%;壁结节个数、边界鉴别良、恶性IPMN的AUC分别为64.2%、72.1%(图 3)。壁结节大小(r=0.42,P=0.001)、边界(r=0.44,P=0.001) 与IPMN良、恶性中度相关;壁结节个数与其良、恶性低度相关(r=0.30,P=0.02)。
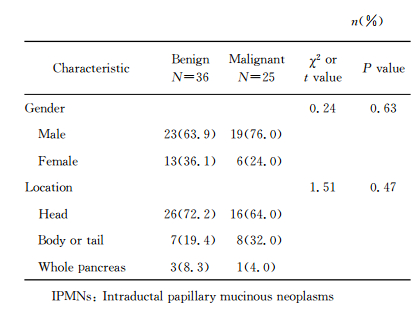
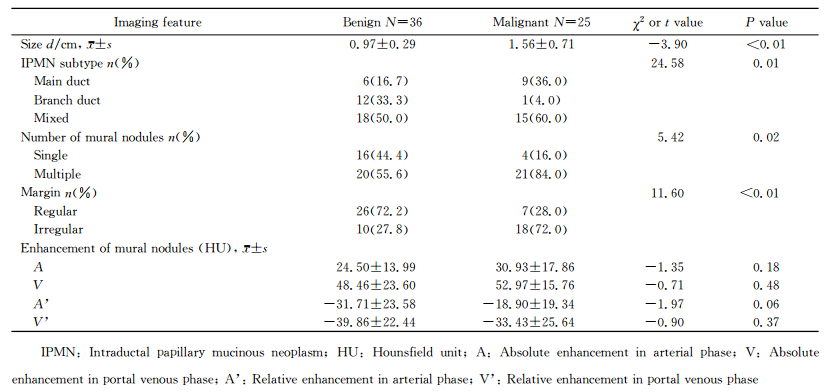
|
图 1 良性主胰管型IPMN壁结节影像及病理表现 Fig 1 CT imaging and pathological section of mural nodules of benign main duct IPMN A 47-year-old male with dilatation of the main pancreatic duct incidentally found in physical examination. Multislice computed tomography (MSCT) axial (A) and coronal (B) images show a well-defined mural nodule in the head of the pancreas (arrow) associated with dilatation of the main pancreatic duct. Its diameter is 0.85 cm. Curved planar reconstruction (CPR) imaging (C) shows more clearly. H-E staining of histological section (D) shows an IPMN with low-grade dysplasia. IPMN: Intraductal papillary mucinous neoplasm. Original magnification:×4 (D) |
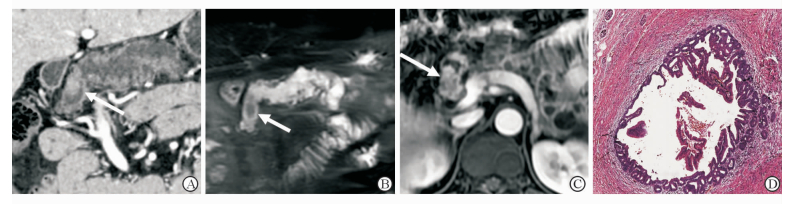
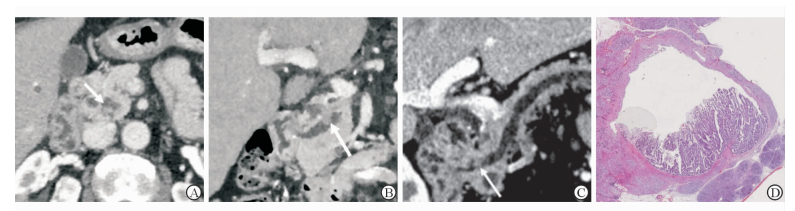
|
图 2 恶性混合型IPMN壁结节影像及病理表现 Fig 2 CT or MRI imaging and pathological section of mural nodules of malignant mixed type IPMN A 62-year-old male with abdominal discomfort and weight loss. Multislice computed tomography (MSCT) axial image (A) demonstrates a markedly dilated main pancreatic duct with mural nodules (arrow) in the head of the pancreas. T2WI coronal image (B) and fat-suppressed contrast-enhanced T1WI axial image (C) show an ill-defined mural nodule in the head of the pancreas (arrow) associated with dilatation of the main pancreatic duct. Its diameter is 2.8 cm. H-E staining of histological section (D) reveals an invasive IPMN. IPMN: Intraductal papillary mucinous neoplasm. Original magnification:×4 (D) |
|
图 3 壁结节大小、个数、边界鉴别IPMN良、恶性的ROC曲线 Fig 3 ROC curves of distinguishing benign from malignant IPMNs by mural nodules' size, number, and margin A: ROC curve of the size of mural nodules. The best cut-off value was 1.35 cm. The area under curve (AUC) was 74.7%, the sensitivity, specificity and accuracy were 56.0%, 91.7% and 77.5%, respectively; B: ROC curve of the number of mural nodules. The AUC was 64.2%; C: ROC curve of the margin of mural nodules. The AUC was 72.1%. ROC: Receiver operating characteristic; IPMN: Intraductal papillary mucinous neoplasm |
3 讨论
IPMN具有一定的恶变倾向,如延误手术,该病将发展为浸润癌,且患者预后差,生存时间短;但是非必要的手术会使患者创伤较大,术后生活质量下降。因此,术前对该病进行较为准确的良恶性评估对临床手术时机的选择尤为重要。国际共识指南[5]指出:出现任何“高危指征”(主胰管直径≥10 mm、存在强化壁结节、肝内外胆管扩张),应手术治疗;出现任何“报警指征”(胰腺炎、囊变≥3 cm、强化分隔、主胰管直径5~9 mm、主胰管截断伴上游胰腺萎缩),应行超声内镜(endoscopic ultrasound,EUS)检查。美国胃肠病学会发布的胰腺囊性病指南[6]中强调:主胰管扩张和壁结节同时存在为IPMN的手术指征。
对于壁结节的影像学特征,我们在CT及MRI图像上观察其大小、位置、个数、边界以及强化程度,本研究通过对61例患者的回顾性研究发现,壁结节大小、个数、边界对评价IPMN的良恶性有临床意义。Kubo等[7]认为壁结节大小应引起足够重视,较大壁结节为恶性倾向,较小壁结节为良性倾向。本研究61例患者中良性36例,最大壁结节平均直径为(0.97±0.29) cm,恶性25例,最大壁结节平均直径(1.56±0.71) cm,良、恶性IPMN的壁结节大小差异有统计学意义(P<0.01),可以认为壁结节越大,患者病变越倾向于恶性。Choi等[8]认为是否存在壁结节和壁结节大小均可作为IPMN良恶性的鉴别指标。我们进一步研究是否有明确的诊断界值可以帮助区分IPMN良、恶性,结果显示壁结节直径≥1.35 cm提示病变恶性,诊断敏感度56.0%、特异性91.7%、准确度77.5%,且相关性良好。Uehara等[3]对100例分支胰管型IPMN患者进行为期97个月随访,结果提示壁结节最大径达1.0 cm可作为手术指征,与本文研究结果接近。因此在临床初诊及随访过程中,不能忽视壁结节直径的测量,比较其前后细微的变化,可以提示临床及时改变诊治策略,以免错过最佳的手术时机。
本研究结果表明,与其他恶性肿瘤形态学特征相似,壁结节边界不清、与周围分界模糊者提示IPMN恶性,且AUC为72.1%,诊断价值较高。此外,病变内存在多个壁结节也提示该病偏向恶性,但诊断价值较低,且与病变良、恶性表现为低度相关关系。
以往判断及评估某组织的强化程度,仅比较某一区域动脉期、门脉期与平扫CT值的差值,但由于个体间血流动力学等因素差异,增强扫描同一时期也会造成强化程度的不同[9]。为尽可能消除个体间差异,我们使用相对强化程度这一指标对良、恶性病变的壁结节进行比较。结果显示,所有病例壁结节在动脉期、门脉期呈渐进性强化,但良、恶性病变壁结节动脉期、门脉期的绝对和相对强化程度差异均无统计学意义,换言之,不能通过壁结节的强化来鉴别IPMN的良、恶性,不同于2012年国际共识指南中“存在强化壁结节高度提示病变恶性”[5]的结论。目前未见相关研究将壁结节强化程度进行具体量化评估,我们猜测造成结果差异的原因可能与选择测量的壁结节有关。
IPMN从良性到恶性的发展是连续性的,因此在某些患者的组织学切片中可以同时发现4种病理类型分布于不同病变区域[10-11]。本研究仅测量直径体积最大、病理更倾向于恶性的壁结节各期CT值,未测量体积较小、病理更倾向于良性的壁结节,统计结果示良、恶性强化程度差异无统计学意义。提示我们今后的研究方向更倾向于将病理切片与薄层CT准确对应,在影像学图像上、病理切片上找到同一壁结节“点对点”研究,这样得出的结果更加直观,且有望对该病做出准确的分级诊断。壁结节的位置亦对鉴别该病良、恶性无临床意义,此结论与Kawada等[4]的结果一致。
CT及MRI较其他检查方式具有方便、快捷、无创等优势,常作为可疑恶性IPMN患者首选检查。CT具备层厚薄、分辨率高、多期动态扫描及后处理技术等优势,可发现体积较小的壁结节,能多角度观察其形态、位置,并对其最大径进行精确测量[12-13]。MRI组织分辨率高,较CT能更好显示囊腔内容物尤其是壁结节的特征;T2WI上液体呈高信号,较易发现囊性病灶,且主胰管或分支胰管囊性病灶内低信号“充盈缺损”,更能间接证明壁结节的存在[14-16]。两种检查方法虽有诸多优势,但是个别病例也会造成对壁结节的漏诊。MRI常规扫描层厚较厚,小于1 cm的壁结节不能展现其全貌,仅在一个层面无法确定其是否为壁结节;CT扫描层厚薄,但薄层图像噪声较大,难以将壁结节与胰腺实质或IPMN囊壁间隔进行明确区分[17-18]。本研究中MRI及CT对壁结节的漏诊率分别为38.5%(30/78)、21.8%(17/78),MRI漏诊率明显高于CT(χ2=2.37,P=0.02),因此,在壁结节强化的研究中我们仅对壁结节的CT值进行测量,从而可将体积较小的壁结节也纳入研究。所以在今后的的临床工作中,不断完善和规范影像学检查技术、联合多种影像学检查及后处理方法是降低漏诊率的关键。
本研究也存在一定的局限性。首先,样本量相对较小。由于来第二军医大学长海医院就诊的多数患者均在外院进行影像学检查,入院后直接手术而未进行相关的影像学检查。其次,在壁结节观察和测量上存在一定的误差。最后,增强扫描只选择CT动脉期及门脉期2个时间点进行研究,对壁结节强化程度的评价不全面,如果选择3个或3个以上时间点,或者引用MRI的时间信号强度曲线可能对研究更有意义。
综上所述,壁结节平均直径≥1.35 cm时IPMN倾向恶性,多个壁结节、壁结节边界亦可提示恶性倾向。CT及MRI可较为清楚、准确地显示壁结节的影像学特征,对IPMN良恶性的鉴别诊断有重要的临床意义。
| [1] | 边云, 李骁, 陈炜, 高振坡, 王莉, 陆建平. CT和MRI对主胰管型胰腺导管内乳头状黏液瘤良恶性鉴别的价值[J]. 中华胰腺病杂志, 2015, 15: 182–186. DOI: 10.3760/cma.j.issn.1674-1935.2015.03.010 |
| [2] | 《中华胰腺病杂志》编辑委员会. 我国胰腺囊性肿瘤共识意见(草案2013, 上海)[J]. 中华胰腺病杂志, 2013, 13: 79–90. DOI: 10.3760/cma.j.issn.1674-1935.2013.02.002 |
| [3] | UEHARA H, ISHIKAWA O, KATAYAMA K, KAWADA N, IKEZAWA K, FUKUTAKE N, et al. Size of mural nodule as an indicator of surgery for branch duct intraductal papillary mucinous neoplasm of the pancreas during follow-up[J]. J Gastroenterol, 2011, 46: 657–663. DOI: 10.1007/s00535-010-0343-0 |
| [4] | KAWADA N, UEHARA H, NAGATA S, TSUCHISHIMA M, TSUTSUMI M, TOMITA Y. Mural nodule of 10 mm or larger as predictor of malignancy for intraductal papillary mucinous neoplasm of the pancreas:pathological and radiological evaluations[J]. Pancreatology, 2016, 16: 441–448. DOI: 10.1016/j.pan.2015.12.008 |
| [5] | TANAKA M, FERNÁNDEZ-DEL CASTILLO C, ADSAY V, CHARI S, FALCONI M, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J]. Pancreatology, 2012, 12: 183–197. DOI: 10.1016/j.pan.2012.04.004 |
| [6] | VEGE S S, ZIRING B, JAIN R, MOAYYEDI P, Clinical Guidelines Committee, American Gastroenterology Association. American gastroenterological association institute guideline on the diagnosis and management of asymptomatic neoplastic pancreatic cysts[J]. Gastroenterology, 2015, 148: 819–822. DOI: 10.1053/j.gastro.2015.01.015 |
| [7] | KUBO H, CHIJⅡWA Y, AKAHOSHI K, HAMADA S, HARADA N, SUMⅡ T, et al. Intraductal papillary-mucinous tumors of the pancreas:differential diagnosis between benign and malignant tumors by endoscopic ultrasonography[J]. Am J Gastroenterol, 2001, 96: 1429–1434. DOI: 10.1111/j.1572-0241.2001.03794.x |
| [8] | CHOI B S, KIM T K, KIM A Y, KIM K W, PARK S W, KIM P N, et al. Differential diagnosis of benign and malignant intraductal papillary mucinous tumors of the pancreas:MR cholangiopancreatography and MR angiography[J]. Korean J Radiol, 2003, 4: 157–162. DOI: 10.3348/kjr.2003.4.3.157 |
| [9] | 中华医学会放射学分会腹部学组. 腹部CT扫描规范指南(试用稿)[J]. 中华放射学杂志, 2007, 41: 999–1004. DOI: 10.3760/j.issn:1005-1201.2007.09.031 |
| [10] | RAMAN S P, KAWAMOTO S, BLACKFORD A, HRUBAN R H, LENNON A M, WOLFGANG C L, et al. Histopathologic findings of multifocal pancreatic intraductal papillary mucinous neoplasms on CT[J]. AJR Am J Roentgenol, 2013, 200: 563–569. DOI: 10.2214/AJR.12.8924 |
| [11] | PAINI M, CRIPPA S, PARTELLI S, SCOPELLITI F, TAMBURRINO D, BALDONI A, et al. Molecular pathology of intraductal papillary mucinous neoplasms of the pancreas[J]. World J Gastroenterol, 2014, 20: 10008–10023. DOI: 10.3748/wjg.v20.i29.10008 |
| [12] | NAKAGAWA A, YAMAGUCHI T, OHTSUKA M, ISHIHARA T, SUDO K, NAKAMURA K, et al. Usefulness of multidetector computed tomography for detecting protruding lesions in intraductal papillary mucinous neoplasm of the pancreas in comparison with single-detector computed tomography and endoscopic ultrasonography[J]. Pancreas, 2009, 38: 131–136. DOI: 10.1097/MPA.0b013e31818b0040 |
| [13] | FUSARI M, MAUREA S, IMBRIACO M, MOLLICA C, AVITABILE G, SOSCIA F, et al. Comparison between multislice CT and MR imaging in the diagnostic evaluation of patients with pancreatic masses[J]. Radiol Med, 2010, 115: 453–466. DOI: 10.1007/s11547-010-0490-7 |
| [14] | OGAWA T, HORAGUCHI J, FUJITA N, NODA Y, KOBAYASHI G, ITO K, et al. Diffusion-weighted magnetic resonance imaging for evaluating the histological degree of malignancy in patients with intraductal papillary mucinous neoplasm[J]. J Hepatobiliary Pancreat Sci, 2014, 21: 801–808. DOI: 10.1002/jhbp.2014.21.issue-11 |
| [15] | KANTARCI M, BAYRAKTUTAN U, YILMAZ O, KARATAS D. MRCP imaging of intraductal papillary-mucinous neoplasm of the pancreas[J]. Eurasian J Med, 2012, 44: 61–62. DOI: 10.5152/eajm. |
| [16] | JANG K M, KIM S H, MIN J H, LEE S J, KANG T W, LIM S, et al. Value of diffusion-weighted MRI for differentiating malignant from benign intraductal papillary mucinous neoplasms of the pancreas[J]. AJR Am J Roentgenol, 2014, 203: 992–1000. DOI: 10.2214/AJR.13.11980 |
| [17] | 黄小华, 敬宗林, 张小明, 杨林, 翟昭华, 周立绥. 胰腺多层螺旋CT照射剂量与噪声的关系分析[J]. 放射学实践, 2010, 25: 688–690. DOI: 10.3969/j.issn.1000-0313.2010.06.027 |
| [18] | 康立丽, 卢广文, 余晓锷, 杨绍洲. MRI扫描参数与信噪比关系的实验研究[J]. 中华放射学杂志, 2003, 37: 225–227. DOI: 10.3760/j.issn:1005-1201.2003.03.007 |
 2017, Vol. 38
2017, Vol. 38