2. 第二军医大学长征医院器官移植科, 上海 200003
2. Department of Organ Transplantation, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
肝移植术是目前国内外治疗各类危重终末期肝病的重要治疗手段。在我国,与慢性乙型肝炎病毒(hepatitis B virus,HBV)感染相关的各类终末期肝脏疾病(如肝硬化、肝衰竭和肝癌等)是患者接受肝移植治疗的首要病因。肝移植术前存在慢性HBV感染的患者均需要在术后长期服用核苷(酸)类似物[nucleos(t)ide analogues,NAs]联合人乙型肝炎免疫球蛋白(hepatitis B immunoglobulin, HBIG)治疗,以预防术后移植肝的HBV再感染[1]。关于肝移植术后患者长期口服NAs的安全性问题受到越来越广泛的关注。
众所周知,肝移植术后患者是出现肾功能损害的高危人群。以往有关肝移植术后肾功能损害危险因素的研究主要集中在患者的自身因素、伴随疾病以及抗排异药物等方面[2-5]。近年来已有研究证实,不同的NAs对患者的肾功能可能存在不同的影响。如长期口服阿德福韦酯(adefovir dipivoxil, ADV)或替诺福韦酯(tenofovir disoproxil, TDF)对慢性HBV感染者(非移植患者)具有潜在的肾脏毒性[6-7];而替比夫定(telbivudine, LDT)则可能对患者的肾功能具有一定的保护作用[8-9]。但目前有关中长期应用NAs对肝移植术后患者肾功能影响的研究仍然甚少[10],尤其是缺乏大样本、严格设计的临床研究。本研究拟通过回顾性临床真实队列研究,观察不同NAs对慢性HBV感染者肝移植术后估算肾小球滤过率(estimated glomerular filtration rate, eGFR)的影响。
1 资料和方法 1.1 研究对象本研究为回顾性临床真实队列研究。研究对象为2008年8月1日至2014年10月31日在我院肝移植科行肝移植手术的患者,所有病例均在中国肝移植注册中心(CLTR)注册登记。肝脏移植术式为经典原位或改良背驮式异体全肝移植。本研究获我院伦理委员会批准。
1.2 纳入与排除标准纳入标准:中国大陆人群;年龄18~70岁;慢性HBV感染相关疾病(肝功能衰竭、肝硬化或肝癌)行肝移植术;肝移植术前或术后即刻使用NAs单药抗HBV治疗,无病毒学突破或耐药史;术后随访期≥27个月。排除标准:合并人免疫缺陷病毒(HIV)或甲型、丙型、丁型、戊型肝炎病毒感染;接受多器官移植;移植术后27个月内出现更换抗病毒治疗方案或停药、肝癌复发或死亡、随访数据不全或失访情况之一者。
1.3 研究方法 1.3.1 研究基线接受肝脏移植手术的终末期肝病(尤其是肝功能衰竭和失代偿肝硬化)或肝癌患者术前常伴不同程度的肾功能损害,如肝肾综合征和HBV相关性肾炎等;此外,肝移植术后急性肾功能损伤定义为不超过3个月的肾脏功能或结构方面的异常,包括血、尿、组织检测或影像学方面异常[11]。鉴于以上原因,为尽量减少基线eGFR的波动对研究的影响,本研究将研究基线时间定义为术后3个月。
1.3.2 数据采集检索CLTR数据库,回顾性收集患者以下信息:国籍、性别、出生年月、肝移植的病因、手术日期、术前及术后并发症(糖尿病、高血压等)、肝癌是否复发及复发时间、抗HBV治疗方案及其变化、抗排异药物治疗方案、死亡时间及原因、行二次肝移植的原因及时间等。以肝移植术后3个月为基线,每间隔6个月收集1次患者的下列动态随访资料:血清肌酐(SCr)、血清尿素氮(BUN)、HBV DNA定量、乙肝表面抗原(HBsAg)、乙肝表面抗体(抗-HBs)及乙肝e抗原(HBeAg)等。如果患者接受了第2次肝移植手术,则数据收集截止至第2次移植术前。对于CLTR数据库中随访数据欠完整的病例,通过电话随访或门诊复诊时补充随访等方式完善患者的资料。病例随访截止日期为2017年1月31日。
1.3.3 肝移植术后用药方案NAs用药方案:本研究为回顾性临床真实队列研究,对NAs治疗方案的选择未进行干预,患者肝移植术后采用何种NAs抗病毒由医师根据治疗经验、患者既往抗病毒治疗史以及患者的意愿综合判定。各药物口服给药方案:拉米夫定(LAM)100 mg,1次/d;ADV 10 mg,1次/d;恩替卡韦(ETV)0.5 mg,1次/d;LDT 600 mg,1次/d。其中ETV在服药前、后2 h内不得进食,其他药物不限。
HBIG的应用:所有患者除术中无肝期给予大剂量HBIG冲击治疗外,术后均与NAs联合使用预防HBV再感染。患者术后不同时期血清抗-HBs滴度分别维持在以下水平:术后3个月内,300~500 mIU/mL;术后3~6个月,300 mIU/mL;术后7~12个月,200 mIU/mL;术后12个月以上,维持在100 mIU/mL以上。
术后抗排异治疗方案:所有患者移植术后均常规给予他克莫司(FK506)、霉酚酸酯和泼尼松联合抗排异治疗。FK506在术后不同时期的血药谷浓度维持在以下治疗窗水平:术后3个月内,10~15 ng/mL;术后3~6个月,8~10 ng/mL;7~9个月,6~8 ng/mL;术后9个月以上,维持在5~6 ng/mL。
1.4 实验室检查HBV DNA定量采用qPCR法检测,PCR扩增采用美国ABI 7500型PCR仪,试剂为上海科华生物工程股份有限公司生产的试剂盒。HBsAg、抗-HBs及抗-HBe定量检测采用化学发光法,试剂为美国雅培医疗器械(上海)有限公司生产的试剂盒;HBeAg定量检测采用化学发光法,试剂为意大利索灵诊断医疗设备(上海)有限公司生产的试剂盒。肝功能及肾功能检测采用美国贝克曼公司AU5400型全自动生化分析仪。
1.5 eGFR的计算根据患者的临床资料,计算基线时(术后3个月)及术后9、15、21和27个月时各治疗组患者的eGFR。目前国内外普遍采用的eGFR计算方法主要是CKD-EPI公式和MDRD公式。CKD-EPI公式由慢性肾脏病流行病学协作组(CKD-EPI)制定,依据患者SCr水平及性别的不同,分别采用以下计算公式:(1) 女性SCr≤0.7者,eGFR=144×(SCr/0.7)-0.329×0.993年龄; (2) 女性SCr>0.7者,eGFR=144×(SCr/0.7)-1.209×0.993年龄; (3) 男性SCr≤0.9者,eGFR=141×(SCr/0.9)-0.411×0.993年龄; (4) 男性SCr>0.9者,eGFR=141×(SCr/0.9)-1.209×0.993年龄。
MDRD公式是经肾病膳食改良试验的公式。近年美国肾脏基金会的《慢性肾脏疾病预后质量指南》[12]推荐将MDRD公式用于成人肾小球滤过率的估算。本研究采用Stevens等[13]报道的MDRD简化公式,即eGFR =175×SCr-1.154×年龄-0.203×1.212(黑人)×0.742(女性)。
上述两种计算公式的eGFR单位为mL·min-1·1.73 m-2,SCr单位为mg/dL (1 mg/dL=88.4 μmol/L), 年龄单位为岁。
1.6 肾功能损伤程度分级根据eGFR变化水平,将患者肾功能损伤程度分为3级[14]:(1) 轻度损伤,eGFR较基线值下降20%~30%;(2) 中度损伤,eGFR较基线值下降30%~50%;(3) 重度损伤,eGFR较基线值下降>50%。
1.7 统计学处理应用SPSS 19.0软件进行数据分析。计数资料以率表示,组间比较采用χ2检验。计量资料以x±s表示,采用随机区组资料方差分析(F检验),两两比较采用SNK q检验。因HBV DNA定量数据不符合正态分布,组间比较采用非参数Kruskal-Wallis检验。采用logistic回归法分析肝移植术后27个月时患者eGFR较基线值变化≥20%的影响因素,单因素分析变量筛选采用enter法,多因素分析变量筛选采用forward:conditional法。研究中所有检验均为双侧检验,检验水准(α)为0.05。
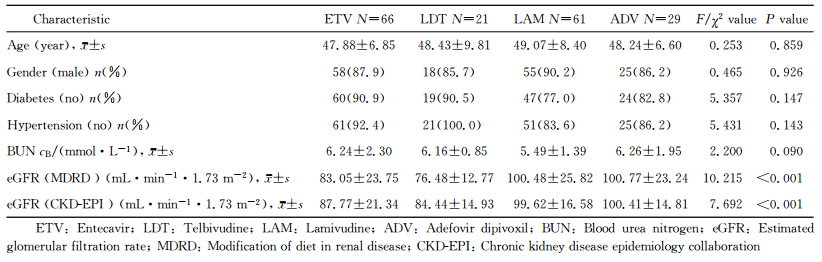
2 结果 2.1 队列人群的一般临床资料和基线特征共177例患者纳入本队列研究,其中ETV治疗组66例、LDT治疗组21例、LAM治疗组61例、ADV治疗组29例。各组患者基线时的性别和年龄分布、糖尿病和高血压等合并症发生率、血清BUN及eGFR水平等资料见表 1。基线时,不同NAs治疗组间分别以MDRD公式和CKD-EPI公式计算的eGFR水平差异均有统计学意义(P<0.001),而各组间患者的性别和年龄分布、糖尿病或高血压等合并症发生率以及血清BUN水平等差异均无统计学意义。自基线开始,ETV组、LDT组、LAM组及ADV组的中位随访时间分别为2.0(2.0, 3.3) 年、2.0(2.0, 2.3) 年、2.9(2.0, 4.9) 年及2.0(2.0, 2.6) 年。随访期间,ETV组、LDT组、LAM组及ADV组中出现轻度肾功能损伤(含一过性eGFR降低20%~30%者)的累计发生率分别为2.20/100人年、0/100人年、5.67/100人年和14.65/100人年;未见中度及重度肾功能损伤者。
|
|
表 1 队列人群的基线特征 Tab 1 Baseline characteristics of cohort population |
2.2 肝移植术后27个月内患者eGFR的变化 2.2.1 肝移植术后27个月内患者eGFR(MDRD公式)的变化
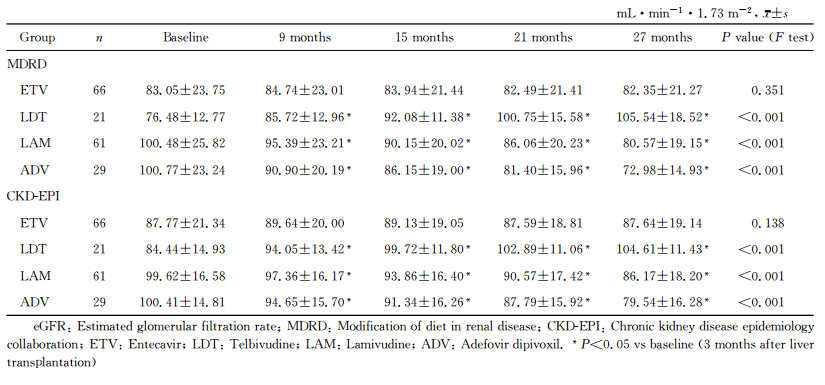
以按MDRD公式计算的eGFR为准,ETV治疗组患者基线时和术后9、15、21及27个月时的eGFR差异均无统计学意义(P=0.351);LAM治疗组和ADV治疗组患者的eGFR自术后9个月起较基线时降低(P<0.05),并在术后27个月内呈进行性降低趋势(P<0.001);而LDT治疗组的eGFR自术后9个月起较基线时升高(P<0.05),并在术后27个月内呈进行性升高趋势(P<0.001)。见表 2。
|
|
表 2 肝移植术后27个月内患者eGFR的变化 Tab 2 Change of eGFR during 27 months after liver transplantation |
以患者各随访时间点的eGFR(MDRD公式)与其基线数据的差值(ΔeGFR)均数作描述,结果可见各组患者的ΔeGFR在术后27个月内呈现与eGFR相同的变化趋势。见表 3。
|
|
表 3 肝移植术后27个月内患者ΔeGFR均数的变化 Tab 3 Changes of ΔeGFR mean at 27 months after liver transplantation |
2.2.2 肝移植术后27个月内患者eGFR(CKD-EPI公式)的变化
以按CKD-EPI公式计算的eGFR为准,ETV治疗组患者基线时和术后9、15、21及27个月时的eGFR差异均无统计学意义(P=0.138);LAM治疗组和ADV治疗组患者的eGFR自术后9个月起较基线时降低(P<0.05),并在术后27个月内呈进行性降低趋势(P<0.001);而LDT治疗组的eGFR自术后9个月起较基线时升高(P<0.05),并在术后27个月内呈进行性升高趋势(P<0.001)。见表 2。
以患者各随访时间点的eGFR(CKD-EPI公式)与其基线数据的差值(ΔeGFR)均数作描述,结果可见各组患者的ΔeGFR在术后27个月内呈现与eGFR相同的变化趋势。见表 3。
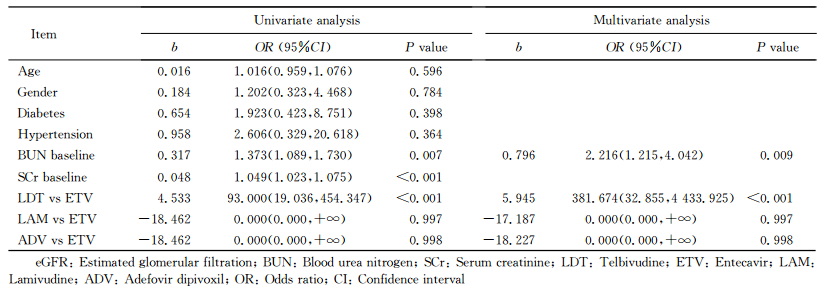
2.3 肝移植术后27个月时患者eGFR较基线值下降≥20%的影响因素分析肝移植术后27个月时,各治疗组中出现eGFR较其自身基线值下降≥20%的患者数分别为ETV组3例、LDT组0例、LAM组12例、ADV组11例。单因素分析结果表明,基线SCr水平、服用LAM或ADV治疗是患者eGFR较基线值降低≥20%的影响因素(P<0.001);多因素logistic回归分析显示,服用LAM或ADV治疗相比ETV治疗更易导致肝移植患者术后发生肾功能损伤,是导致eGFR较基线值下降≥20%的独立危险因素(P<0.01,表 4)。
|
|
表 4 肝移植术后27个月时患者eGFR较基线值下降≥20%的影响因素分析 Tab 4 Logistic regression analysis of risk factors of ≥20% decrease of eGFR baseline 27 months after liver transplantation |
2.4 肝移植术后27个月时患者eGFR较基线值升高≥20%的影响因素分析
肝移植术后27个月时,各治疗组中出现eGFR较其自身基线值升高≥20%的患者数分别为ETV组4例、LDT组9例、LAM组0例、ADV组0例。如表 5所示,单因素分析结果表明,基线BUN水平、SCr水平及服用LDT治疗是患者eGFR较基线值升高≥20%的影响因素(P<0.01),而年龄、性别、基线时是否合并高血压或糖尿病、LAM和ETV治疗等均与患者eGFR较基线值升高≥20%无关。多因素logistic回归分析显示,基线BUN水平和服用LDT治疗是导致eGFR较基线值升高≥20%的独立预测因素(P<0.01,表 5)。
|
|
表 5 肝移植术后27个月时患者eGFR较基线值升高≥20%的影响因素分析 Tab 5 Logistic regression analysis of risk factors of ≥20% increase of eGFR baseline 27 months after liver transplantation |
3 讨论
肾功能损伤是肝移植术后患者的常见并发症,其发生是多因素导致的。有报道称,术前合并有高血压或糖尿病的患者肝移植术后更易出现肾功能损伤[2-3];年龄>50岁的患者不仅术后发生肾功能损伤的概率升高,而且肾功能继续恶化的危险性更高[4];术后服用环孢素A(CsA)、FK506等钙神经蛋白抑制剂也是肾功能损伤的危险因素[5]。
我国绝大部分接受肝脏移植手术的患者术前均合并慢性HBV感染。在此类患者中,为预防术后移植肝的HBV再感染(HBV感染复发),患者一般均常规接受口服NAs联合注射HBIG的预防性治疗方案。有关慢性乙型肝炎、肝硬化等非移植术后患者的临床研究发现,不同的NAs可能对患者的肾功能具有不同的影响。ADV和TDF具有潜在的肾脏毒性,尤其是在乙型肝炎肝硬化患者中,其风险更高[6-7]。Kim等[14]回顾性分析了687例接受ADV治疗的慢性乙型肝炎及代偿期肝硬化患者的临床资料,发现随访1、3和5年时的累积肾功能损伤发生率分别为2.6%、14.8%和34.7%。与上述情况相反,近年来一些临床研究提示LDT能够改善患者的eGFR[8-9, 15]。但截至目前,关于NAs在肝移植术后患者中长期应用后的肾脏安全性的研究甚少[10],尤其是缺乏大样本、高质量的临床研究。Cholongitas等[10]将肝移植术后采用其他NAs治疗的17例患者更换为LDT治疗,随访24个月后发现患者的eGFR比未换用LDT治疗的对照组患者显著升高。
本研究采用回顾性临床真实队列的研究方法,观察了ETV、LDT、LAM和ADV治疗对肝移植术后患者eGFR的影响,以往尚未见类似报道。研究发现,在肝移植术后27个月内,LAM或ADV治疗组患者的eGFR呈进行性降低趋势,与Lee等[16]的报道一致;而采用LDT治疗的患者eGFR则呈进行性升高趋势;治疗期间ETV对患者的eGFR水平未见有显著影响。根据以往的研究报道[14],本研究以eGFR改变≥20%作为评价患者肾功能改变的指标,多因素logistic回归分析显示,肝移植术后27个月时LAM或ADV治疗是患者eGFR较基线值降低≥20%的独立危险因素,而LDT治疗则是患者eGFR较基线值升高≥20%的独立预测因素。以上结果提示在肝移植术后人群中,为预防HBV感染复发而使用LAM或ADV预防性治疗时,应密切随访并关注其对患者肾功能的不良影响。目前关于LAM和ADV引起肾功能损伤的机制尚未完全明了,尤其是LAM在肾脏毒性方面的研究尚未见报道。有研究发现ADV的肾毒性可能与其对肾脏近曲小管的直接毒性有关,近曲小管通过基底膜上的人体器官阴离子转运体1(human organic anion transporter 1,hOAT-1) 摄取ADV,进而通过顶端多耐药蛋白4(multidrug resistant-associated protein 4,MDRP-4) 分泌;hOAT-1的过度表达或MDRP4的低表达均可导致ADV对近曲小管细胞的毒性增加[17-18]。而从保护或改善肝移植术后患者的肾功能角度考虑,使用LDT治疗具有一定的优势。有关LDT对肾功能保护作用的机制目前尚未明了。有研究显示,长期服用LDT患者的血清血管紧张素水平显著降低,且与eGFR水平的升高明显相关[19],推测LDT可能通过血管紧张素途径改善肾功能。本研究还发现,患者的基线BUN水平也是肝移植术后27个月时eGFR较基线值升高≥20%的独立预测因素,但血清BUN水平受饮食、药物等因素影响较大,其预测价值尚需要进一步研究验证。
本研究存在以下不足之处:(1) 由于是临床真实队列研究,经严格筛选后最终纳入队列研究的病例数相对较少,随访时间亦相对较短;(2) 数据库中未登记患者的肌酸激酶及血磷、血钙等资料,无法更全面地评价相关药物的安全性。
综上所述,肝移植术后患者长期服用LAM或ADV治疗具有潜在的肾脏毒性,而LDT治疗则能够改善患者的eGFR,ETV治疗对患者的eGFR未见有显著影响。
| [1] | 中华医学会器官移植学分会, 中华医学会肝病学分会. 中国肝移植乙型肝炎防治指南(2016版)[J]. 中华肝脏病杂志, 2016, 24: 885–889. DOI: 10.3760/cma.j.issn.1007-3418.2016.12.002 |
| [2] | GARCES G, CONTRERAS G, CARVALHO D, JARABA I M, CARVALHO C, TZAKIS A, et al. Chronic kidney disease after orthotopic liver transplantation in recipients receiving tacrolimus[J]. Clinical Nephrology, 2011, 75: 150–157. DOI: 10.5414/CNP75150 |
| [3] | SCHMITZ V, LAUDI S, MOECKEL F, PUHL G, STOCKMANN M, TRAN Z V, et al. Chronic renal dysfunction following liver transplantation[J]. Clin Transplant, 2008, 22: 333–340. DOI: 10.1111/j.1399-0012.2008.00806.x |
| [4] | BRAUN N, DETTE S, VIEBAHN R. Impairment of renal function following liver transplantation[J]. Transplant Proc, 2003, 35: 1458–1460. DOI: 10.1016/S0041-1345(03)00486-X |
| [5] | MORARD I, MENTHA G, SPAHR L, MAJNO P, HADENGUE A, HUBER O, et al. Long-term renal function after liver transplantation is related to calcineurin inhibitors blood levels[J]. Clin Transplant, 2006, 20: 96–101. DOI: 10.1111/ctr.2006.20.issue-1 |
| [6] | LUO Q, DENG Y, CAI F F, KANG J, ZHONG S, ZHANG D Z, et al. Relationship between nephrotoxicity and long-term adefovir dipivoxil therapy for chronic hepatitis B:a meta-analysis[J/OL]. Medicine (Baltimore), 2016, 95:e5578. doi:10.1097/MD.0000000000005578. |
| [7] | GUPTA S K, ANDERSON A M, EBRAHIMI R, FRALICH T, GRAHAM H, SCHAREN-GUIVEL V, et al. Fanconi syndrome accompanied by renal function decline with tenofovir disoproxil fumarate:a prospective, case-control study of predictors and resolution in HIV-infected patients[J/OL]. PLoS One, 2014, 9:e92717. doi:10.1371/journal.pone.0092717.eCollection2014. |
| [8] | GANE E J, DERAY G, LIAW Y F, LIM S G, LAI C L, RASENACK J, et al. Telbivudinge improves renal function in patients with chronic hepatitis B[J]. Gastroenterology, 2014, 146: 138–146. DOI: 10.1053/j.gastro.2013.09.031 |
| [9] | CHAN H L, CHEN Y C, GANE E J, SARIN S K, SUH D J, PIRATVISUTH T, et al. Randomized clinical trial:efficacy and safety of telbivudine and lamivudine in treatment naive patients with HBV-related decompensated cirrhosis[J]. Viral Hepat, 2012, 19: 732–743. DOI: 10.1111/jvh.2012.19.issue-10 |
| [10] | CHOLONGITAS E, VASILIADIS T, GOULIS I, FOUZAS I, ANTONIADIS N, PAPANIKOLAOU V, et al. Telbivudine is associated with improvement of renal function in patients transplanted for HBV liver disease[J]. J Viral Hepat, 2015, 22: 574–580. DOI: 10.1111/jvh.2015.22.issue-7 |
| [11] | 中华医学会外科学分会器官移植学组. 肝移植受者肾功能损伤诊疗指南[J]. 中华移植杂志(电子版), 2011, 5: 254–256. |
| [12] | National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease:evaluation, classification, and stratification[J]. Am J Kidney Dis, 2002, 39: S1–S266. |
| [13] | STEVENS L A, CORESH J, GREENE T, LEVEY A S. Assessing kidney function-measured and estimated glomerular filtration rate[J]. N Engl J Med, 2006, 354: 2473–2483. DOI: 10.1056/NEJMra054415 |
| [14] | KIM Y J, CHO H C, SINN D H, GWAK G Y, CHOI M S, KOH K C, et al. Frequency and risk factors of renal impairment during long-term adefovir dipivoxil treatment in chronic hepatitis B patients[J]. Gastroenteml Hepatol, 2012, 27: 306–312. DOI: 10.1111/jgh.2012.27.issue-2 |
| [15] | QI X, WANG J Y, MAO R C, ZHANG J M. Impact of nucleos(t)ide analogues on the estimated glomerular filtration rate in patients with chronic hepatitis B:a prospective cohort study in China[J]. Viral Hepatitis, 2015, 22: 46–54. |
| [16] | LEE J G, LEE J, LEE J J, SONG S H, JU M K, CHOI G H, et al. Adefovir or lamivudine induced renal tubular dysfunction after liver transplantation[J]. Medicine (Baltimore), 2015, 94: e1569. DOI: 10.1097/MD.0000000000001569 |
| [17] | CIHLAR T, HO E S, LIN D C, MULATO A S. Human renal organic anion transporter 1(hOAT1) and its role in the nephrotoxicity of antiviral nucleotide analogs[J]. Nucleosides Nucleotides Nucleic Acids, 2001, 20: 641–648. DOI: 10.1081/NCN-100002341 |
| [18] | IMAOKA T, KUSUHARA H, ADACHI M, SCHUETZ J D, TAKEUCHI K, SUGIYAMA Y, et al. Functional involvement of multidrug resistance associated protein 4 in the renal elimination of the antiviral drugs adefovir and tenofovir[J]. Mol Pharmacol, 2007, 71: 619–627. |
| [19] | LIANG K H, CHEN Y C, HSU C W, CHANG M L, YEH C T. Decrease of serum angiotensin converting enzyme levels upon telbivudine treatment for chronic hepatitis B virus infection and negative correlations between the enzyme levels and estimated glumerular filtration rates[J]. Hepatitis Monthly, 2014, 14: e15074. DOI: 10.5812/hepatmon.15074 |
 2017, Vol. 38
2017, Vol. 38