下咽恶性肿瘤是头颈部常见肿瘤之一,约94.9%的病理类型为鳞状细胞癌[1],局部复发和远处转移是其极为常见的现象,且伴有转移的患者一般预后较差[2-3]。上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞的迁移和运动能力增加,从而转化成易发生侵袭和迁移的具有间质细胞特性的细胞,它是肿瘤发生转移的重要早期事件之一。EMT进程受多种蛋白的调控,包括E-钙黏蛋白(E-cadherin)等上皮细胞标志蛋白和波形蛋白(vimentin)等间质细胞标志蛋白[4-5]。E-cadherin和vimentin是肿瘤EMT最重要的指示蛋白,在EMT进程中,E-cadherin表达下调、vimentin表达上调,提示肿瘤细胞向间质表型转换,肿瘤发生了转移[6-7]。
已知p63是p53家族成员之一,与p53在序列和结构上具有高度同源性[8]。在头颈鳞癌细胞中,p63主要分布亚型为ΔNp63[9],其在调控细胞分化、肿瘤发生等方面具有重要作用[9-10]。但下咽鳞状细胞癌(hypopharyngeal squamous cell carcinoma,HSCC)中ΔNp63与EMT的关系目前尚未有深入研究。本研究用免疫组织化学方法检测了HSCC中ΔNp63及EMT标志蛋白E-cadherin、vimentin的表达情况,探讨了HSCC中ΔNp63的表达与E-cadherin、vimentin的相关性及其对HSCC临床病理特征的影响,为研究HSCC的局部复发和远处转移机制提供理论依据。
1 材料和方法 1.1 材料来源选取第二军医大学长海医院耳鼻咽喉头颈外科2013年1月至2016年11月收治的98例HSCC患者的HSCC组织及相应癌旁正常组织。所有患者均经病理诊断确诊为HSCC。患者术前均未接受化疗、放疗及其他辅助治疗,且临床病例资料完整。所有患者的临床诊断均由2名具有高级职称的耳鼻咽喉头颈外科专科医师根据2010年美国癌症联合会(AJCC)第7版分期标准[11]进行临床分期。本研究经长海医院伦理委员会批准,并获得患者或家属知情及签署同意书。
1.2 主要试剂兔抗人p63(recognizes ΔN-isoforms)单克隆抗体购自美国BioLegend公司(批号619002,工作浓度1:400),兔抗人E-cadherin(批号3195)、vimentin(批号5741) 单克隆抗体购自美国CTS公司(工作浓度1:100),DAB染色液试剂盒(K5007) 购自美国Dako公司,正常山羊血清购自武汉博士德生物工程有限公司(AR1009),其他免疫组化试剂均购自湖北百奥斯生物科技有限公司。
1.3 免疫组织化学法染色采用即用型(EnVision)快速酶免疫组化二步法染色。标本用10%多聚甲醛溶液固定,石蜡包埋,5 μm厚连续切片。石蜡切片经脱蜡、梯度水化后,置pH 6.0枸橼酸缓冲液中,高温修复2 min后冷却。加入3%过氧化氢室温放置20 min以阻断内源性过氧化物酶,Tris-HCl缓冲盐溶液(TBS)冲洗3次,10%山羊血清孵育30 min。去除血清,滴加适当稀释至工作浓度的一抗,4 ℃反应过夜,TBS冲洗。每张片子滴加50 μL Dako二抗,室温孵育25 min,TBS冲洗后每张切片滴加50 μL DAB显色。苏木精复染,1%盐酸乙醇分化1~2 s后返蓝液返蓝,自来水冲洗。梯度乙醇脱水后二甲苯透明,中性树胶封片。以PBS代替一抗作阴性对照。
1.4 染色结果判定标准在显微镜下观察组织染色情况,选择组织结构清晰、无明显背景的视野进行观察,使用二级计分法[12-13]判定表达强度。400倍视野下随机选取5个含有肿瘤细胞的区域,每个区域计数100个细胞。二级计分法具体操作:(1) 按照显色强度差异计分。细胞不着色记为0分,浅黄色记1分,棕黄色记2分,棕褐色记3分。(2) 按照阳性细胞所占比例计分。<5%记0分,5%~25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。将上述两项得分相乘,所得分数即为每例病例标本的最终得分,以此进行标本病例分组:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.5 统计学处理应用SPSS 16.0软件进行数据处理及分析。采用秩和检验比较肿瘤组织与癌旁正常上皮组织中ΔNp63、E-cadherin、vimentin蛋白表达的差异和各蛋白表达强度与临床病理特征的关系,以及肿瘤中央区和边缘区各蛋白表达的差异。采用Spearman等级相关检验分析各蛋白之间的相关性。检验水准(α)为0.05。
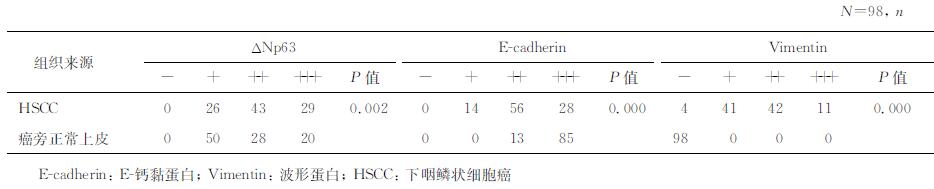
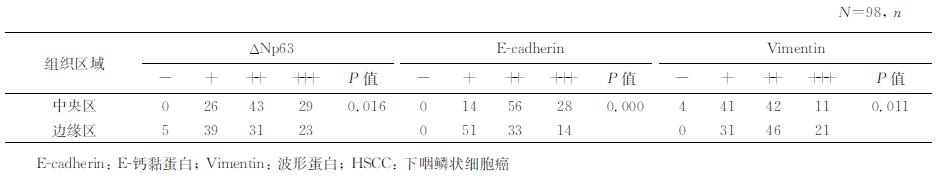
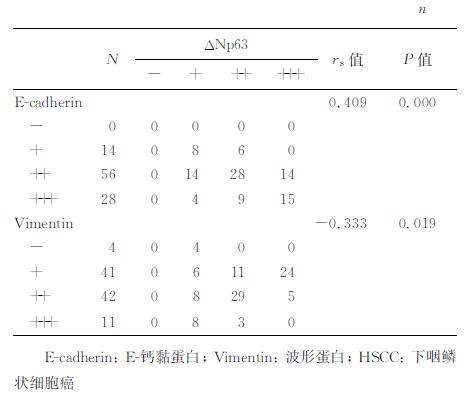
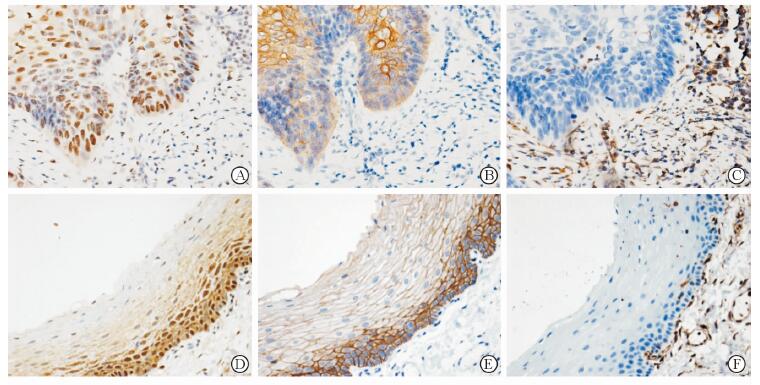
2 结果 2.1 HSCC组织及其癌旁正常上皮组织中ΔNp63、E-cadherin及vimentin蛋白的表达ΔNp63的阳性产物主要定位于细胞核,呈棕黄色或棕褐色颗粒状。HSCC组织中ΔNp63阳性细胞排列紊乱,胞核大小各异(图 1A);癌旁正常上皮组织中ΔNp63阳性细胞主要位于上皮基底细胞层,多为棕褐色,在上层角质形成细胞中表达较弱,其在间质细胞中并无表达(图 1D)。HSCC组织中ΔNp63的表达强度较癌旁正常上皮组织升高,差异有统计学意义(P<0.01,表 1)。HSCC组织中E-cadherin的阳性产物主要定位于胞膜,呈线性棕黄色分布;其在胞质中也有少量分布,呈弥漫性黄色(图 1B、1E)。98例HSCC组织标本均检测到E-cadherin的表达,但其表达强度较癌旁正常上皮组织降低(P<0.01,表 1)。Vimentin呈棕黄色或者棕褐色染色,在已发生EMT的HSCC组织中主要定位于胞质(图 1C),其在癌旁正常上皮组织中未见表达(图 1F)。在94例已发生EMT的HSCC组织中检测到vimentin的表达,而癌旁正常上皮组织中均未检测到vimentin表达,差异有统计学意义(P<0.01,表 1)。
|
图 1 ΔNp63、E-cadherin、vimentin在HSCC组织及癌旁正常上皮组织中的表达(免疫组化EnVison二步法染色) A~C: ΔNp63 (A)、E-cadherin (B)、vimentin (C)在HSCC组织中的表达; D~F: ΔNp63 (D)、E-cadherin (E)、vimentin (F)在癌旁正常上皮组织中的表达. E-cadherin: E-钙黏蛋白; Vimentin:波形蛋白; HSCC:下咽鳞状细胞癌. Original magnification: ×400 |
|
|
表 1 ΔNp63、E-cadherin和vimentin在HSCC组织及癌旁正常上皮组织中的表达 |
与肿瘤中央区相比,肿瘤边缘区ΔNp63、E-cadherin的阳性表达强度下降,vimentin的阳性表达强度上升,差异具有统计学意义(P均<0.05,表 2)。
|
|
表 2 HSCC组织不同区域中ΔNp63、E-cadherin和vimentin的表达 |
2.2 EMT标志蛋白E-cadherin、vimentin的表达强度与ΔNp63的相关性
经Spearmen等级相关检验分析结果显示,在HSCC组织中ΔNp63与E-cadherin的表达呈正相关(rs=0.409,P<0.01;表 3),随着ΔNp63表达的增强,E-cadherin表达亦增强。而ΔNp63与vimentin的表达呈负相关(rs=-0.333,P<0.05;表 3),vimentin随着ΔNp63表达的增强而降低。
|
|
表 3 ΔNp63与E-cadherin及vimentin在HSCC组织中表达的相关分析 |
2.3 HSCC组织中ΔNp63、E-cadherin及vimentin表达强度与临床病理特征的关系
见表 4。ΔNp63蛋白在HSCC组织中的表达强度与年龄、性别、病理分化程度、T分期、有无淋巴结转移、临床分期等临床病理特征均无关(P均>0.05)。E-cadherin的表达强度随病理分化程度降低而降低,且与有无淋巴结转移有关(P<0.05),vimentin的表达强度随病理分化程度降低而升高,且与有无淋巴结转移有关(P<0.05)。E-cadherin及vimentin与年龄、性别、T分期、临床分期等无关(P均>0.05)。
|
|
表 4 HSCC组织中ΔNp63与E-cadherin及vimentin表达与临床病理特征的关系 |
3 讨论
ΔNp63作为转录因子具有广泛的转录调控作用,参与调控细胞的分化、干性、死亡、衰老、迁移以及扩散[14]。目前研究认为ΔNp63是头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)中p63的主要存在形式,可能是p63影响HNSCC预后的主要因素[9]。ΔNp63在HNSCC中可以调控肿瘤细胞的增殖,增加肿瘤细胞对顺铂的耐药性,是HNSCC的重要预后标志物之一[15-16]。本研究检测了98例HSCC标本中ΔNp63蛋白的表达,结果显示ΔNp63主要定位于细胞核,与文献[15-17]所报道的ΔNp63的分布情况一致。同时本研究还发现,ΔNp63在肿瘤组织及癌旁正常组织中呈差异性表达,提示ΔNp63与HSCC的发生、发展有密切关系。本研究结果表明ΔNp63与患者的临床分期以及病理分化程度无关,这可能与HSCC的早期诊断率低、本组数据中Ⅲ~Ⅳ期患者数量较多(79.59%)有关,需进一步增加早期患者的样本量来获得更准确的结果。
EMT是影响肿瘤转移的重要早期事件,早在2002年,Thiery[18]就提出恶性肿瘤细胞发生转移前通过EMT获得侵袭和转移能力,自此EMT成为解释肿瘤转移的重要理论。恶性肿瘤可以通过EMT获得活动性间质表型及迁移侵袭能力,且能导致细胞迁移到不相邻的靶位点[19-20]。目前研究认为,EMT在HNSCC的转移过程中发挥了重要作用[21],其中E-cadherin和vimentin可作为HNSCC肿瘤EMT进程的可靠标志物[6-7, 22]。本研究发现E-cadherin和vimentin的表达强度与HSCC的病理分化程度及有无淋巴结转移有关,表明这两种蛋白在肿瘤的发展、转移过程中具有重要作用,可作为HSCC转移的生物标志物。
目前研究认为,ΔNp63在多种肿瘤中可以调控恶性细胞的EMT进程。研究发现在宫颈鳞癌中ΔNp63可上调miR-205的表达,而miR-205可抑制Zeb1和vimentin的表达,肿瘤组织中ΔNp63表达的降低增加了肿瘤细胞的迁移和侵袭能力[23],提示ΔNp63具有抑制EMT的作用。在乳腺癌中,ΔNp63通过提高EMT相关蛋白Slug和Axl的表达诱导迁移,同时上调miR-205的表达,从而抑制由EMT诱导引起的上皮特性的丧失[24]。提示ΔNp63调控EMT的作用可能具有组织特异性,而关于ΔNp63在HSCC EMT中的作用目前尚未见报道。
为明确ΔNp63在HSCC中对EMT的调控作用,本研究采用免疫组织化学方法检测了EMT标志蛋白E-cadherin、vimentin的表达,并分析其与ΔNp63蛋白表达的相关性。结果发现在肿瘤组织中,ΔNp63蛋白的表达强度与E-cadherin呈正相关,与vimentin呈负相关。相较中央区肿瘤组织,边缘区呈侵袭性生长的肿瘤组织中ΔNp63的表达下降,同时伴随E-cadherin表达减少及vimentin表达升高。结果提示ΔNp63在HSCC肿瘤组织中可能具有抑制EMT进程的作用。
综上,ΔNp63在HSCC早期的生物学进程调控中可能具有重要作用,其作用可能具有高度的组织特异性,并在肿瘤发展的不同阶段不尽相同。在HSCC早期,ΔNp63可促进细胞增殖,但当肿瘤发展到中晚期时,ΔNp63可抑制细胞EMT进程,局部肿瘤组织可下调ΔNp63表达从而增强肿瘤的侵袭性。因此,ΔNp63可能与HSCC的发生、发展有关,且具有抑制EMT的作用,但具体作用机制仍有待进一步研究。
| [1] | COOPER J S, PORTER K, MALLIN K, HOFFMAN H T, WEBER R S, ANG K K, et al. National Cancer Database report on cancer of the head and neck:10-year update[J]. Head Neck, 2009, 31: 748–758. DOI: 10.1002/hed.v31:6 |
| [2] | TINHOFER I, KONSCHAK R, STROMBERGER C, RAGUSE J D, DREYER J H, JOHRENS K, et al. Detection of circulating tumor cells for prediction of recurrence after adjuvant chemoradiation in locally advanced squamous cell carcinoma of the head and neck[J]. Ann Oncol, 2014, 25: 2042–2047. DOI: 10.1093/annonc/mdu271 |
| [3] | SMITH R B. Surgery in the management of laryngeal and hypopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2007, 69(2 Suppl): S28–S30. |
| [4] | KONG D, LI Y, WANG Z, SARKAR F H. Cancer stem cells and epithelial-to-mesenchymal transition (EMT)-phenotypic cells:are they cousins or twins?[J]. Cancer (Basel), 2011, 3: 716–729. DOI: 10.3390/cancers30100716 |
| [5] | LIU L K, JIANG X Y, ZHOU X X, WANG D M, SONG X L, JIANG H B. Upregulation of vimentin and aberrant expression of E-cadherin/beta-catenin complex in oral squamous cell carcinomas:correlation with the clinicopathological features and patient outcome[J]. Mod Pathol, 2010, 23: 213–224. DOI: 10.1038/modpathol.2009.160 |
| [6] | NIJKAMP M M, SPAN P N, HOOGSTEEN I J, VAN DER KOGEL A J, KAANDERS J H, BUSSINK J. Expression of E-cadherin and vimentin correlates with metastasis formation in head and neck squamous cell carcinoma patients[J]. Radiother Oncol, 2011, 99: 344–348. DOI: 10.1016/j.radonc.2011.05.066 |
| [7] | KIM K H, KIM L, CHOI S J, HAN J Y, KIM J M, CHU Y C, et al. The clinicopathological significance of epithelial mesenchymal transition associated protein expression in head and neck squamous cell carcinoma[J]. Korean J Pathol, 2014, 48: 263–269. DOI: 10.4132/KoreanJPathol.2014.48.4.263 |
| [8] | SCHMALE H, BAMBERGER C. A novel protein with strong homology to the tumor suppressor p53[J]. Oncogene, 1997, 15: 1363–1367. DOI: 10.1038/sj.onc.1201500 |
| [9] | SNIEZEK J C, MATHENY K E, WESTFALL M D, PIETENPOL J A. Dominant negative p63 isoform expression in head and neck squamous cell carcinoma[J]. Laryngoscope, 2004, 114: 2063–2072. DOI: 10.1097/01.mlg.0000149437.35855.4b |
| [10] | CANDI E, SMIRNOV A, PANATTA E, LENA A M, NOVELLI F, MANCINI M, et al. Metabolic pathways regulated by p63[J]. Biochem Biophys Res Commun, 2017, 482: 440–444. DOI: 10.1016/j.bbrc.2016.10.094 |
| [11] | EDGE S, BYRD D R, COMPTON C C, FRITZ A G, GREENE F L, TROTTI A. AJCC cancer staging manual[M]. 7th ed. New York: Springer, 2010: 4-5. |
| [12] | DOHADWALA M, WANG G, HEINRICH E, LUO J, LAU O, SHIH H, et al. The role of ZEB1 in the inflammation-induced promotion of EMT in HNSCC[J]. Otolaryngol Head Neck Surg, 2010, 142: 753–759. DOI: 10.1016/j.otohns.2010.01.034 |
| [13] | ZHU M, YIN F, FAN X, JING W, CHEN R, LIU L, et al. Decreased TIP30 promotes Snail-mediated epithelial-mesenchymal transition and tumor-initiating properties in hepatocellular carcinoma[J]. Oncogene, 2015, 34: 1420–1431. DOI: 10.1038/onc.2014.73 |
| [14] | ROMANO R A, ORTT K, BIRKAYA B, SMALLEY K, SINHA S. An active role of the Delta N isoform of p63 in regulating basal keratin genes K5 and K14 and directing epidermal cell fate[J/OL]. PLoS One, 2009, 4:e5623. doi:10.1371/journal.pone.0005623. |
| [15] | BRETZ A C, GITTLER M P, CHARLES J P, GREMKE N, ECKHARDT I, MERNBERGER M, et al. ΔNp63 activates the Fanconi anemia DNA repair pathway and limits the efficacy of cisplatin treatment in squamous cell carcinoma[J]. Nucleic Acids Res, 2016, 44: 3204–3218. DOI: 10.1093/nar/gkw036 |
| [16] | SUAREZ C M, HUBERT P, GONZALEZ A, DURAY A, RONCARATI P, ERPICUM C, et al. Delta Np63 isoform-mediated β-defensin family up-regulation is associated with (lymph)angiogenesis and poor prognosis in patients with squamous cell carcinoma[J]. Oncotarget, 2014, 5: 1856–1868. DOI: 10.18632/oncotarget |
| [17] | 林树春, 林国经, 黄建民. 下咽鳞状细胞癌组织中ΔNp63和TAp63蛋白的表达及临床意义[J]. 中国肿瘤临床与康复, 2013, 20: 1061–1066. |
| [18] | THIERY J P. Epithelial-mesenchymal transitions in tumor progression[J]. Nat Rev Cancer, 2002, 2: 442–454. DOI: 10.1038/nrc822 |
| [19] | LAMOUILLE S, XU J, DERYNCK R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15: 178–196. DOI: 10.1038/nrm3758 |
| [20] | VOULGARI A, PINTZAS A. Epithelial-mesenchymal transition in cancer metastasis:mechanisms, markers and strategies to overcome drug resistance in the clinic[J]. Biochim Biophys Acta, 2009, 1796: 75–90. |
| [21] | LIN Y, MALLEN-St CLAIR J, LUO J, SHARMA S, DUBINETT S, St JOHN M. p53 modulates NF-κB mediated epithelial-to-mesenchymal transition in head and neck squamous cell carcinoma[J]. Oral Oncol, 2015, 51: 921–928. DOI: 10.1016/j.oraloncology.2015.07.006 |
| [22] | HU Z, QIAN G, MULLER S, XU J, SABA N F, KIM S, et al. Biomarker quantification by multiplexed quantum dot technology for predicting lymph node metastasis and prognosis in head and neck cancer[J]. Oncotarget, 2016, 7: 44676–44685. |
| [23] | ZHAO W D, WANG H Y, HAN H X, MA J, ZHOU Y Y, CHEN Z Z, et al. ΔNp63α attenuates tumor aggressiveness by suppressing miR-205/ZEB1-mediated epithelial-mesenchymal transition in cervical squamous cell carcinoma[J]. Tumour Biol, 2016, 37: 10621–10632. DOI: 10.1007/s13277-016-4921-5 |
| [24] | DANG T T, ESPARZA M A, MAINE E A, WESTCOTT J M, PEARSON G W. ΔNp63α promotes breast cancer cell motility through the selective activation of components of the epithelial-to-mesenchymal transition program[J]. Cancer Res, 2015, 75: 3925–3935. DOI: 10.1158/0008-5472.CAN-14-3363 |
 2017, Vol. 38
2017, Vol. 38