来自于循序分化的成体器官的细胞以往一直被认为是定型且表型不易发生改变[1-2],然而近年来研究表明,基于细胞谱系-转录因子的显著作用,通过转分化将一种分化的细胞类型绕过多能干细胞的状态直接转化为另一种细胞类型是可行的[3]。最初的转分化现象在两栖动物下肢的再生和蝴蝶幼虫变态发育中被观察到[4-5],此后,生理情况下肠上皮化生和肿瘤发生中也发现转分化现象的存在[6]。运用病毒转导谱系特异性转录因子或Yamanaka因子联合特定的培养条件可以将成纤维细胞(fibroblasts,Fbs)转分化为神经元、心肌细胞、血液祖细胞、肝细胞、胰腺β细胞、上皮干细胞等[7-9]。过去数十年,新的技术和筛选途径被用来选择合适的用于谱系转变的转录因子。但以上转分化途径都依赖于病毒载体和基因材料,安全性隐患限制了其临床应用。因此,学者们开始使用不涉及病毒载体的小分子策略诱导体细胞转分化[10-13]。但迄今为止仅有少量关于用小分子策略实现心肌Fbs向内皮细胞(endothelial cells,ECs)转分化的报道[11, 13],且都是孤立性的未被重复的研究。
急性心肌梗死后,心肌局部缺血缺氧引起的级联瀑式反应导致心肌细胞的丢失和心功能受损。心肌Fbs在损伤部位的增殖伴随ECs的招募和扩增[14]。ECs可以促进损伤部位的血管新生[15]和损伤后修复[16]。反应性纤维化和缺血后血管新生在损伤后早期发生,两者密切的时空交互作用被认为可以显著影响瘢痕负荷和功能修复,经历内皮间质转变[17],同时Fbs分泌促进血管形成的分子反馈性促血管新生[18-19]。但心肌Fbs被认为是一种终末分化的定型细胞[20-21],因此目前还不清楚在急性心肌缺血损伤环境下,不依赖于外源性基因整合的Fbs是否能反方向地向ECs谱系转化,进而促进“功能性血管新生”。为进一步了解心肌Fbs向ECs转分化的可能性和分子机制,本研究通过体外干预心肌Fbs,模拟体内急性心肌梗死缺血缺氧的微环境,观察血清剥夺细胞应激对心肌Fbs表型、功能及血管新生的影响,为小分子的化学转分化在急性心肌缺血损伤时“治疗性血管新生”的临床应用提供理论依据。
1 材料和方法 1.1 实验动物所有动物研究均获得上海市实验动物管理办公室和上海市科学技术委员会批准。1~3日龄的野生型C57BL/6小鼠购于中国科学院上海药物研究所,动物生产许可证号:SCXK(沪)2013-0017。
1.2 试剂与仪器DMEM培养基、胎牛血清(fetal calf serum,FBS)、胰酶-EDTA购自美国Gibco公司;碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、Ⅰ型脱氧核糖核酸酶(DNaseⅠ)、中性蛋白酶(Dispase)、Ⅳ型胶原酶购自美国Sigma公司;白血病抑制因子(leukemia inhibitory factor,LIF)购自美国Cell Signaling Technology公司;血管内皮生长因子(VEGF) ELISA检测试剂盒购自北京达科为生物技术有限公司。恒温CO2细胞培养箱(型号:HERA cell 150i,美国Thermo Fisher公司);IX-70倒置显微镜(型号:IX71-A12FL/PH,日本Olympus公司);CFX ConnectTM定量PCR仪(型号:788BR01921,美国Bio-Rad公司);Thermal Cycler PCR仪(型号:TP600,日本TaKaRa公司)。细胞培养皿、多孔板、超净台(型号:CA950-2,上海净化仪器厂),台式离心机(型号:TGL-16C,上海安亭科学仪器厂)。
1.3 Fbs分离、培养及鉴定腹腔麻醉1~3日龄C57BL/6新生小鼠,取新鲜心脏组织,并剪成约1 mm3的组织碎块;加入1 mL混合消化酶(7.5 mg/mL DNase Ⅰ、2 mg/mL Dispase、1.5 mg/mL Ⅳ型胶原酶,按1:1:1比例配制),37 ℃水浴孵育20 min。取上清1 180×g离心5 min,用含10% FBS、10 ng/μL LIF和10 ng/μL bFGF的DMEM培养液重悬细胞沉淀;同时,剩余组织沉淀加入5 mL新的混合消化酶,震荡混悬,37 ℃水浴孵育10 min。取上清,离心、重悬,加入新的消化酶消化,重复上述操作3~4次,直至组织块成黏稠泥状终止消化。分离的细胞用培养液重悬后置于细胞培养箱中(37 ℃,5% CO2)孵育过夜,第2天换液,PBS洗去未贴壁细胞,再加入含有10% FBS、10 ng/μL LIF、10 ng/μL bFGF的DMEM培养液继续培养,隔2~3 d换液1次,细胞生长至80%~85%融合时,传代继续培养。在倒置显微镜下观察Fbs形态,用qPCR法检测Fbs的标志物,鉴定Fbs的表型特点。
1.4 实验分组取第3代Fbs,用0.25%胰酶消化接种至6孔板,培养至细胞融合度达85%左右,将细胞分为对照组(含10%FBS的DMEM培养液培养)和血清剥夺(不含FBS的单纯DMEM培养液培养) 24 h组、血清剥夺48 h组、血清剥夺72 h组,以及血清剥夺48 h且全程不添加LIF组。
1.5 Fbs内皮表面标志物检测取心肌Fbs抽提RNA并反转录为cDNA,采用CFX ConnectTM定量PCR仪和SYBR Green Master Mix试剂盒(Roche公司)行qPCR,以GAPDH为内参,检测谱系特异性基因CD31、血管内皮钙黏素(VE-herin)、波形蛋白(vimentin)、胰岛因子1(isl-1) 的相对表达量。引物序列:GAPDH上游5′-TGG ATT TGG ACG CAT TGG TC-3′,下游5′-TTT GCA CTG GTA CGT GTT GAT-3′;CD31上游5′-ACG CTG GTG CTC TAT GCA AG-3′,下游5′-TCA GTT GCT GCC CAT TCA TCA-3′;VE-herin上游5′-CAG GCT GGG TCC ACA ATT AGG-3′,下游5′-TGC AGC GAG TTC CTC TAC CT-3′;vimentin上游5′-CGG CTG CGA GAG AAA TTG C-3′,下游CCA CTT TCC GTT CAA GGT CAA G-3′;isl-1上游5′-ATG GCT AGG AAC GCC TAC TTC-3′,下游5′-CCC AAG TTA AAC GGT CTT CAGT-3′。每组设3个复孔,实验重复3次。
1.6 Martrigel体外血管新生实验采用体外血管新生试剂盒检测血清剥夺干预后Fbs的体外血管新生能力。将ECMatrixTM溶液和稀释缓冲液置于0 ℃冰浴中,取100 μL制冷后的10×稀释缓冲液置于1 mL离心管中,加入900 μL ECMatrixTM溶液,在4 ℃条件下混匀制备成ECMatrixTM工作液,低温以避免ECMatrixTM凝胶凝固。取96孔板,每孔加入50 μL ECMatrixTM工作液,37 ℃孵育60 min,使ECMatrixTM凝胶凝固。混合消化酶消化(浓度同上)收集Fbs,血清剥夺或非血清剥夺细胞分别培养在含1×链霉素/青霉素的DMEM培养液或含1×链霉素/青霉素、10%FBS的DMEM培养液中。以106/孔的细胞密度将Fbs细胞悬液铺于已凝固的凝胶上,置于37 ℃、5% CO2的细胞培养箱中孵育,观察细胞交联和管状结构形成情况,最长孵育15 h后细胞开始凋亡。在倒置荧光显微镜下拍照,随机选取低倍镜下(40×) 6个视野,计数微血管分叉点数。
1.7 检测Fbs吞噬Dil-Ac-LDL的能力使用单纯无血清DMEM培养液稀释Dil-Ac-LDL至50 μg/mL,酶消化离心收集细胞,用适量DMEM培养液重悬,每孔加入1×106的细胞至96孔板,加入稀释后的Dil-Ac-LDL工作液50 μL,置于37 ℃、5% CO2的细胞培养箱中孵育4 h。移除培养液,PBS洗涤3次,荧光显微镜下观察并拍照(激发波长549 nm,发射波长565 nm)。
1.8 检测Fbs分泌VEGF的能力采用小鼠VEGF ELISA检测试剂盒检测血清剥夺后Fbs分泌VEGF的情况。首先制备标准曲线,后取细胞培养上清100 μL,加入到96孔板孔中,37 ℃孵育90 min,PBS洗涤3次,加入以适当比例稀释的生物素标记的人VEGF抗体工作液100 μL,37 ℃孵育60 min。PBS洗涤5次。每孔加入90 μL四甲基联苯胺(TMB)缓冲液,避光孵育25 min,显色反应完成后立即加入100 μL TMB终止液终止反应。在终止反应30 min内,酶标仪波长选择450 nm为检测波长,603 nm为参考波长,检测光密度(D)值。根据标准曲线获得VEGF质量浓度。
1.9 统计学处理应用SPSS 18.0软件进行数据分析。所有计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用Student’s t检验。检验水准(α)为0.05。
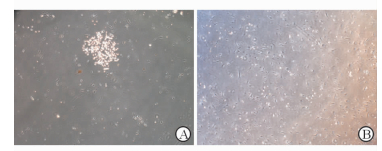
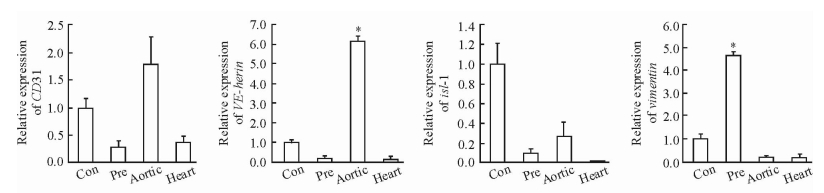
2 结果 2.1 Fbs培养及鉴定原代培养第3天可见Fbs呈突起的纺锤形和新月形结构,其中可见少量搏动的心肌细胞,互相拼凑成岛屿状,部分单个细胞呈圆形,贴壁不完全(图 1A);传代后具有搏动能力的心肌细胞消失,剩余细胞均匀分布、贴壁良好,细胞有突起,部分相互交联,当细胞密度达85%~95%融合时予传代培养。经过2次传代,培养至7~10 d,第3代Fbs互相交联,此时细胞主要为星形的扁平状结构,伴少许纺锤形和新月形细胞(图 1B)。qPCR鉴定结果(图 2)显示在血清剥夺干预前,细胞表达Fbs特异性标志物vimentin,而不表达ECs特异性表面标志物CD31、VE-herin和心肌、内皮干/祖细胞特异性标志物isl-1,表明成功培养获得Fbs。
|
图 1 培养3~10 d时Fbs的形态特点 Fig 1 Morphology characteristics of fibroblasts (Fbs)after culturing for 3-10 d A: Fbs grew in clusters; B: Fbs were either star-shaped or spindles and mutually crosslinked. Original magnification: ×40 |
|
图 2 血清剥夺干预前Fbs的鉴定 Fig 2 Identification of fibroblasts (Fbs) before serum deprivation intervention Con: Newborn C57BL/6 mouse derma; Pre: Newborn C57BL/6 mouse cardiac Fbs (passage 3); Aortic: Newborn C57BL/6 mouse aortic; Heart: Newborn C57BL/6 mouse heart tissue. *P < 0.05 vs Con. n=3, x±s |
2.2 各组Fbs体外血管新生比较
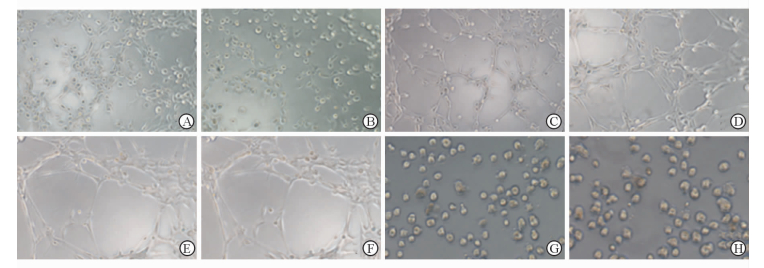
与对照组(0) 比较,各血清剥夺组Fbs形成血管分叉的数目均增加(P<0.05)。与血清剥夺24 h组(8.1±1.3) 和血清剥夺72 h组(12.3±1.8) 相比,血清剥夺48 h组(20.0±2.2) Fbs的血管分叉结构增加(P<0.05);此外,与血清剥夺48 h且全程不添加LIF组(0) 比较,血清剥夺48 h组Fbs形成血管结构的能力也提高(P<0.05)。表明血清剥夺可以提高小鼠心肌Fbs的体外微血管形成能力。见图 3。
|
图 3 各组Fbs体外血管新生情况 Fig 3 Microvascular of fibroblasts (Fbs) in vitro in each group A, B: Microvascular at 24 h of serum deprivation in vitro; C, D: Microvascular at 48 h of serum deprivation in vitro; E, F: Microvascular at 72 h of serum deprivation in vitro; G: Microvascular at 48 h of control group in vitro; H: Microvascular at 48 h of serum deprivation without LIF in vitro. LIF: Leukemia inhibitory factor. Original magnification: ×40 |
2.3 Fbs吞噬Dil-Ac-LDL功能实验结果
倒置荧光显微镜下观察发现,各组Fbs中均未观察到诱导细胞吞噬Dil-Ac-LDL的现象。
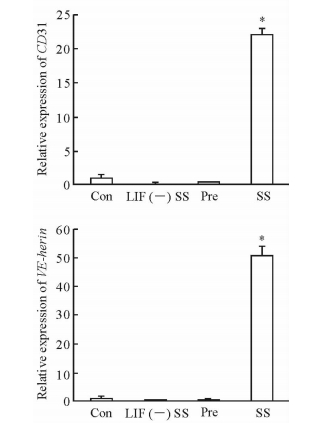
2.4 Fbs内皮表面标志物的变化与对照组相比,血清剥夺48 h组Fbs中内皮特异性基因CD31和VE-herin的表达均升高(P<0.05);而血清剥夺48 h且全程不添加LIF组Fbs中CD31和VE-herin的表达无明显变化(P>0.05,图 4),表明血清剥夺未能促进其向内皮转分化。进一步比较不同干预时间组Fbs中CD31的表达变化,可见血清剥夺24 h组Fbs中CD31的表达和对照组相比无明显变化,而血清剥夺48 h组是对照组的13.7倍(P<0.05),血清剥夺72 h组是对照组的2倍(P<0.05),见图 5。
|
图 4 血清剥夺48 h后各组Fbs内皮表面标志物的表达 Fig 4 Expression of endothelial markers in fibroblasts (Fbs)after serum deprivation for 48 h Con: Control; LIF(-)SS: Serum deprivation for 48 h without leukemia inhibitory factor (LIF); Pre: Pre-intervention cell group; SS: Serum deprivation for 48 h. *P < 0.05 vs Con. n=3, x±s |
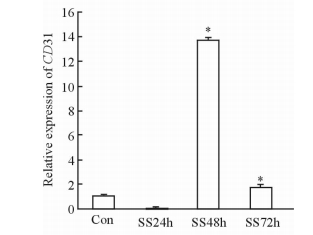
|
图 5 血清剥夺不同时间点Fbs中CD31的表达 Fig 5 Expression of CD31 in fibroblasts (Fbs) after differenttimes of serum deprivation Con: Control; SS24h: Serum deprivation for 24 h; SS48h: Serum deprivation for 48 h; SS72h: Serum deprivation for 72 h. *P < 0.05 vs Con. n=3, x±s |
2.5 血清剥夺后Fbs分泌VEGF的能力变化
血清剥夺24 h组VEGF的浓度与对照组相比差异无统计学意义[(21.38±9.36) pg/mL vs (34.74±12.46) pg/mL, P>0.05];而血清剥夺48 h组[(243.70±24.95) pg/mL]是对照组的7倍,血清剥夺72 h组[(127.137±22.88) pg/mL]是对照组的3.7倍,差异均有统计学意义(P<0.05)。血清剥夺48 h组Fbs分泌的VEGF量最多,与其他时间点血清剥夺组相比差异均有统计学意义(P<0.05)。
3 讨论分化成熟的细胞在损伤修复进程中可以改变它们的细胞表型[21]。本研究显示已分化的心肌Fbs保有一定程度的细胞谱系可塑性,即具有在细胞应激下向内皮样细胞表型转分化的固有潜能。目前,有关心肌常驻Fbs的细胞重编程已有报道。Wong和Cooke[22]发现仅用ETV2、FLⅡ、GATA2和KLF4这4种内皮转录因子即可将人新生包皮Fbs转分化为ECs,Fbs转染病毒载体编码的这4种转录因子的开放阅读框后,KDR、CD31、CD144、FLⅡ、GATA2和KIF4等内皮基因的表达显著上调。此外,其他重编程策略也证明人类和小鼠Fbs都可以被转分化为ECs样的表型[23-25]。
虽然通过信号转导因子将Fbs转分化为ECs可作为一种潜在的治疗血管新生的ECs来源,但利用Fbs固有的细胞可塑性促进血管新生和潜在性减少瘢痕形成来修复损伤心肌,则是一种更新颖的转化策略。Fbs保有这种特定的转分化为ECs的内在潜能并不令人惊讶。无论是在静息状态还是在损伤的心脏组织中,Fbs都具有广泛的功能,其在发生、发展至成年过程中与ECs有着紧密的功能性关联[14]。心肌梗死后,反应性纤维化和血管新生产生紧密的时空关联,缺血损伤局部的微环境也可能有利于转分化的发生。本研究通过血清剥夺诱导Fbs向ECs转化,支持了Fbs和ECs存在紧密关联这一观点,也证实了在应激条件下Fbs也可以发生转分化。此外,本研究采用血清剥夺的细胞应激,旨在模拟急性心肌梗死时局部组织缺血缺氧的微环境,结果显示血清剥夺刺激可激活心肌Fbs转分化为ECs。但相关的具体机制尚需要进一步探索。有研究发现,p53及其上下游靶点等应激相关的基因和信号通路中的靶点可能会影响Fbs向ECs转分化[11-12]。此外,Ubil等[11]发现在小鼠急性心肌梗死造模过程中,心肌Fbs(运用示踪技术)从间质向内皮谱系转变的过程除依赖p53的调控外,也可能与心肌梗死细胞应激、局部微环境炎症反应及酸性环境等有关,但具体机制还不清楚,由此可推测损伤心肌局部微环境中的细胞因子、炎症介质、激素或外泌体等也可能调控Fbs转分化为ECs,从而影响血管新生和损伤修复,表明Fbs可能是一种新颖和强有力的ECs形成来源。
间质内皮转化(MEndoT)是一种目前还不为人熟知的生理现象,其在心肌损伤时可能发挥着重要的生理性作用[8];功能上,MEndoT可通过提供一种高效的策略快速提高心脏损伤区域的血管新生,抑制或中断MEndoT可能会损害心肌梗死后血管新生和心脏功能的修复。研究发现,非基因整合的方式——化学转分化可以用来加强MEndoT和促进损伤后血管新生,提示MEndoT也许可以作为提高血管化和修复缺血组织的治疗性靶点[8, 13, 26]。本研究分析显示血清剥夺的Fbs呈现类似于ECs的表型,其表达CD31和VE-herin的能力显著提高,在功能学上获得了ECs的一些特点,其在体外形成微血管和分泌VEGF的能力较非血清剥夺干预细胞显著提高。然而,Dil-Ac-LDL吞噬功能实验结果显示各组均未观察到诱导细胞吞噬Dil-Ac-LDL现象,由此可推测血清剥夺后产生的诱导型ECs可能是一种幼稚的、功能不完全的细胞,血清剥夺也可能抑制了诱导细胞的部分功能。但在血清剥夺后再加入FBS,观察和评估诱导细胞是否能维持内皮表型、诱导细胞传代后能否维持表型稳定及维持时间均有待进一步研究。综上,血清剥夺导致小鼠心肌Fbs表达多种内皮特异性标志物,其中分泌VEGF的能力显著增加,并且在体外形成微血管样结构,表明血清剥夺诱导了Fbs向内皮转分化。未来研究可通过阐明血清剥夺诱导转分化的具体分子机制来调控Fbs向ECs的谱系转变,促进血管新生和心肌损伤修复,此外,还可通过示踪技术来证明在体Fbs向内皮转分化的生理学进程和相应治疗的重要性和可行性。
综上所述,Fbs具有转分化为ECs的潜能,激活这种潜能并促进“治疗性血管新生”的同时减轻纤维化将是一种新颖的、有前景的心肌缺血损伤的治疗策略,而完全使用小分子的不整合外源性基因的化学转分化将是再生医学的理想目标之一。
| [1] | QIAN L, HUANG Y, SPENCER C, FOLEY A, VEDANTHAM V, LIU L, et al. In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes[J]. Nature, 2012, 485: 593–598. DOI: 10.1038/nature11044 |
| [2] | SONG K, NAM Y J, LUO X, QI X, TAN W, HUANG G N, et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors[J]. Nature, 2012, 485: 599–604. DOI: 10.1038/nature11139 |
| [3] | CAIAZZO M, GIANNELLI S, VALENTE P, LIGNANI G, CARISSIMO A, SALESS A, et al. Direct conversion of fibroblasts into functional astrocytes by defined transcription factors[J]. Stem Cell Reports, 2015, 4: 25–36. DOI: 10.1016/j.stemcr.2014.12.002 |
| [4] | BROCKES J P, KUMAR A. Plasticity and reprogramming of differentiated cells in amphibian regeneration[J]. Nat Rev Mol Cell Biol, 2002, 3: 566–574. DOI: 10.1038/nrm881 |
| [5] | HADORN E. Transdetermination in cells[J]. Sci Am, 1968, 219: 110–114. |
| [6] | SLACK J M. Metaplasia and transdifferentiation:from pure biology to the clinic[J]. Nat Rev Mol Cell Biol, 2007, 8: 369–378. DOI: 10.1038/nrm2146 |
| [7] | FU Y, HUANG C, XU X, GU H, YE Y, JIANG C, et al. Direct reprogramming of mouse fibroblasts into cardiomyocytes with chemical cocktails[J]. Cell Res, 2015, 25: 1013–1024. DOI: 10.1038/cr.2015.99 |
| [8] | XIE X, SUN A, HUANG Z, ZHU W, WANG S, ZOU Y, et al. Another possible cell source for cardiac regenerative medicine:reprogramming adult fibroblasts to cardiomyocytes and endothelial progenitor cells[J]. Medical Hypotheses, 2010, 76: 365–367. |
| [9] | ZHOU Q, BROWN J, KANAREK A, RAJAGOPAL J, MELTON D A. In vivo reprogramming of adult pancreatic exocrine cells to β-cells[J]. Nature, 2008, 455: 627–632. DOI: 10.1038/nature07314 |
| [10] | LIU K, YU C, XIE M, LI K, DING S. Chemical modulation of cell fate in stem cell therapeutics and regenerative medicine[J]. Cell Chem Biol, 2016, 23: 893–916. DOI: 10.1016/j.chembiol.2016.07.007 |
| [11] | UBIL E, DUAN J, PILLAI I C, ROSA-GARRIDO M, WU Y, BARGIACCHI F, et al. Mesenchymal-endothelial transition contributes to cardiac neovascularization[J]. Nature, 2014, 514: 585–590. DOI: 10.1038/nature13839 |
| [12] | BRUMM A J, NUNEZ S, DOROUNDCHI M, KAWAGUCHI R, DUAN J, PELLEGRINI M, et al. Astrocytes can adopt endothelial cell fates in a p53-dependent manner[J/OL]. Mol Neurobiol, 2016. doi:10.1007/s12035-016-9974-3. |
| [13] | SAYED N, WONG W T, OSPINO F, MENG S, LEE J, JHA A, et al. Transdifferentiation of human fibroblasts to endothelial cells role of innate immunity[J]. Circulation, 2015, 131: 300–309. DOI: 10.1161/CIRCULATIONAHA.113.007394 |
| [14] | CHRISTIA P, BUJAK M, GONZALEZ-QUESADA C, CHEN W, DOBACZEWSKI M, REDDY A, et al. Systematic characterization of myocardial inflammation, repair, and remodeling in a mouse model of reperfused myocardial infarction[J]. J Histochem Cytochem, 2013, 61: 555–570. DOI: 10.1369/0022155413493912 |
| [15] | COHN J, FERRARI R, SHARPE N. Cardiac remodeling-concepts and clinical implications:a consensus paper from an international forum on cardiac remodeling[J]. J Am Coll Cardiol, 2000, 35: 569–582. DOI: 10.1016/S0735-1097(99)00630-0 |
| [16] | KOCHER A A, SCHUSTER M D, SZABOLCS M J, TAKUMA S, BURKHOFF D, WANG J, et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function[J]. Nat Med, 2001, 7: 430–436. DOI: 10.1038/86498 |
| [17] | SOUDERS C A, BOWERS S L, BAUDINO T A. Cardiac fibroblast:the renaissance cell[J]. Circ Res, 2009, 105: 1164–1176. DOI: 10.1161/CIRCRESAHA.109.209809 |
| [18] | ZEISBERG E M, TARNAVSKI O, ZEISBERG M, DORFMAN A L, McMULLEN J R, GUSTAFSSON E, et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis[J]. Nat Med, 2007, 13: 952–961. DOI: 10.1038/nm1613 |
| [19] | CHINTALGATTU V, NAIR D M, KATWA L C. Cardiac myofibroblasts:a novel source of vascular endothelial growth factor (VEGF) and its receptors Flt-1 and KDR[J]. J Mol Cell Cardiol, 2003, 35: 277–286. DOI: 10.1016/S0022-2828(03)00006-3 |
| [20] | ZHAO L, EGHBALI M. Release of pro-and anti-angiogenic factors by human cardiac fibroblasts:effects on DNA synthesis and protection under hypoxia in human endothelial cells[J]. Biochim Biophys Acta, 2001, 1538: 273–282. DOI: 10.1016/S0167-4889(01)00078-7 |
| [21] | TOSH D, SLACK J M. How cells change their phenotype[J]. Nat Rev Mol Cell Biol, 2002, 3: 187–194. DOI: 10.1038/nrm761 |
| [22] | WONG W T, COOKE J P. Therapeutic transdifferentiation of human fibroblasts into endothelial cells using forced expression of lineage-specific transcription factors[J/OL]. J Tissue Eng, 2016, 7:2041731416628329. doi:10.1177/2041731416628329. |
| [23] | NIU W, ZANG T, ZOU Y, FANG S, SMITH D, BACHOO R, et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain[J]. Nat Cell Biol, 2013, 15: 1164–1175. DOI: 10.1038/ncb2843 |
| [24] | TORPER O, PFISTERER U, WOLF D, PEREIRA M, LAU S, JAKOBASSON J, et al. Generation of induced neurons via direct conversion in vivo[J]. Proc Natl Acad Sci USA, 2013, 110: 7038–7043. DOI: 10.1073/pnas.1303829110 |
| [25] | ROUAUX C, ARLOTAA P. Direct lineage reprogramming of post-mitotic callosal neurons into corticofugal neurons in vivo[J]. Nat Cell Biol, 2013, 15: 214–221. DOI: 10.1038/ncb2660 |
| [26] | XU A, CHENG L. Chemical transdifferentiation:closer to regenerative medicine[J]. Front Med, 2016, 10: 152–165. DOI: 10.1007/s11684-016-0445-z |
 2017, Vol. 38
2017, Vol. 38


