颈动脉内膜斑块切除术(carotid endarterectomy,CEA)可以降低颈动脉重度狭窄患者患侧脑卒中的风险[1],适用于患侧短暂性脑缺血或无症状性脑卒中患者[2]。CEA通常是在区域麻醉(颈丛神经阻滞)或全身麻醉(转流或脑氧饱和度监测)下完成,但其最佳麻醉方法目前仍存在争议。有关CEA的随机试验[3]以及对其他类型手术中腰麻和硬膜外麻醉的研究[4]均认为区域麻醉优于全身麻醉(以下简称“全麻”)。而一项大型随机试验研究显示,虽然全身麻醉较区域麻醉在围手术期脑卒中、心肌梗死或死亡方面的风险更高, 但这种差异并无统计学意义[5-6]。
本研究比较分析了超声引导下颈浅丛神经阻滞复合全麻与单纯全麻下,CEA患者的血流动力学、脑氧饱和度、麻醉用药量、血管活性药使用次数以及视觉模拟评分(visual analogue scale, VAS)和简易精神状态检查(mini-mental state examination, MMSE)评分情况,评估超声引导下颈浅丛神经阻滞复合全麻在CEA中的安全性和有效性。
1 资料和方法 1.1 研究对象选取第二军医大学长征医院麻醉科2015年12月至2016年10月拟行CEA患者40例,依据麻醉方法将其分为超声引导下颈浅丛神经阻滞复合全麻组(以下简称复合全麻组)和单纯全麻组,各20例。纳入标准:(1) 需要择期行CEA的患者;(2) 年龄≤85岁;(3) 术侧为单侧;(4) 颈浅丛神经阻滞实施者及全麻实施者为同1位麻醉医师;(5) 麻醉药物种类及颈浅丛神经阻滞方法相同;(6) 患者了解并自愿参加本研究,由本人或法定监护人签署知情同意书。排除标准:(1) 有神经阻滞禁忌证者;(2) 有精神系统疾病或不能配合麻醉者;(3) CEA联合其他手术者;(4) 药物过敏或不能耐受者。本研究获得第二军医大学长征医院伦理委员会批准。
1.2 麻醉方法及监护患者入手术室后常规开通术侧外周静脉通路,对侧行桡动脉穿刺置管监测有创动脉压,监测五导联心电图、脉搏氧饱和度及脑氧饱和度。两组患者均接受相同的全身麻醉,诱导期用药:丙泊酚1~1.5 mg/kg,咪唑安定0.05 mg/kg,芬太尼2~3 μg/kg,顺阿曲库铵0.15~0.2 mg/kg。麻醉维持:七氟醚1.5%~2.5%,使最低肺泡有效浓度(MAC)维持在0.6~1, 瑞芬太尼0.05~0.2 μg/(kg·min)。气管插管后持续吸入七氟醚直至手术结束,持续静脉泵注瑞芬太尼直至患者意识恢复。复合全麻组患者于全麻前先在超声引导下行颈浅丛神经阻滞,经过超声定位后,在颈浅丛分叉处注射0.375%罗哌卡因8 mL,然后沿颈浅丛的分支方向注射0.375%罗哌卡因10 mL,共计18 mL。
血流动力学稳定,定义为平均动脉压(mean arterial pressure,MAP)变化不超过基线值的10%。高血压, 定义为MAP升高超过基线值的30%, 排除麻醉过浅原因后,通常注射5 mg盐酸乌拉地尔注射液作为首剂, 然后每次追加5 mg至MAP升高不超过基线值的10%。低血压, 定义为MAP下降超过基线值的30%, 排除容量不足及麻醉过深原因后, 通常注射麻黄碱6 mg作为首剂, 必要时重复, 直至MAP下降不超过基线值的10%。当MAP变化幅度为基线值的10%~30%时, 为了维持血流动力学稳定,首先调整七氟醚及瑞芬太尼的剂量,如果调整麻醉深度效果不佳, 可以使用血管活性药。在颈动脉阻断期间, 为防止脑梗死发生,需要维持控制性高压的状态。控制性高压通常升高MAP基线值的20%~30%,可通过改变麻醉药用量及使用血管活性药维持控制性高压的状态,与此同时, 可以通过观察脑氧饱和度的变化调节血压。在颈动脉阻断期, 脑氧饱和度下降>13%常提示患者需要转流[7]。
1.3 观察指标记录患者进入手术室或颈浅丛神经阻滞前(T0-B)、颈浅丛神经阻滞后(T0-L)、麻醉诱导后(T1)、切皮时刻(T2)、动脉剥离时刻(T3)、颈动脉阻断时刻(T4)、颈动脉开放时刻(T5)和术后2 h(T6)的收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)、MAP、心率(heart rate, HR)及双侧脑氧饱和度;术中芬太尼、瑞芬太尼及七氟醚用量;升压药及降压药使用次数;术后VAS和MMSE评分。VAS评分标准[8]:无痛, 记0分;轻微疼痛,能忍受,记1~3分;疼痛并影响睡眠,尚能忍受,记4~6分;有渐强烈的疼痛,疼痛难忍,影响睡眠、影响食欲,记7~10分。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析, 组间比较采用t检验或χ2检验。检验水准(α)为0.05。
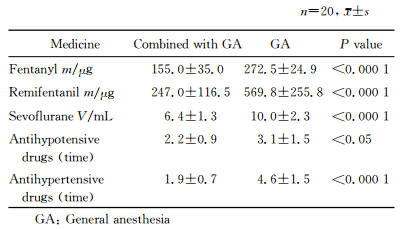
2 结果 2.1 患者一般情况比较由表 1可见,两组患者年龄、性别、体质量指数、危险因素及双侧颈动脉狭窄程度差异无统计学意义(P>0.05)。
|
|
表 1 两组患者一般情况比较 Tab 1 Comparison of general characteristics between two groups |
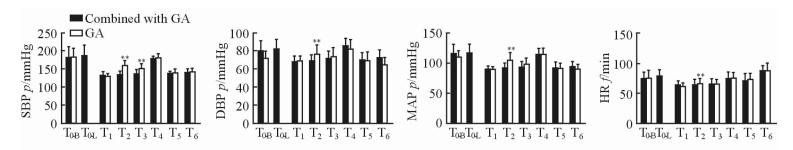
2.2 围手术期血流动力学变化
与T1时间点比较,T2、T3时间点复合全麻组的SBP变化不明显,而单纯全麻组的SBP升高(P<0.01)。与T1时间点比较,T2时间点复合全麻组的DBP、MAP及HR基本稳定, 而单纯全麻组的DBP、MAP及HR升高(P<0.01)。见图 1。
|
图 1 两组患者在CEA中各时间点SBP、DBP、MAP及HR的比较 Fig 1 Comparison of SBP, DBP, MAP and HR at different time points between two groups during CEA CEA: Carotid endarterectomy; SBP: Systolic blood pressure; DBP: Diastolic blood pressure; MAP: Mean arterial pressure; HR: Heart rate; GA: General anesthesia; T0-B: At arrival of the operating room or before superficial cervical plexus block; T0-L: After superficial cervical plexus block; T1: After induction; T2: At skin incision moment; T3: At atery dissection moment; T4: At carotid artery occlusion moment; T5: At carotid artery opening moment; T6: Two hours after operation. 1 mmHg=0.133 kPa. **P < 0.01 vs T1 time point in GA group. n=20, x±s |
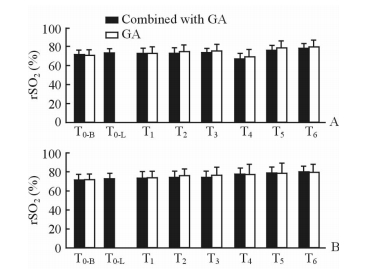
2.3 两组患者双侧脑氧饱和度变化
由图 2可见,两组T4时间点术侧脑氧饱和度较T0-B时间点低,但差异均无统计学意义(P>0.05)。除术侧T4时间点,两组任意时刻双侧脑氧饱和度均较T0-B时间点升高,但差异无统计学意义(P>0.05)。
|
图 2 两组患者在CEA中各时间点术侧(A)及对侧(B)脑氧饱和度比较 Fig 2 Comparison of ipsilateral (A) and contralateral (B) rSO2 at different time points between two groups during CEA CEA: Carotid endarterectomy; GA: General anesthesia; rSO2: Regional oxygen saturation; T0-B: At arrival of the operating room or before superficial cervical plexus block; T0-L: After superficial cervical plexus block; T1: After induction; T2: At skin incision moment; T3: At artery dissection moment; T4: At carotid artery occlusion moment; T5: At carotid artery opening moment; T6: Two hours after operation. n=20, x±s |
2.4 两组患者术中用药情况
由表 2可见,单纯全麻组中芬太尼、瑞芬太尼及七氟醚的用量和血管活性药使用次数较复合全麻组增多(P<0.05,P<0.01)。
|
|
表 2 两组患者麻醉药及血管活性药使用情况比较 Tab 2 Comparison of anesthesia and vasoactiveagent service condition between two groups |
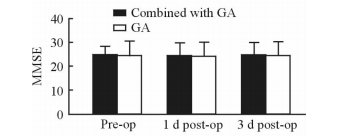
2.5 两组患者VAS及MMSE评分
复合全麻组患者术后均无痛感,VAS均为0分,而单纯全麻组患者术后VAS为1.6±0.8,两组间差异有统计学意义(P<0.01)。两组患者MMSE评分在术前及术后各时间点的差异均无统计学意义(P>0.05, 图 3)。
|
图 3 两组患者的MMSE评分 Fig 3 The mini-mental state examination (MMSE)score of two groups at different time points GA: General anesthesia; Pre-op: Pre-operation; Post-op: Post-operation. n=20, x±s |
3 讨论
有研究者认为CEA中行区域麻醉主要是因为有意识的患者在颈动脉阻断期间的脑灌注情况可以通过监测精神状态来评估,使脑卒中发生率降到最低,大大减少转流[9],且缩短住院时间[10]。然而, 在一项大型前瞻性研究中,1 000例患者在颈丛神经阻滞下行CEA, 术中约53%的患者需要补充局部麻醉, 66%的患者需要镇静, 2.5%的患者需要改为全麻[11]。CEA中镇静通常发生在患者疼痛和焦虑情况下,这不仅会增加心肌耗氧量,而且会导致不良心血管事件发生,特别不适合冠心病患者。全麻的主要优点是存在安全气道,可以通过气道控制通气并调节动脉CO2浓度[12]。挥发性麻醉药物和丙泊酚都有神经保护作用,可降低大脑的新陈代谢[13-15]。瑞芬太尼现已用于区域麻醉,颈浅丛神经阻滞复合持续静脉注射瑞芬太尼可以使患者更加舒适[16-17],然而, 呼吸抑制和过度镇静可能是这种方法的缺点[18]。
在本研究中, 我们在超声引导下完成颈浅丛神经阻滞,不仅可以在直视下将阻滞针刺入神经周围间隙,还可减少注射药物的体积,最大限度地降低穿刺相关并发症的发生风险[19-20]。此外, 有效的颈丛神经阻滞是在药物毒性范围内尽可能地降低药物剂量,因此超声引导下区域麻醉系统毒性发生的可能性不大[19]。本研究结果显示,复合全麻组的SBP在T2、T3时间点较T1时间点变化不明显, 而单纯全麻组SBP在T2、T3时间点较T1时间点升高(P<0.01);复合全麻组T2时间点的DBP、MAP及HR较T1时间点基本稳定,而单纯全麻组T2时间点的上述指标较T1时间点升高(P<0.01)。考虑其原因可能为复合全麻组患者行颈浅丛神经阻滞麻醉,此种麻醉方法使术侧颈部皮肤及肌肉麻醉,在切皮及动脉剥离等较强刺激下心血管反应减弱,血流动力学趋于稳定。本研究还发现,复合全麻组的麻醉药用量及血管活性药使用次数较少,VAS评分较低。分析其原因可能为颈浅丛神经阻滞在术中及术后起到镇痛作用,并且使患者术中血流动力学较稳定,从而减少了麻醉药及血管活性药使用。除术侧T4时间点,两组其他任意时刻双侧脑氧饱和度均较T0-B时间点升高,但差异无统计学意义(P>0.05)。同时研究中发现在丙泊酚诱导过程中, 即使在血压下降的情况下双侧脑氧饱和度仍然升高。双侧脑氧饱和度升高考虑其原因为七氟醚和丙泊酚可以降低脑代谢, 有脑保护作用[13]。研究中还发现复合全麻组在T0-L时间点,双侧脑氧饱和度均有小幅度升高。这可能是由于患者在行颈浅丛神经阻滞时精神紧张导致血压轻微上升进而导致脑氧饱和度小幅度升高。
在CEA中出现血流动力学不稳定是很常见的, 主要由于:脑卒中后动脉压力自身调节功能受损;颈动脉动脉粥样硬化导致压力感受器敏感性降低; 颈动脉手术、麻醉、高龄、糖尿病、抗高血压药物等影响[13]。一些非随机试验报道了CEA中区域麻醉与全麻对血流动力学的影响,发现全麻术中血压较区域麻醉难控制[9]。一些之前的研究曾报道在区域麻醉中使用丙泊酚镇静和瑞芬太尼镇痛有相当多的药物不良反应[18, 21],瑞芬太尼较丙泊酚更有利于镇痛,但有呼吸抑制的风险[22],而丙泊酚更容易导致过度镇静[21]。因全麻的主要优势是机械通气, 避免由于输注瑞芬太尼和丙泊酚导致的呼吸抑制,本研究中,我们将颈浅丛神经阻滞和全麻复合,可以更轻松地控制血压, 减少麻醉药和血管活性药的使用。研究中还发现, 两组血流动力学稳定性差异不影响患者的术后认知功能。
本研究也存在一定不足:(1) 样本量较少,所以对于研究结果的解释需谨慎。(2) 研究中患者和操作者不是双盲,这对研究结果造成一定的偏差,但在本研究中双盲是不宜实现的。(3) 未设单纯颈浅丛神经阻滞麻醉组。理论上, 颈浅丛神经阻滞麻醉可以提供与颈浅丛神经阻滞复合全麻相同稳定程度的血流动力学状态。本研究不包括颈浅丛神经阻滞麻醉组是因为外科医师觉得睡眠状态的患者在脑氧饱和度监测下手术更舒适、更省时,而且大部分患者在清醒状态下手术会感到紧张而影响手术过程。
综上, 本研究发现在行CEA时,超声引导下颈浅丛神经阻滞复合全麻较单纯全麻有更好的血流动力学状态及镇痛效果, 减少麻醉药和血管活性药的使用。因此对于CEA更适合实施颈浅丛神经阻滞复合全麻的麻醉方法,尤其伴有不稳定心血管疾病、呼吸性疾病和焦虑等围手术期并发症的高风险患者。同时,此种方法还适合不能单独实施颈丛神经阻滞的患者(肥胖、短颈、紧张等)[17]。
| [1] | ROTHWELL P M, ELIASZIW M, GUTNIKOV S A, FOX A J, TAYLOR D W, MAYBERG M R, et al. Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis[J]. Lancet, 2003, 361: 107–116. DOI: 10.1016/S0140-6736(03)12228-3 |
| [2] | ROTHWELL P M, ELIASZIW M, GUTNIKOV S A, WARLOW C P, BARNETT H J. Carotid Endarterectomy Trialists Collaboration.Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery[J]. Lancet, 2004, 363: 915–924. DOI: 10.1016/S0140-6736(04)15785-1 |
| [3] | RERKASEM K, BOND R, ROTHWELL P M. Local versus general anaesthesia for carotid endarterectomy[J/CD]. Cochrane Database Syst Rev, 2004(2):CD000126. |
| [4] | RODGERS A, WALKER N, SCHUG S, McKEE A, KEHLET H, VAN ZUNDERT A, et al. Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia:results from overview of randomised trials[J]. BMJ, 2000, 321: 1493. DOI: 10.1136/bmj.321.7275.1493 |
| [5] | GALATrial Collaborative Group, LEWIS S C, WARLOW C P, BODENHAM A R, COLAM B, ROTHWELL P M, TORGERSON D, et al. General anaesthesia versus local anaesthesia for carotid surgery (GALA):a multicentre, randomised controlled trial[J]. Lancet, 2008, 372: 2132–2142. DOI: 10.1016/S0140-6736(08)61699-2 |
| [6] | VANIYAPONG T, CHONGRUKSUT W, RERKASEM K. Local versus general anaesthesia for carotid endarterectomy[J/CD]. Cochrane Database Syst Rev, 2013(12):CD000126. doi:10.1002/14651858.CD000126.pub4. |
| [7] | GRUBHOFER G, PLÖCHL W, SKOLKA M, CZERNY M, EHRLICH M, LASSNIGG A. Comparing Doppler ultrasonography and cerebral oximetry as indicators for shunting in carotid endarterectomy[J]. Anesth Analg, 2000, 91: 1339–1344. DOI: 10.1097/00000539-200012000-00006 |
| [8] | 高万露, 汪小海. 视觉模拟疼痛评分研究的进展[J]. 医学研究杂志, 2013, 42: 144–146. DOI: 10.3969/j.issn.1673-548X.2013.04.041 |
| [9] | RERKASEM K, ROTHWELL P M. Local versus general anaesthesia for carotid endarterectomy[J/CD]. Cochrane Database Syst Rev, 2008(4):CD000126. doi:10.1002/14651858.CD000126.pub3. |
| [10] | SCHECHTER M A, SHORTELL C K, SCARBOROUGH J E. Regional versus general anesthesia for carotid endarterectomy:the American College of Surgeons National Surgical Quality Improvement Program perspective[J]. Surgery, 2012, 152: 309–314. DOI: 10.1016/j.surg.2012.05.008 |
| [11] | DAVIES M J, SILBERT B S, SCOTT D A, COOK R J, MOONEY P H, BLYTH C. Superficial and deep cervical plexus block for carotid artery surgery:a prospective study of 1000 blocks[J]. Reg Anesth, 1997, 22: 442–446. DOI: 10.1016/S1098-7339(97)80031-4 |
| [12] | LADAK N, THOMPSON J. General or local anaesthesia for carotid endarterectomy?[J]. Continuing Education in Anesthesia Critical Care & Pain, 2012, 12: 92–96. |
| [13] | MATCHETT G A, ALLARD M W, MARTIN R D, ZHANG J H. Neuroprotective effect of volatile anesthetic agents:molecular mechanisms[J]. Neurol Res, 2009, 31: 128–134. DOI: 10.1179/174313209X393546 |
| [14] | KAISTI K K, LÅNGSJÖ J W, AALTO S, OIKONEN V, SIPILÄ H, TERÄS M, et al. Effects of sevoflurane, propofol, and adjunct nitrous oxide on regional cerebral blood flow, oxygen consumption, and blood volume in humans[J]. Anesthesiology, 2003, 99: 603–613. DOI: 10.1097/00000542-200309000-00015 |
| [15] | McCULLOCH T J, THOMPSON C L, TURNER M J. A randomized crossover comparison of the effects of propofol and sevoflurane on cerebral hemodynamics during carotid endarterectomy[J]. Anesthesiology, 2007, 106: 56–64. DOI: 10.1097/00000542-200701000-00012 |
| [16] | KRENN H, DEUSCH E, JELLINEK H, OCZENSKI W, FITZGERALD R D. Remifentanil or propofol for sedation during carotid endarterectomy under cervical plexus block[J]. Br J Anaesth, 2002, 89: 637–640. DOI: 10.1093/bja/aef233 |
| [17] | MARROCCO-TRISCHITTA M M, BANDIERA G, CAMILLI S, STILLO F, CIRIELLI C, GUERRINI P. Remifentanil conscious sedation during regional anaesthesia for carotid endarterectomy:rationale and safety[J]. Eur J Vasc Endovasc Surg, 2001, 22: 405–409. DOI: 10.1053/ejvs.2001.1502 |
| [18] | COPPI G, MORATTO R, RAGAZZI G, NICOLOSI E, SILINGARDI R, BENASSI FRANCIOSI G, et al. Effectiveness and safety of carotid endarterectomy under remifentanil[J]. J Cardiovasc Surg (Torino), 2005, 46: 431–436. |
| [19] | HOEFER J, PIERER E, RANTNER B, STADLBAUER K H, FRAEDRICH G, FRITZ J, et al. Ultrasound-guided regional anesthesia for carotid endarterectomy induces early hemodynamic and stress hormone changes[J]. J Vasc Surg, 2015, 62: 57–67. DOI: 10.1016/j.jvs.2015.02.036 |
| [20] | GAUTIER P, VANDEPITTE C, RAMQUET C, DECOOPMAN M, XU D, HADZIC A. The minimum effective anesthetic volume of 0.75% ropivacaine in ultrasound-guided interscalene brachial plexus block[J]. Anesth Analg, 2011, 113: 951–955. DOI: 10.1213/ANE.0b013e31822b876f |
| [21] | DANIELAK-NOWAK M, MUSIOŁE, ARCT-DANIELAK D, DUDA I, LUDWIK K. A comparison of subhypnotic doses of propofol and midazolam during spinal anaesthesia for elective Caesarean section[J]. Anaesthesiol Intensive Ther, 2016, 48: 13–18. DOI: 10.5603/AIT.2016.0003 |
| [22] | LUCHETTI M, CANELLA M, ZOPPI M, MASSEI R. Comparison of regional anesthesia versus combined regional and general anesthesia for elective carotid endarterectomy:a small exploratory study[J]. Reg Anesth Pain Med, 2008, 33: 340–345. |
 2017, Vol. 38
2017, Vol. 38