前列腺癌(prostate cancer, PCa)是男性泌尿生殖系统最常见的恶性肿瘤,在男性肿瘤致死率中居第2位,并且随着人口寿命的增长,发病率逐年升高[1-2]。早期的PCa通常无明显(或无特异性)临床表现,患者多数是在出现尿路梗阻症状就诊时,因随检的前列腺特异性抗原(prostate-specific antigen, PSA)升高,行前列腺穿刺活检术而诊断出来。PSA作为应用最为普及的PCa诊断标志物,灵敏度高但特异性低,特别在用于我国老年男性患者时,造成了一定的过度诊疗。早期诊断、早期治疗对PCa患者的治疗和预后至关重要,因此寻找可靠、有效且适用于我国老年男性患者的PCa诊断分子标志物是目前临床研究的热点和难点。微小RNA(microRNA)是大小约为22个核苷酸的短链非编码RNA,在细胞增殖和分化、器官的形成和发育及肿瘤进展等方面均有着重要作用[3]。MiR-4286定位于人类染色体8p23.1,碱基序列为5′-ACC CCA CUC CUG GUA CC-3′,多项研究证实其在肿瘤中的表达发生变化[4-5]。我科实验室在72例血液样本microRNA芯片的数据基础上,发现了在癌与非癌患者中差异性表达的miR-4286,本研究检测了PSA升高患者的血清miR-4286的表达差异,旨在探索miR-4286与PCa的关系,研究其诊断价值。
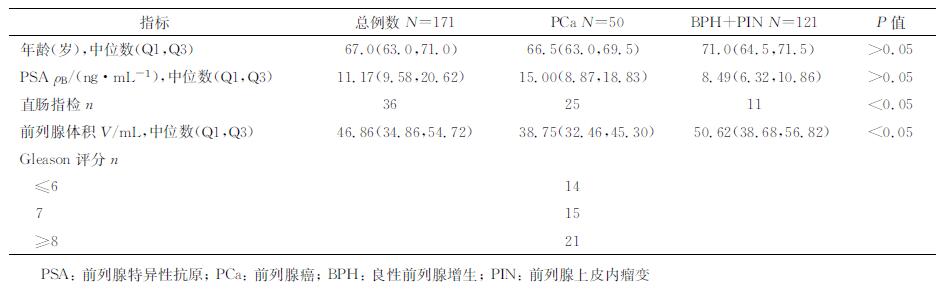
1 材料和方法 1.1 研究对象前瞻性收集2016年3月至8月本院日间手术病区PSA升高、行前列腺穿刺活检的患者171例,中位年龄67.0岁(我院>75岁患者至泌尿外科病房住院穿刺),中位PSA 11.17 ng/mL;经直肠B超引导下前列腺穿刺活检术共检出PCa 50例、良性前列腺病变121例。良性病变中,良性前列腺增生(benign prostatic hyperplasia, BPH) 113例、前列腺上皮内瘤变(PIN Ⅰ级)8例(表 1)。所有患者自愿签署科研样本留取协议书,所取血清样本置于-80 ℃冰箱保存。所有患者均未接受过PCa相关的内分泌治疗。患者的确诊均以穿刺活检的病理诊断为依据。
|
|
表 1 研究样本的临床参数 |
1.2 试剂与仪器
BD采血管(美国BD公司),离心管(美国Axygen公司),RNA提取试剂盒(AM1556)、TaqMan反转录试剂盒、TaqMan探针(美国life公司)。离心机为德国Eppendorf公司产品,普通反转录设备为美国Bio-Rad公司产品,qPCR仪为美国Life公司的ABI StepOnePlus实时荧光定量PCR仪。
1.3 标本采集与处理早晨采集患者空腹静脉血3.5 mL,1 600 ×g离心10 min,吸取上清于1.5 mL离心管中,再次于17 949×g 10 min离心,吸取350 μL上层血清置于1.5 mL离心管中,置于-80 ℃冰箱中保存。使用RNA抽提试剂盒从血清样本中提取总RNA,NanoDrop 2000紫外分光光度计测量RNA浓度及纯度,光密度介于1.8~2.1之间的样本用于后续实验。反转录体系为30 μL,包括10.00 μL RNA样品、0.30 μL dNTP、2.00 μL MultiScribeTM反转录酶、3.00 μL 10×反转录缓冲液、0.38 μL RNase抑制剂、8.32 μL无核酸酶水、6 μL 5×反转录引物。反转录引物使用购置TaqMan探针时附带的5×特定引物,反转录条件为16 ℃ 30 min、42 ℃ 30 min、85 ℃ 5 min,反转录产物置于-20 ℃保存。
1.4 TaqMan法检测miR-4286在血清中的表达采用qPCR法检测miR-4286在血清中的表达水平,反应体系为20 μL,其中TaqMan Small RNA Assay(20×) 1.00 μL,cDNA 1.33 μL,TaqMan通用型PCR Master Mix Ⅱ (2×) 10.00 μL,无核酸酶水7.67 μL;qPCR反应条件及要求依据试剂盒(4465407, Reversion C, 01/2013) 推荐条件进行,反应条件:95 ℃预变性10 min;95 ℃ 2 min,60 ℃ 60 s,40个循环。血清miR-4286的相对表达量用2-ΔΔCt法进行计算。
1.5 统计学处理应用MedCalc 11.4.2.0软件进行统计学分析,两组均数间的差异性分析采用Mann-Whitney U检验,两配对样本资料的差异性分析采用Wilcoxon配对符号秩检验,诊断效能分析采用受试者工作特征(receiver operating characteristic, ROC)曲线,使用曲线下面积(AUC)比较诊断效能。检验水准(α)为0.05。
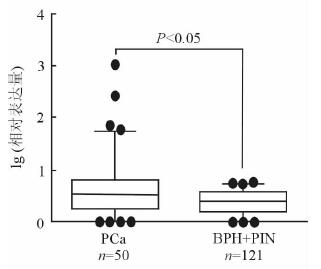
2 结果 2.1 PCa和良性病变患者的血清miR-4286表达水平用miR-1228作为内参,经检测miR-4286在PCa和良性病变(BPH+PIN)患者血清中均稳定表达,其中PCa患者miR-4286表达量的中位数为3.291(95%CI: 2.616~4.146),良性病变患者表达量的中位数为2.538 (95%CI: 2.107~3.289), 差异有统计学意义(P<0.05),见图 1。
|
图 1 PCa和良性病变患者血清miR-4286的表达 PCa:前列腺癌;BPH:良性前列腺增生; PIN:前列腺上皮内瘤变 |
2.2 PCa和良性病变患者血清miR-4286在术前与术后的表达
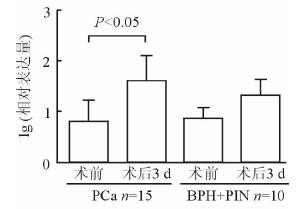
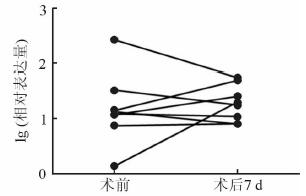
本研究在参考文献[6]的基础上,分析研究了10例良性病变患者术前与术后3 d的血清miR-4286的表达变化,以及15例PCa患者的术前与术后3 d及8例PCa患者术前与术后7 d的血清miR-4286的表达变化。结果显示在良性病变患者中,术后3 d miR-4286的表达水平较术前升高,但差异无统计学意义(P>0.05);而在PCa患者中,术后3 d miR-4286的表达水平较术前升高,差异有统计学意义(P<0.05),见图 2。术后7 d PCa患者血清miR-4286的表达水平较术前无显著变化(P>0.05),见图 3。
|
图 2 PCa和良性病变患者血清miR-4286在术前与术后3 d的表达 PCa:前列腺癌;BPH:良性前列腺增生; PIN:前列腺上皮内瘤变. x±s |
|
图 3 PCa患者血清miR-4286在术前和术后7 d的表达 PCa:前列腺癌. n=8 |
2.3 MiR-4286在PSA升高患者中的诊断效能
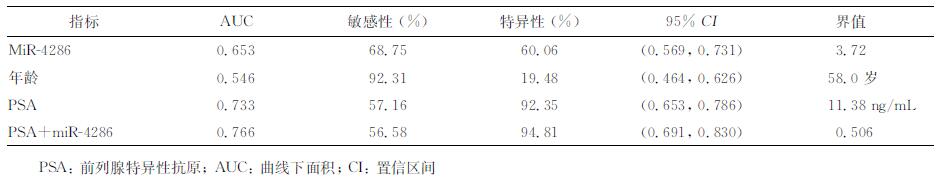
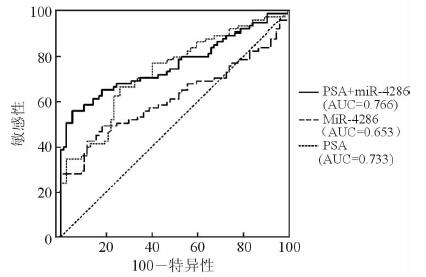
在171例血清PSA升高患者中的研究发现,miR-4286在PSA升高患者中具有一定的诊断价值。在171例穿刺患者中,使用miR-4286的血清表达差异诊断PCa,在界值为3.72时,AUC可达0.653,敏感性为68.75%,特异性为60.06%。而使用PSA进行诊断分析,在界值为11.38 ng/mL时AUC达到0.733, 敏感性为57.16%,特异性为92.35%。联合使用PSA和miR-4286的表达水平诊断PCa时,AUC可高达0.766 (95%CI: 0.691~0.830),敏感性为56.58%,特异性高达94.81%。详见表 2和图 4。
|
|
表 2 PSA和miR-4286对前列腺癌的诊断效能分析 |
|
图 4 MiR-4286、PSA和PSA+miR-4286诊断前列腺癌的ROC曲线 PSA:前列腺特异性抗原; ROC:受试者工作特征;AUC:曲线下面积 |
3 讨论
目前PCa的发病与进展机制尚不明确[7],PSA是PCa筛查、诊断、预后及进展的常用标志物,应用虽然已经普及,但是PSA的高敏感性、低特异性的特点使其在临床应用上存在一定的局限性。如BPH患者和前列腺炎患者的血清PSA也会有一定程度的升高,这直接影响了医师的诊断,也在一定程度上导致对血清PSA升高患者的过度诊疗[8]。目前关于microRNA在PCa中的诊断研究越发详细[9-11],研究表明miR-4286与肿瘤的发生、发展密切相关[5, 11-12]。研究显示miR-4286在黑素瘤及食管癌中均高表达,并且在食管癌患者的循环血液中存在高表达[11-12],有望成为液体活检(liquid biopsy)的新型标志物,但是miR-4286在PCa中的研究目前尚无报道。本研究依据对我科实验室检测的血液microRNA芯片的数据分析,找出在PCa患者和良性病变患者中差异性表达的miR-4286,采用高特异性的TaqMan探针技术方法,检测了我院连续性系统穿刺的PSA升高患者的血清miR-4286的表达情况,发现其在PCa患者中的表达高于良性病变患者(P<0.05)。因此通过检测PSA升高患者中miR-4286的表达情况能够将PCa患者与非癌患者有效区分开来,并且可以辅助PSA联合诊断,提高临床医师对于PCa患者的早期诊断率,也在一定程度上减少了PSA升高患者的过度诊疗。本研究还进行了PCa患者与良性病变患者血清中miR-4286术前与术后的表达水平的变化检测,结果提示miR-4286与PCa存在高度相关性,该结果趋势与国外早期类似研究[6]结果相似。MiR-4286在术前表达和术后3 d及7 d的表达差异分析也说明了miR-4286在前列腺组织中的相对特异性[13]。MiR-4286区别、诊断PCa的效能与PSA相近,但是其敏感性略优于PSA,这在临床工作中对于PCa的诊断具有一定的指导意义。本研究中PSA的诊断效能较高,可能跟阶段性纳入的患者情况有关,与大样本、多中心的PSA诊断能力有着一定区别[14],明显高于既往报道。为更加有效的对比研究miR-4286和PSA的诊断效能,还需更大样本和多中心的样本研究以做支持。在目前的提升PCa诊断率的研究中,以临床信息数据(如PSA)联合实验室研究标志物共同诊断为主[15-17]。本研究发现PSA和miR-4286联合诊断PCa具有良好价值,符合目前的研究趋势和证据支持。本研究亦存在一定可改进之处。在选择手术前后对比样本时,因我院泌尿科良性病变患者术后3 d即可出院,缺少和PCa患者匹配的术后7 d样本以作对比。虽前列腺体积在两类患者中存在统计学差异,但收集的精确前列腺各径数值为行穿刺活检时的经直肠B超数值,在门诊应用时存在一定障碍,故未行纳入分析。
综上所述,从PCa的诊断上看,还需要发现高灵敏性和高特异性的诊断标志物,以提高PSA升高患者的诊断率,避免不必要的前列腺穿刺活检和医疗支出。本研究提示miR-4286与PCa高度相关,并且具有良好的诊断效能,可作为PCa液体活检的新型分子标志物。
| [1] | CHEN W, ZHENG R, BAADE P D, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI: 10.3322/caac.21338 |
| [2] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65: 5–29. DOI: 10.3322/caac.21254 |
| [3] | GREGORY R I, SHIEKHATTAR R. MicroRNA biogenesis and cancer[J]. Cancer Res, 2005, 65: 3509–3512. DOI: 10.1158/0008-5472.CAN-05-0298 |
| [4] | DRAHOS J, SCHWAMEIS K, ORZOLEK L D, HAO H, BIRNER P, TAYLOR P R, et al. MicroRNA profiles of barrett's esophagus and esophageal adenocarcinoma:differences in glandular non-native epithelium[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25: 429–437. DOI: 10.1158/1055-9965.EPI-15-0161 |
| [5] | PEHSERL A M, RESS A L, STANZER S, RESEL M, KARBIENER M, STADELMEYER E, et al. Comprehensive analysis of miRNome alterations in response to sorafenib treatment in colorectal cancer cells[J/OL]. Int J Mol Sci, 2016, 17:e2011. doi:10.3390/ijms17122011. |
| [6] | EGIDI M G, COCHETTI G, SERVA M R, GUELFI G, ZAMPINI D, MECHELLI L, et al. Circulating micrornas and kallikreins before and after radical prostatectomy:are they really prostate cancer markers?[J]. Biomed Res Int, 2013, 2013: 241780. |
| [7] | VELTRI R W, CHRISTUDASS C S. Nuclearmorphometry, epigenetic changes, and clinical revelance in prostate cancer[J]. Adv Exp Med Biol, 2014, 773: 77–99. DOI: 10.1007/978-1-4899-8032-8 |
| [8] | 谭书涛, 吴斌. 前列腺癌主动监测的研究进展[J]. 现代泌尿外科杂志, 2016, 21: 68–71. DOI: 10.3969/j.issn.1009-8291.2016.01.020 |
| [9] | KACHAKOVA D, MITKOVA A, POPOV E, POPOV I, VLAHOVA A, DIKOV T, et al. Combinations of serum prostate-specific antigen and plasma expression levels of let-7c, miR-30c, miR-141, and miR-375 as potential better diagnostic biomarkers for prostate cancer[J]. DNA Cell Biol, 2015, 34: 189–200. DOI: 10.1089/dna.2014.2663 |
| [10] | LARNE O, MARTENS-UZUNOVA E, HAGMAN Z, EDSJ A, LIPPOLIS G, DEN BERG M S, et al. miQ-A novel microRNA based diagnostic and prognostic tool for prostate cancer[J]. Int J Cancer, 2013, 132: 2867–2875. DOI: 10.1002/ijc.27973 |
| [11] | ZHAI R, WEI Y, SU L, LIU G, KULKE M H, WAIN J C, et al. Whole-miRNome profiling identifies prognostic serum miRNAs in esophageal adenocarcinoma:the influence of Helicobacter pylori infection status[J]. Carcinogenesis, 2015, 36: 87–93. DOI: 10.1093/carcin/bgu228 |
| [12] | KOMINA A, PALKINA N, AKSENENKO M, TSYRENZHAPOVA S, RUKSHA T. Antiproliferative and pro-apoptotic effects of miR-4286 inhibition in melanoma cells[J/OL]. PLoS One, 2016, 11:e0168229. doi:10.1371/journal.pone.0168229. |
| [13] | YANG B, LIU Z, NING H, ZHANG K, PAN D, DING K, et al. MicroRNA-21 in peripheral blood mononuclear cells as a novel biomarker in the diagnosis and prognosis of prostate cancer[J]. Cancer biomarker, 2016, 17: 223–230. DOI: 10.3233/CBM-160634 |
| [14] | 陈锐, 谢立平, 周立群, 黄翼然, 傅强, 贺大林, 等. 中国前列腺癌联盟成员医院前列腺穿刺活检现状的调查报告[J]. 中华泌尿外科杂志, 2015, 36: 342–345. DOI: 10.3760/cma.j.issn.1000-6702.2015.05.006 |
| [15] | KRISTENSEN H, THOMSEN A R, HALDRUP C, DYRSKJOT L, HOYER S, BORRE M, et al. Novel diagnostic and prognostic classifiers for prostate cancer identified by genome-wide microRNA profiling[J]. Oncotarget, 2016, 7: 30760–30771. |
| [16] | LI Z, MA Y Y, WANG J, ZENG X F, LI R, KANG W, et al. Exosomal microRNA-141 is upregulated in the serum of prostate cancer patients[J]. Onco Targets Ther, 2016, 9: 139–148. |
| [17] | SALIDO-GUADARRAMA A I, MORALES-MONTOR J G, RANGEL-ESCARENO C, LANGLEY E, PERALTA-ZARAGOZA O, CRUZ COLIN J L, et al. Urinary microRNA-based signature improves accuracy of detection of clinically relevant prostate cancer within the prostate-specific antigen grey zone[J]. Mol Med Rep, 2016, 13: 4549–4560. |
 2017, Vol. 38
2017, Vol. 38