2. 第二军医大学东方肝胆外科医院胆道一科, 上海 200438;
3. 第二军医大学东方肝胆外科医院腹腔镜科, 上海 200438
2. Department of Biliary Tract(Ⅰ), Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
3. Department of Laparoscopy, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
胆管癌是指源于肝外胆管包括肝门区至胆总管下端胆管的恶性肿瘤,其发病考虑与胆管结石、胆管囊性扩张及原发性硬化性胆管炎等疾病相关[1],以黄疸、尿黄、陶土便、胆囊肿大、胆道感染出血及肝脏损害等为主要临床表现[2]。胆管癌在临床上较为少见,发病率占所有消化系统恶性肿瘤的3%左右[3]。胆管癌患者起病较为隐匿,早期诊断率极低,绝大多数患者在进展期确诊,从而失去手术根治机会。因此,以化疗为主的姑息治疗是胆管癌临床治疗的主要手段,旨在延缓病情发展、延长患者生存期限[4]。
持续腹腔热灌注化疗(continuous hyperthermic peritoneal perfusion chemotherapy, CHPPC)的作用机制为利用热效能及腹腔较高浓度的化疗药物对机体肿瘤细胞不可逆性杀死,以达到控制肿瘤转移和复发的目的[5-6]。近年来,CHPPC受到国内外学者的广泛关注,随着技术的不断改进成熟,被广泛应用于胃癌、肠癌等腹腔恶性肿瘤的治疗中,以有效预防疾病复发,提高临床疗效,改善患者预后。我院于2014年8月至2016年6月共收治进展期胆管癌患者103例,采用CHPPC或常规化疗进行治疗,本研究拟通过对这些患者临床资料的分析,探讨CHPPC的临床效果及对患者预后的影响,为其临床应用提供依据。
1 资料和方法 1.1 一般资料回顾性分析2014年8月至2016年6月于我院就诊的103例进展期胆管癌患者资料,所有患者均仅行肿瘤姑息性切除术,并未行根治性切除术。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7版胆管癌的TNM分期标准,这些患者均为TNM Ⅲ期和Ⅳ期。其中46例患者给予CHPPC治疗,作为CHPPC组;57例患者给予常规静脉化疗,作为对照组。CHPPC组:男22例、女24例;胆囊癌18例、肝内胆管癌21例、肝门部胆管癌7例;年龄25~73岁,平均(55.23±9.24) 岁;TNM Ⅲ期3例、Ⅳ期43例;根据术前影像学检查(CT或者MRI),判断肿瘤直径0.6~7.8 cm,中位数3.0 cm;KPS评分91.31±11.08;根据体力状况ECOG评分,从事轻体力活动44例、丧失工作能力2例。对照组:男32例、女25例;胆囊癌24例、肝内胆管癌29例、肝门部胆管癌4例;年龄23~78岁,平均(57.50±9.67) 岁;TNM Ⅲ期9例、Ⅳ期48例;根据术前影像学检查(CT或者MRI),判断肿瘤直径0.5~8.0 cm,中位数3.04 cm;KPS评分90.43±6.15;根据体力状况ECOG评分,从事轻体力活动54例、丧失工作能力3例。两组患者的性别、年龄、临床分期、肿瘤直径、KPS评分、ECOG评分等差异均无统计学意义,具有可比性(P < 0.05)。
1.2 入选标准(1) 采用中华医学会外科学分会肝脏外科学组发布的《胆管癌诊断与治疗——外科专家共识》中关于胆管癌的诊断标准,统指胆管系统衬覆上皮发生的恶性肿瘤,包括肝内胆管癌、肝门部胆管癌、远端胆管癌和胆囊癌[7],术后病理或穿刺活检证实为进展期胆管癌,判定为TNM Ⅲ期或者Ⅳ期;(2) 未接受过放疗或化疗;(3) KPS评分≥70分;(4) 所有患者均知情同意;(5) 无心、肝、脑、肾等重要脏器功能异常及出血倾向;(6) 无明显化疗或手术禁忌证者。
1.3 治疗方法所有患者入院后根据自身综合情况给予病理活检、腹腔镜下腹腔探查术、胆管癌姑息性切除术、胆管探查、T管引流及淋巴结局部切除术等。对照组患者于姑息切除术后4周开始进行化疗,给予5-氟尿嘧啶(5-fluorouracil, 5-FU) 2 500~3 000 mg/m2和顺铂(cisplatin, DDP) 60~75 mg/m2常规化疗方案。
CHPPC组患者在术中或术后第1天给予CHPPC治疗,其中12例行术中CHPPC,34例于术后第1天行CHPPC。患者手术中,在行CHPPC之前应最大限度降低肿瘤负荷。姑息性切除术后,检查腹腔及吻合口,将灌注导管置入腹腔,两侧出口管位于肋弓下方4指与锁骨中线相交处,2个出口管分别置入盆腔,两侧入口管位于脐与髂前上棘连线中外1/3处,2个入口管分别放于肝膈面和脾脏前方,用内交叉置管方法使热灌注液体充盈整个腹腔,不留治疗盲区。用4 L灌注液循环灌注,灌注速度400~600 mL/min,加入化疗药物(5-FU和DDP),加热灌注液至43 ℃,热灌注化疗60~90 min;灌注机试验正常,无菌条件下连接专用循环通路与各预置的灌注管,形成密闭环路,使加热的灌注液流入腹腔并持续循环。同时,给予盐酸哌替啶加盐酸异丙嗪止痛,灌注速度400~600 mL/min,每隔1 d重复1次,3次为1个疗程。在整个灌注过程中严密监测患者生命体征变化,若患者出现腹部不适可适当调慢灌注速度。所有患者化疗后给予止吐处理,预防恶心、呕吐等消化道不良反应,同时给予保肝、水化、碱化及利尿等对症支持治疗。
1.4 疗效评定(1) 生活质量评定[8]:改善,KPS评分增加≥10分;稳定,KPS评分增加 < 10分或减少 < 10分;降低,KPS评分减少≥10分。(2) 近期疗效评定:依据WHO实体肿瘤客观判定标准[9],分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、无变化(no change, NC)、进展(progressive disease, PD),有效为CR+PR。(3) 比较两组患者天冬氨酸转氨酶(aspartate aminotransferase, AST)、丙氨酸转氨酶(alanine aminotransferase, ALT)、γ-谷氨酰转移酶(γ-glutamyl transferase, γ-GT)、总胆红素(total bilirubin, TB)、碱性磷酸酶(alkaline phosphatase, ALP)等肝功能指标,以及血清糖类抗原19-9(carbohydrate antigen 19-9, CA19-9) 指标变化。(4) 不良反应评定:依据WHO不良反应分级标准[9],分为血液系统、胃肠道、肾与膀胱、心脏和神经系统5个部分,分为0~Ⅳ度,分级越高越严重。治疗后第2天进行疗效评估,术后2个月后复查CT评估肿瘤缩小情况。
1.5 随访所有患者均给予电话随访或者门诊随访,每3个月随访1次,最近一次随访时间为2016年12月,随访6~28个月,中位随访时间15个月。无失访,随访率100%。
1.6 统计学处理应用SPSS 20.0软件进行统计学分析。计量资料用x±s或中位数[最小值, 最大值]表示,组间比较采用独立样本t检验或Mann-Whitney U检验;计数资料用频数(%)表示,组间比较采用χ2检验;等级资料比较采用Mann-Whitney U检验。生存分析中数据用x±sx表示,采用Log-Rank(Mantel-Cox)检验。检验水准(α)为0.05。
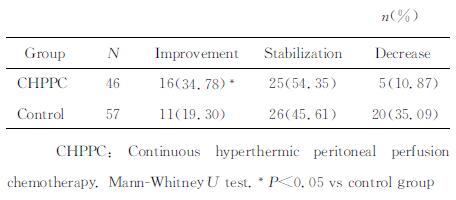
2 结果 2.1 生活质量评定治疗后,根据KPS评分变化,CHPPC组的生活质量改善率为34.78%(16/46),高于对照组的19.30%(11/57),两组比较差异有统计学意义(Z=-2.441,P < 0.05)。详见表 1。
|
|
表 1 两组患者生存曲线比较 Tab 1 Comparison of survival time of patients between two groups |
2.2 近期疗效
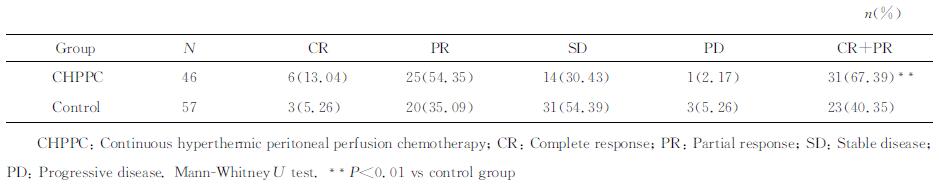
CHPPC组的近期疗效有效率为67.39%(31/46),高于对照组的40.35%(23/57),两组比较差异有统计学意义(Z=-3.685,P < 0.01)。详见表 2。
|
|
表 2 两组患者治疗后生活质量评定 Tab 2 Quality of life of patients in two groups |
2.3 肝功能指标及血清CA19-9变化
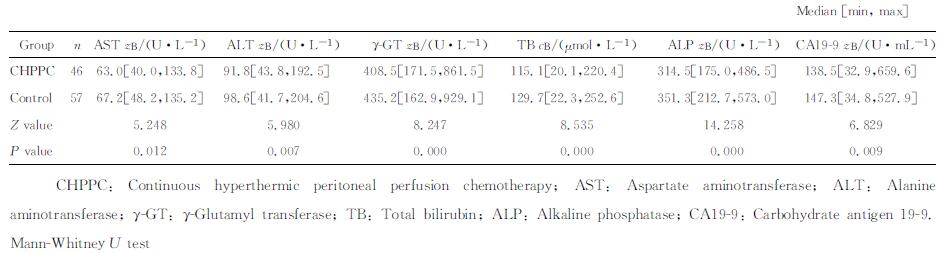
CHPPC组的肝功能指标(AST、ALT、γ-GT、TB、ALP)及血清CA19-9的中位数水平均低于对照组,差异有统计学意义(P < 0.05)。详见表 3。
|
|
表 3 两组患者肝功能和血清CA19-9水平的比较 Tab 3 Comparison of liver function and CA19-9 level of patients between two groups |
2.4 不良反应
CHPPC组白细胞减少、血小板减少及肝功能损伤的发生率低于对照组,两组比较差异有统计学意义(P < 0.05)。两组血红蛋白减少、胃肠道反应和肾功能损伤的发生率差异无统计学意义(P > 0.05)。详见表 4。
|
|
表 4 两组患者不良反应比较 Tab 4 Comparison of adverse reaction of patients between two groups |
2.5 生存时间比较
CHPPC组的生存时间为(12.00±2.47) 个月,长于对照组的(6.00±0.80) 个月,两组比较差异有统计学意义(P < 0.01)。见图 1。

|
图 1 两组患者生存曲线比较 Fig 1 Comparison of survival time of patients between two groups CHPPC: Continuous hyperthermic peritoneal perfusion chemotherapy. Log-Rank (Mantel-Cox) test |
3 讨论
临床中认为,胆管癌的发生是由于细菌感染的内毒素及炎症因子等使胆管细胞分泌多能细胞因子,促使细胞分裂,逐步从胆管炎、胆管细胞增殖、慢性增生性胆管炎发展转变为胆管细胞癌[10]。对于进展期胆管癌患者而言,大部分已经失去了手术机会,姑息性手术治疗仅有胆道引流和缓解症状作用,临床上术后常用的化疗方案以氟尿嘧啶类和铂类药物为主,但其临床缓解率仅为15%左右[11],效果欠佳。因此,如何延长这部分患者生存期、改善预后、提高患者生活质量成为临床治疗的重点内容。
CHPPC是在1988年由Fujimoto等[12]首次用于治疗胃肠肿瘤,目前在临床中已广泛应用于治疗腹腔恶性肿瘤。CHPPC是将化疗药物加热灌注至腹腔,提高局部温度至43 ℃,在保护正常组织不受损害的前提下,选择性杀伤肿瘤细胞使其凋亡[13]。同时,CHPPC可使化疗药物敏感性增加,细胞膜通透性增加,肿瘤细胞的DNA损伤加重; 使肿瘤细胞无氧酵解增加,杀伤能力提高; 使癌细胞耐药性下降[14]。热疗可以有效促进肿瘤血供,提高药物浓度与疗效。CHPPC所产生的热效应可诱导产生具有骨髓刺激作用的细胞因子,对机体免疫功能及骨髓也有一定保护作用[15-16]。较常规静脉化疗而言,CHPPC局部治疗可有效提高药物局部浓度,有数据显示局部浓度可达到血清浓度的10~20倍,使化疗药物与癌细胞接触时间有效延长,有效杀伤肿瘤,且药物经门静脉系统循环入肝对机体的全身不良反应较轻[17]。
本研究绝大部分为晚期患者,无法行根治性切除手术。CHPPC组在肿瘤姑息性切除术后采用了CHPPC,结果显示CHPPC组的生存时间[(12.00±2.47) 个月]长于术后采用常规静脉化疗的对照组[(6.00±0.80) 个月];CHPPC组生活质量改善率为34.78% (16/46),高于对照组的19.30% (11/57);CHPPC组有效率为67.39% (31/46),高于对照组的40.35% (23/57);CHPPC组的血清CA19-9水平也低于对照组,提示CHPPC较常规静脉化疗而言,不仅可有效提高患者临床有效率,改善患者临床症状,延长生存时间,而且可以提高患者的生活质量。目前肿瘤姑息性切除术+CHPPC已经广泛应用于胃肠癌、卵巢癌、腹膜癌等治疗,并取得较好的疗效[18-19],但是在进展期胆管癌的治疗中研究较少,也未见报道,本研究表明该方法在进展期胆管癌中也获得了较好的疗效。
在两组肝功能指标变化方面,CHPPC组AST、ALT、γ-GT、TB及ALP的中位数水平均低于对照组。在两组不良反应发生情况方面,CHPPC组白细胞减少、血小板减少和肝功能损伤的发生率低于对照组,这可能与腹膜-血浆屏障可以明显减缓化疗药物的吸收、延长药物的作用时间、降低血药浓度并减少了骨髓抑制作用有关。虽然热化疗直接接触肠管,可能引起恶心、呕吐等胃肠道反应,但是在临床观察中,反应程度普遍较轻,应用适量的止吐药物即可缓解。两组的胃肠道反应、血红蛋白减少和肾功能损伤的发生率差异无统计学意义。
术后吻合口瘘是严重的并发症,胆道手术后通常行胆肠吻合,但是在本研究中,CHPPC组无一例因CHPPC导致的胆肠吻合口瘘的发生,与文献[20-21]报道结果相似。因此,我们认为CHPPC对胆肠吻合口瘘的发生无明显影响。
综上所述,CHPPC治疗进展期胆管癌临床疗效显著,可延长患者生存时间,改善生活质量,不良反应较轻,对胆肠吻合口影响小,进展期胆管癌行肿瘤姑息性切除术+CHPPC是安全的,值得推广应用。
| [1] | 王越, 徐林, 沈春健, 车艳, 何旭, 姚建, 等. 胆管癌危险因素的病例对照研究[J]. 中华普通外科杂志, 2011, 26: 260–261. DOI: 10.3760/cma.j.issn.1007-631X.2011.03.034 |
| [2] | 王煜, 王炜, 章志翔. 肝外胆管癌87例临床治疗分析[J]. 中国普通外科杂志, 2015, 24: 2338–2340. |
| [3] | 陈筱莉, 文彬. 胆管癌的研究进展[J]. 临床与实验病理学杂志, 2013, 29: 434–437. DOI: 10.3969/j.issn.1001-7399.2013.04.021 |
| [4] | 胡贤荣, 胡冰. 光动力治疗在胆管癌姑息性治疗中的应用[J]. 中国微创外科杂志, 2015, 15: 460–464. DOI: 10.3969/j.issn.1009-6604.2015.05.022 |
| [5] | 韩建军, 贾霖, 高飞, 何君, 贾利. 结肠癌术后早期腹腔热灌注化疗的疗效分析[J]. 实用癌症杂志, 2016, 31: 1525–1527. DOI: 10.3969/j.issn.1001-5930.2016.09.042 |
| [6] | 姬忠贺, 孙建华, 武海涛, 张倩, 彭开文, 李雁. 腹腔热灌注化疗对腹腔游离癌细胞杀灭效果的评价[J]. 中国肿瘤临床, 2015, 42: 963–968. DOI: 10.3969/j.issn.1000-8179.2015.19.848 |
| [7] | 国际肝胆胰学会中国分会, 中华医学会外科学分会肝脏外科学组. 胆管癌诊断与治疗——外科专家共识[J]. 临床肝胆病杂志, 2015, 31: 12–56. DOI: 10.3969/j.issn.1001-5256.2015.01.003 |
| [8] | 谭诗生, 李杭, 罗健, 陈南江, 宋毅, 姜桂林, 等. 欧洲癌症研究与治疗组织研制的生活质量核心调查问卷第3版中文版生活质量调查问卷测评[J]. 中国临床康复, 2006, 10: 23–27. DOI: 10.3321/j.issn:1673-8225.2006.04.006 |
| [9] | 周际昌. 实用肿瘤内科学[M]. 2006: 28-41. |
| [10] | 邓敏, 仇毓东, 陈骏, 严笑鹏, 毛谅, 周铁. 胆管细胞性肝癌与肝内胆管癌的临床及病理特征研究[J]. 肝胆外科杂志, 2015, 23: 165–168. DOI: 10.3760/cma.j.issn.1007-8118.2015.03.006 |
| [11] | 杨军, 李向农, 侍阳. 肝门部胆管癌术后生存情况的影响因素分析[J]. 胃肠病学和肝病学杂志, 2014, 23: 1464–1467. |
| [12] | FUJIMOTO S, SHRESTHA R D, KOKUBUN M, OHTA M, TAKAHASHI M, KOBAYASHI K, et al. Intraperitoneal hyperthermic perfusion combined with surgery effective for gastric cancer patients with peritoneal seeding[J]. Ann Surg, 1988, 208: 36–41. DOI: 10.1097/00000658-198807000-00005 |
| [13] | 牟洪超, 崔书中. 持续循环腹腔热灌注化疗治疗肝胆胰恶性肿瘤的临床应用[J/CD]. 消化肿瘤杂志(电子版), 2012, 4: 223-227. |
| [14] | 崔欢. 腹腔热灌注化疗治疗卵巢癌研究进展[J]. 中华实用诊断与治疗杂志, 2013, 27: 729–730. |
| [15] | 王金焕, 王振玲, 王晓芳, 赵智刚. 化疗药物对骨髓间充质干细胞的损伤作用[J]. 中国组织工程研究, 2014, 18: 8080–8087. DOI: 10.3969/j.issn.2095-4344.2014.50.008 |
| [16] | WU Y, PAN M, CUI S, BA M, CHEN Z, RUAN Q. Efficacy and safety of ultrasound-guided continuous hyperthermic intraperitoneal perfusion chemotherapy for the treatment of malignant ascites:a midterm study of 36 patients[J]. Onco Targets Ther, 2016, 9: 403–407. |
| [17] | 宋展, 钱国武, 吕柯, 张海洋, 王新伟, 孙晓林, 等. 局部进展期胃癌术中腹腔热灌注化疗的疗效评价[J]. 中华普通外科杂志, 2015, 30: 425–427. DOI: 10.3760/cma.j.issn.1007-631X.2015.06.001 |
| [18] | YANG X J, LI Y, YONEMURA Y. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy to treat gastric cancer with ascites and/or peritoneal carcinomatosis:results from a Chinese center[J]. J Surg Oncol, 2010, 101: 457–464. DOI: 10.1002/jso.v101:6 |
| [19] | COSTA W L Jr, COIMBRA F J, RIBEIRO H S, DINIZ A L, DE GODOY A L, BEGNAMI M, et al. Safety and preliminary results of perioperative chemotherapy and hyperthermic intraperitoneal chemotherapy (HIPEC) for high-risk gastric cancer patients[J]. World J Surg Oncol, 2012, 10: 195. DOI: 10.1186/1477-7819-10-195 |
| [20] | HALKIA E, EFSTATHIOU E, ROGDAKIS A, CHRISTAKIS C, SPILIOTIS J. Digestive fistulas after cytoreductive surgery & HIPEC in peritoneal carcinomatosis[J]. J BUON, 2015, 20(Suppl 1): S60–S63. |
| [21] | KUSAMURA S, BARATTI D, HUTANU I, ROSSI P, DERACO M. The importance of the learning curve and surveillance of surgical performance in peritoneal surface malignancy programs[J]. Surg Oncol Clin N Am, 2012, 21: 559–576. DOI: 10.1016/j.soc.2012.07.011 |
 2017, Vol. 38
2017, Vol. 38