2. 新疆维吾尔自治区中药民族药研究所, 乌鲁木齐 830002
2. Institute of Traditional Chinese Medicine and Ethnodrug, Urumqi 830002, Xinjiang Uygur Autonomous Region, China
近年来,由于广谱抗生素、免疫抑制剂、糖皮质激素等药物在临床上的广泛应用,深部真菌感染的发病率和病死率大幅增加[1-3], 其中白假丝酵母菌(Candida albicans, CA)、烟曲霉(Aspergillus fumigatus, AF)和新生隐球菌(Cryptococcus neoformans, CN)为最常见的深部感染真菌。除现有抗真菌药物种类较少、抗真菌作用不强、抗真菌谱较窄、不良反应较大外,随着氮唑类药物在临床上的长期应用,真菌耐药现象也日趋严重(部分真菌如克柔念珠菌、AF等先天耐药;CA的继发性耐药,以及真菌在体内形成生物被膜、转变成菌丝后的高度耐药),抗真菌新药的研发迫在眉睫。从天然药物中发现抗真菌新药及协同现有药物抗耐药真菌的药物是目前抗真菌新药研发的重要策略之一[4-5]。维吾尔民族药(以下简称维药)是新疆少数民族千百年来的医药学的创造,是中药的重要组成部分,新疆独特的地理位置和气候条件孕育了它的独特性,但对其研究相对薄弱,缺乏系统的现代化研究[6]。马志桥等[7]通过对新疆维药成药的专利申请与研究进行文献调研及系统性分析,发现其治疗领域主要集中在皮肤病、风湿病等病种,且多数是较为原始的复方研究,单组分单成分研究较少。因此我们参考《中华本草》(第三十三卷-维吾尔药卷)[8],选择临床应用悠久、疗效确切、基源清楚,具有维吾尔民族特色的122味药材[9-10],采用统一筛选标准进行抗深部真菌作用的活性测定,并进一步探索其抗菌谱及与氟康唑(fluconazole,FLC)的协同作用,并初步确定其活性部位,为临床用药和民族药开发提供一定的理论依据。
1 材料和方法 1.1 材料、试剂与仪器122味维药材(详见附表 1)均由新疆中药民族药研究所提供,并经该研究所贾晓光教授鉴定,凭证标本(201510A1~A122) 保存在第二军医大学药学院新药研究中心;FLC注射液(2 mg/mL,批号A447404) 购自美国Pfizer公司,伏立康唑(voriconazole,VCZ)及酮康唑(ketoconazole,KCZ)均购自美国Sigma公司。没食子酸(CAS:149-91-7, PS08121401) 购于成都普思生物科技股份有限公司, 磷钼钨酸试液购于厦门海标科技有限公司,其他试剂均购于国药集团化学试剂有限公司。
|
|
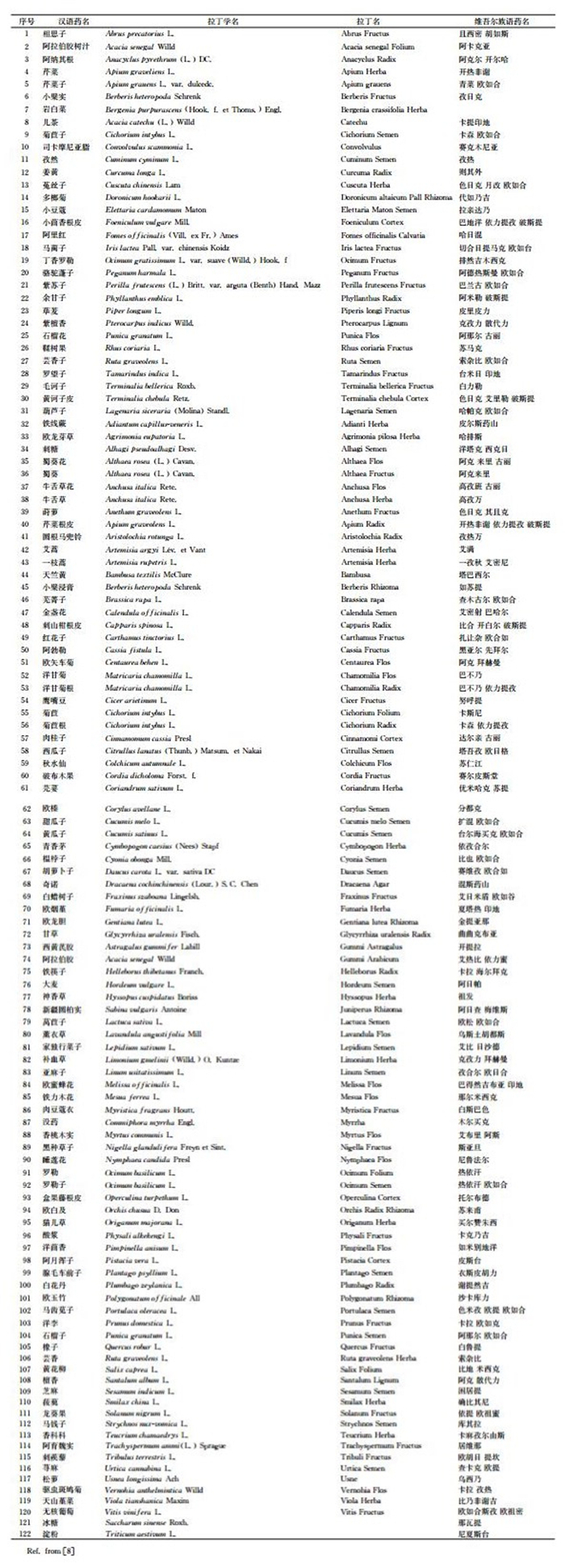
附表 1 122种维吾尔药名及拉丁名 |
DL-1000B型智能超声波清洗器(上海之信仪器有限公司),SW-CT-IF型单人双面超净化工作台(苏州安泰空气技术有限公司),XW-80A型漩涡混合器(上海琪特分析仪器有限公司),隔水式电热恒温培养箱(上海跃进医疗器械厂),MJX型智能霉菌培养箱(宁波江南仪器厂),Multiskan MK3型酶标仪(芬兰Labsystems公司),TECAN Infinite M200型多功能酶标仪(瑞士)。
RPMI 1640培养液:RPMI 1640 (美国Gibco公司)10 g、NaHCO3 2.0 g、吗啡啉丙磺酸(morpholinepropanesulfonic acid, MOPS;美国Sigma公司)34.5 g,加三蒸水900 mL溶解,以1 mol/L NaOH调pH至7.0(25 ℃),三蒸水定容至1 000 mL,0.22 μm微孔滤膜过滤除菌, 4 ℃保存。
YEPD培养液:酵母浸膏10 g、蛋白胨20 g、葡萄糖20 g,加三蒸水900 mL溶解,加入2 mg/mL氯霉素水溶液50 mL,三蒸水定容至1 000 mL,高压灭菌(121 ℃,15 min),4 ℃保存。
沙堡葡萄糖琼脂培养基:蛋白胨10 g、葡萄糖40 g、琼脂18 g,定容至1 000 mL,高压灭菌(121 ℃,15 min),4 ℃保存。
CA国际标准菌株SC5314、Y0109由美国华盛顿乔治敦大学William A.Fonzi教授惠赠; CN32609、AF7544、CA102、CA103、近平滑假丝酵母菌(Candida parapsilosis, CP)ATCC22019、光滑假丝酵母菌(Candida glabrata, CG)537、石膏样小孢子菌(Microsporum gypseum, MG)、红色毛癣菌(Trichophyton rubrum, TR)由第二军医大学长海医院真菌室提供。所有菌株均经形态学和分子鉴定。
1.2 药材的提取药材粉碎,过20目筛,取10 g药粉于5倍量的75%乙醇中浸泡,30 ℃充分振摇24 h,超声提取60 min,离心取上清液,得终浓度为200 mg生药/mL的提取液,置于-20 ℃冰箱备用。
1.3 最低抑菌浓度(minimum inhibitory concentration, MIC)测定 1.3.1 阳性对照药配制VCZ和KCZ用二甲亚砜(DMSO)溶解,配制成6.4 mg/mL药物母液,置于-20 ℃冰箱备用。
1.3.2 菌悬液配制酵母菌于35 ℃ SDA固体培养基划线孵育24~48 h,挑取单菌落接种至YEPD培养液,于30 ℃、200 r/min振荡培养16 h,使菌株处于生长对数期;丝状菌(AF、MG和TR)于35 ℃马铃薯葡萄糖琼脂培养基孵育7 d,经4层无菌纱布过滤,以保证菌株活力;以血细胞计数板计数,用RPMI 1640培养液调整酵母菌液浓度为(0.5~2.5)×103 CFU/mL、丝状菌孢子浓度为(0.5~2.5)×104 CFU/mL,用于药敏实验铺板。
1.3.3 体外抑菌活性测定参照2008年和2009年美国临床实验室标准化协会(CLSI)推荐的M38-A2和M27-A3微量液基稀释法[11-12]:取无菌96孔板,于每排1号孔加100 μL RPMI 1640培养液作空白对照,12号孔只加100 μL菌悬液作生长对照;2号孔分别加菌液198 μL和药液2 μL,3~11号孔各加菌悬液100 μL,从2~11号孔依次倍比稀释,使各孔的最终维药提取物浓度分别为2 000、1 000、500、250、125、62.5、31.25、15.63、7.81、3.91 μg/mL;阳性对照药FLC、VCZ和KCZ的终浓度分别为16、8、4、2、1、0.5、0.25、0.13、0.063和0.031 μg/mL,各孔中乙醇或DMSO的含量均低于1%。药敏板于35 ℃恒温培养箱中培养,假丝酵母菌和AF孵育48 h、CN孵育72 h,用酶标分析仪于630 nm处测各孔光密度(D)值,并辅以目测。每次配制药敏板的同时均制备一质控菌药敏板。
1.3.4 MIC值结果判定与生长对照孔(D值控制在0.2左右)比较,以D值下降90%以上的最低浓度孔为MIC值(即真菌生长被抑制90%时的药物浓度)。维药提取物大多颜色较深,部分D值偏高,同时辅以目测,以肉眼观察无菌生长的最低浓度为MIC,若D值偏高,以目测为准。实验过程严格对照,设有质控菌株(CP ATCC22019) 及质控化合物(FLC、VCZ、KCZ),其MIC参考值如下:FLC 0.5~4.0 μg/mL;VCZ 0.016~0.12 μg/mL;KCZ为0.03~0.25 μg/mL。每次实验时质控菌MIC值介于CLSI M38-A2和M27-A3公布的标准范围内,且对照菌株生长良好,方认为实验操作准确可靠,结果可接受。实验均在不同时间段重复3次,3次结果不超过一个浓度差则可用,且以较高浓度作为MIC值。
1.4 联合FLC对抗耐药CA103的作用采用棋盘式微量液基稀释法[12-14]:合用的2种药物于96孔板上以二维棋盘的纵(A~D)、横(2~11) 两个方向分别进行2倍的倍比稀释,使得FLC的终浓度为1、0.5、0.25和0.13 μg/mL,维药提取物合用的终浓度为1 000、500、250、125、62.5、31.25、15.63、7.81、3.91和1.95 μg/mL。实验所用试剂、药物单用、实验操作步骤同上述1.3项。联合用药结果判定:部分抑菌浓度指数(fractional inhibitory concentration index,FICI)是评价联合用药的两药相互作用方式的主要参数,FICI计算方法:将2种药物联合抑菌时的MIC值与单用时MIC值的比值相加。本实验选用目前国际公认的标准评价联合用药效果:FICI≤0.5,协同作用,且FICI指数越小,协同作用越强;0.5 < FICI≤1,相加作用;1 < FICI≤4,无关作用;FICI > 4,拮抗作用。
1.5 各部位鞣质含量测定及抗真菌活性测定 1.5.1 对照品溶液制备精密称取没食子酸对照品0.050 8 g,置100 mL棕色量瓶中,加水溶解并稀释至刻度,精密量取5 mL,置50 mL棕色量瓶中,用水稀释至刻度,摇匀,即得含没食子酸0.05 mg/mL的对照品溶液。
1.5.2 供试品溶液制备选取抗CA MIC值 < 250 μg/mL的黄诃子皮、毛诃子、鞣树果、阿拉伯胶树汁、岩白菜5味药材粉末各20 g,用10倍体积的70%丙酮浸泡4 h,超声提取30 min,共提取4次,3 000×g室温离心10 min,合并4次提取液,减压回流干燥至恒质量,为粗总鞣质部位;将药渣用75%乙醇按照丙酮提取法再次提取,减压回流干燥至恒质量,我们认为是非鞣质部位;将粗总鞣质部位与2倍体积的水混悬,依次用等体积的乙醚、乙酸乙酯、正丁醇萃取,然后分别回收溶剂得到乙醚部位、乙酸乙酯部位、正丁醇部位及水部位。使用乙醚是除去极性较小的杂质,而乙酸乙酯部位和正丁醇部位是较纯的鞣质部位。取各部位,精密称定,置250 mL棕色量瓶中,加水150 mL,放置过夜,超声处理10 min,冷却,加水稀释至刻度,摇匀,静置,过滤取续滤液20 mL,置100 mL棕色量瓶,用水稀释至刻度,摇匀。
1.5.3 标准曲线绘制精密量取对照品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL,分别置25 mL棕色量瓶中,各加入磷钼钨酸试液1 mL,再分别加水11.5、11、10、9、8、7 mL,用29%碳酸钠溶液稀释至刻度,摇匀,避光30 min,在760 nm的波长处测定D值。以D值为纵坐标y、浓度为横坐标x绘制标准曲线。线性方程y=0.036 5x+0.042 8,相关系数R2=0.999 6,在1.0~10.0 μg/mL范围内线性关系良好。
1.5.4 鞣质含量测定总酚:精密量取供试品溶液2 mL,置25 mL棕色量瓶中,按照1.5.3项下的方法,自“加入磷钼钨酸试液1 mL”起,加水10 mL,依法测定D值,根据标准曲线计算供试品溶液中没食子酸的量(mg)。
不被吸附的多酚:取供试品溶液25 mL,加至已盛有干酪素0.6 g的100 mL具塞锥形瓶中,密塞,置30 ℃水浴中保温1 h,时时振摇,取出,放冷,摇匀,滤过。弃去初滤液,精密量取续滤液2 mL,置25 mL棕色量瓶中,按照1.5.3项下的方法,自“加入磷钼钨酸试液1 mL”起,加水10 mL,依法测定D值,根据标准曲线计算供试品溶液中没食子酸的量(mg)。同时进行干酪素吸附空白试验,计算扣除空白值。
按下式计算鞣质的含量:鞣质含量=总酚量-不被吸附的多酚量。3次测定结果取平均值。
1.5.5 体外抑菌活性测定精密称取乙醚部位、乙酸乙酯部位、正丁醇部位、水部位及粗总鞣质部位,用30%乙醇溶解制成6.4 mg/mL溶液进行活性测定。药物测试浓度范围0.25~128 μg/mL。测定方法与1.3项相同。
2 结果 2.1 122味维药醇提物体外抗深部真菌活性筛选本实验药物浓度范围为3.91~2 000 μg/mL(生药量),将MIC值 > 2 000 μg/mL视为无效。经测定,对CN有效的维药有21味,对CA有效的有15味,仅姜黄对AF有效。小檗果实、黑种草子、芸香子、相思子、阿纳其根、芹菜籽这6味药仅对CN有抑制作用,MIC值分别为62.5、250、250、500、500、500 μg/mL。
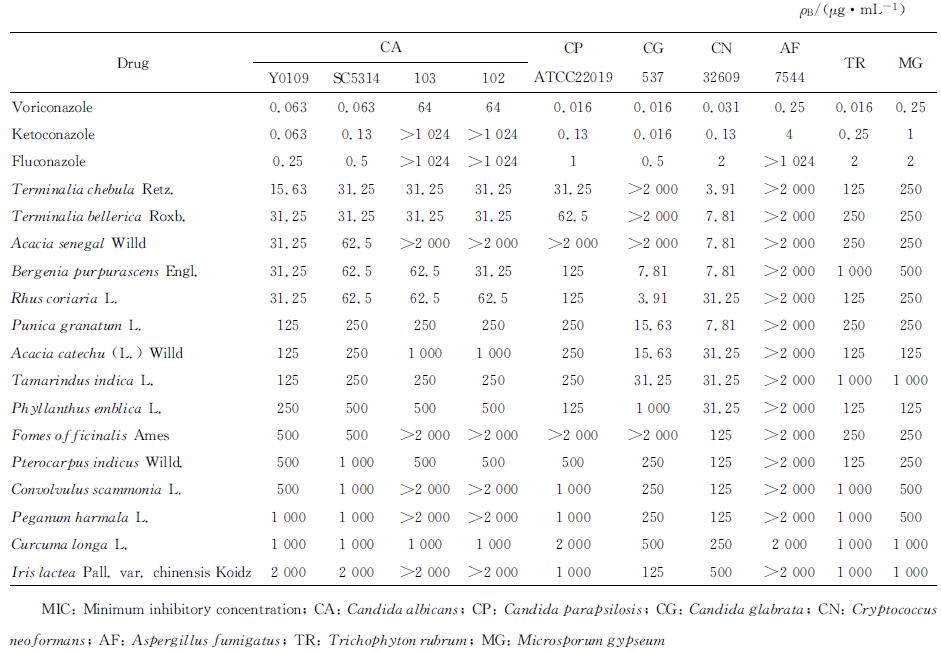
2.2 考察对CA SC5314有抑制作用的15味维药的抗菌谱结果表明,大多数维药对耐药CA、CN、CP等都有较好的抑制作用,其中姜黄抗菌谱最广,能抑制所有测试菌株。对CA SC5314抑制效果较好的有黄诃子皮、毛诃子、鞣树果、阿拉伯胶树汁、岩白菜5味药材,其MIC值均≤62.5 μg/mL;黄诃子皮、毛诃子、阿拉伯胶树汁、鞣树果、儿茶、石榴花、余甘子、阿里红、紫檀香9味药材对TR和MG均有抑制作用,且MIC值≤250 μg/mL。详见表 1。
|
|
表 1 15味维药醇提物对10种常见致病真菌的抗真菌作用(MIC) Tab 1 In vitro antifungal effects (MIC) of 15 kinds of Uighur medicines against 10 common pathogenic fungi |
2.3 维药协同FLC抗临床耐药CA103活性测定结果
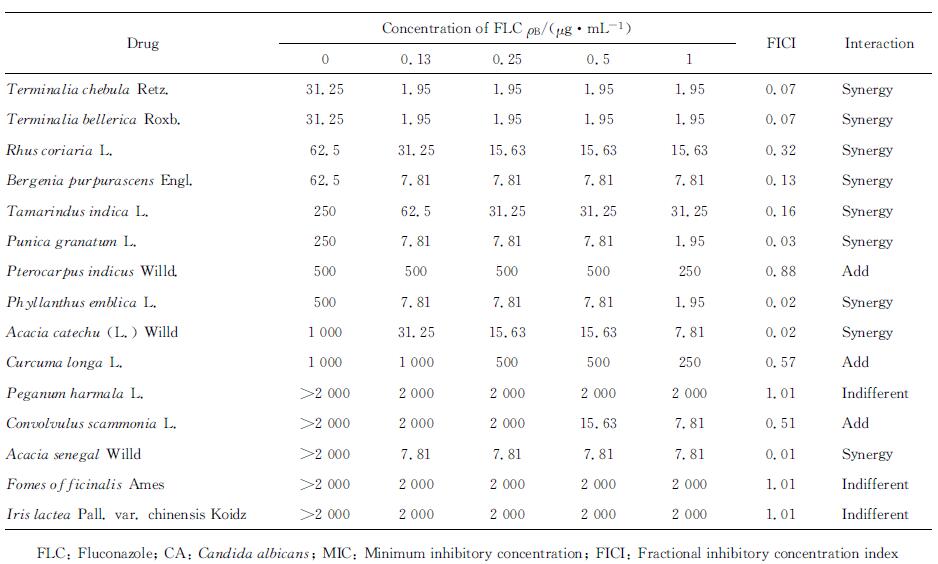
对CA SC5314有抑制作用的15味药材中,除骆驼蓬子、马蔺子、阿里红无协同作用,紫檀香、司卡摩尼亚脂、姜黄表现为相加作用外,黄诃子皮、毛诃子、鞣树果、岩白菜、罗望子、石榴花、阿拉伯胶树汁、余甘子、儿茶9味维药与FLC合用对临床耐药菌CA103表现出较强抑菌活性,能使FLC对耐药CA的MIC值( > 1 024 μg/mL)平均降低64倍以上;阿拉伯胶树汁单用对耐药CA103无效,但与FLC合用后MIC值下降,协同作用最为显著,FICI值低至0.01。详见表 2。
|
|
表 2 15味维药醇提物单用及联合FLC对CA103的作用(MIC) Tab 2 Effect (MIC) of 15 Uighur medicines single and combined with FLC against CA103 |
2.4 5味抗真菌维药的活性部位初探
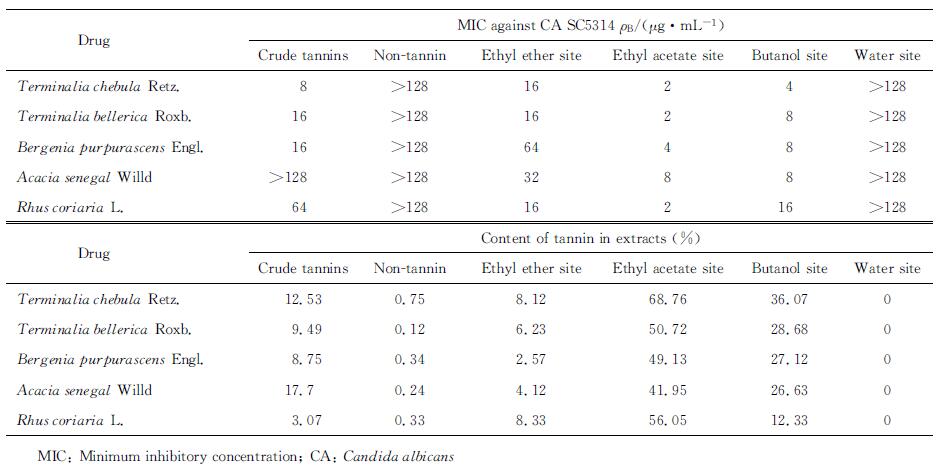
黄诃子皮、毛诃子、岩白菜、阿拉伯胶树汁、鞣树果各部位抗CA SC5314的MIC值和鞣质含量测定结果见表 3。结果表明,抗真菌活性较强的部位鞣质含量相对较高,而鞣质含量较低的部位则不具有抗真菌活性,如黄诃子皮的乙酸乙酯部位和正丁醇部位的鞣质含量分别为68.76%和36.07%,相对应的MIC值为2 μg/mL和4 μg/mL;水部位不含鞣质,其MIC值>128 μg/mL。
|
|
表 3 5味维药各部位抗CA SC5314的MIC值和鞣质含量测定 Tab 3 MIC values and contents of tannin of different parts of 5 kinds of Uygur medicines against CA SC5314 |
3 讨论
维吾尔医药是中国传统民族医学的重要组成部分,是集中医、波斯医学、阿拉伯医学和古希腊医学之长形成的医药学理论和临床实践基础[15]。新疆地处亚欧大陆中心,其特殊的地理位置和环境孕育了维药的独特性,目前维药材的治疗领域主要集中在皮肤病、风湿病等少数几个病种,其中又以皮肤病居首,例如新疆知名治疗皮肤病的良药地锦草、雅丽蔓、驱虫斑鸠菊、阿纳齐根,以及组方类药百癣夏塔热胶囊、复方卡力孜然酊等[7, 16-18],体现了维药在真菌病治疗领域有独特优势。
本研究首次用统一筛选标准对122味维药进行了系统性体外抗深部真菌活性研究,发现其中15味维药抗真菌作用较强,大多能协同FLC抗耐药CA,且初步断定其主要活性成分是鞣质。因初筛进行的是大规模药物活性测定,我们无法保证同一提取方法对所有药物的提取均能达到最大效率,故仅根据提取溶剂极性大小对乙醇提取浓度进行了摸索,将文献报道较好的中药(五倍子、月季花、黄连、苦参等12味中药)进行了水提物(0%)、75%醇提物、99%醇提物的抗CA活性测定,发现75%乙醇提取物的抗真菌效果相对较好,且相比水提提取液相对澄清、不易沉淀。故我们选取75%乙醇作为中药提取浓度。
分析122味维药体外抗真菌活性结果,我们发现维药对CN抑制作用明显,但对AF有效的极少,且对CN有效的维药大多数对CA也有很好的抑制作用。进一步扩大抗菌谱发现,除阿拉伯胶树汁、阿里红、司卡摩尼亚脂、骆驼篷子和马蔺子5味药物对CA耐药菌不敏感,其余10味药材对CA标准菌和耐药菌均有较好的抑制作用,提示我们这10味维药对CA基本无耐药性或耐药性小。同一味维药虽对不同菌株的抗菌活性不同,但对酵母菌属和丝状菌属表现出很好的一致性(对假丝酵母菌效果较好的药物对TR和MG也有较好活性),如鞣树果、岩白菜、儿茶、石榴花、罗望子、余甘子等。协同抗耐药CA结果发现,黄诃子皮、毛诃子、鞣树果、岩白菜、罗望子、石榴花、阿拉伯胶树汁、余甘子、儿茶这9味维药与FLC合同也有较好的增效作用。
对CA MIC值 < 250 μg/mL的5味维药进行文献调研,发现它们主要成分中均含较多鞣质,故提取鞣质部位及非鞣质部位进行抗真菌活性测定,发现非鞣质部位基本无抗真菌活性,鞣质部位活性较好。为了考察鞣质含量与其抗真菌活性是否相关,我们参照2015年版《中华人民共和国药典》(四部)通则[19]部分,采用磷钼钨酸-干酪素法测定鞣质含量,发现鞣质含量高的部位抗真菌活性高,不含鞣质的水部位基本无抗真菌活性。如黄诃子皮、毛诃子、鞣树果的乙酸乙酯部位和正丁醇部位鞣质含量较高,相应的抗真菌活性较强;而水部位基本不含鞣质,相应的不具有抗真菌活性,因而认定鞣质为上述药材的主要抗真菌活性成分。抗真菌领域物质基础研究大多集中在生物碱、黄酮、挥发油类,对极性大部位鞣质关注较少,值得我们深入研究。
维药在抗真菌领域的研究尚不多,对维药的抗真菌活性进行系统性研究,深入挖掘维药材的抗真菌谱及协同抗真菌作用,将为探索寻找高效、低毒的抗真菌药物开辟途径,更为少数民族临床用药提供了科学依据。
| [1] | ANTINORI S, MILAZZO L, SOLLIMA S, GALLI M, CORBELLINO M. Candidemia and invasive candidiasis in adults:a narrative review[J]. Eur J Intern Med, 2016, 34: 21–28. DOI: 10.1016/j.ejim.2016.06.029 |
| [2] | McCARTY T P, PAPPAS P G. Invasive candidiasis[J]. Infect Dis Clin N Am, 2016, 30: 103–124. DOI: 10.1016/j.idc.2015.10.013 |
| [3] | PU S, NIU S, ZHANG C, XU X, QIN M, HUANG S, et al. Epidemiology, antifungal susceptibilities, and risk factors for invasive candidiasis from 2011 to 2013 in a teaching hospital in southwest China[J]. J Microbiol Immunol Infect, 2017, 50: 97–103. |
| [4] | MARTIN K W, ERNST E. Herbal medicines for treatment of fungal infections:a systematic review of controlled clinical trials[J]. Mycoses, 2004, 47: 87–92. DOI: 10.1046/j.1439-0507.2003.00951.x |
| [5] | DENNING D W, BROMLEY M J. How to bolster the antifungal pipeline[J]. Science, 2015, 347: 1414–1416. DOI: 10.1126/science.aaa6097 |
| [6] | 刘永刚, 木艾塔尔·努尔麦麦提, 阿曼古丽, 赵娜, 木叶赛尔·吐尔逊, 杨小林. 维药开发中存在的问题及建议[J]. 中国现代中药, 2014, 16: 87–89. |
| [7] | 马志桥, 章懋妤, 胡豪, 王一涛. 新疆维吾尔药成药研究进展——基于专利申请与学术文献分析[J]. 中国民族民间医药, 2013, 22: 4–7. DOI: 10.3969/j.issn.1007-8517.2013.02.004 |
| [8] | 国家中医药管理局, 《中华本草》编委会. 中华本草:维吾尔药卷[M]. 上海: 上海科学技术出版社, 2005. |
| [9] | GRAZIOSE R, LILA M A, RASKIN I. Merging traditional Chinese medicine with modern drug discovery technologies to find novel drugs and functional foods[J]. Curr Drug Discov Technol, 2010, 7: 2–12. DOI: 10.2174/157016310791162767 |
| [10] | LIU Q, LUYTEN W, PELLENS K, WANG Y, WANG W, THEVISSEN K, et al. Antifungal activity in plants from Chinese traditional and folk medicine[J]. J Ethnopharmacol, 2012, 143: 772–778. DOI: 10.1016/j.jep.2012.06.019 |
| [11] | Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards:Reference method for broth dilution antifungal susceptibility testing of yeast. Approved Standard, edn 3; Document M38-A2[S]. Wayne, PA:Clinical and Laboratory Standards Institute. 2008. |
| [12] | Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards:Reference method for broth dilution antifungal susceptibility testing of yeast. Approved Standard, edn 3; Document M27-A3[S]. Wayne, PA:Clinical and Laboratory Standards Institute. 2009. |
| [13] | HUANG S, CAO Y Y, DAI B D, SUN X R, ZHU Z Y, CAO Y B, et al. In vitro synergism of fluconazole and baicalein against clinical isolates of Candida albicans resistant to fluconazole[J]. Biol Pharm Bull, 2009, 31: 2234–2236. |
| [14] | YANG F, DING S, LIU W, LIU J, ZHANG W, ZHAO Q, et al. Antifungal activity of 40 TCMs used individually and in combination for treatment of superficial fungal infections[J]. J Ethnopharmacol, 2015, 163: 88–93. DOI: 10.1016/j.jep.2015.01.025 |
| [15] | 颜承云, 谷继伟, 宗希明, 佟德成. 我国民族药资源概述[J]. 黑龙江医药科学, 2003, 26: 46–47. DOI: 10.3969/j.issn.1008-0104.2003.01.041 |
| [16] | 古力娜·达吾提, 尤丽吐孜, 艾则孜·亚森, 努尔买买提. 维药地锦草软膏的体外抗真菌及其对豚鼠皮肤真菌感染的治疗作用研究[J]. 中药药理与临床, 2007, 23: 178–180. DOI: 10.3969/j.issn.1001-859X.2007.05.089 |
| [17] | 尤力都孜·买买提, 努尔买买提·艾买提, 艾则孜·亚森, 古力娜·达吾提. 维药雅丽蔓制剂体外抗真菌作用研究[J]. 中国民族医药杂志, 2006, 12: 50–51. DOI: 10.3969/j.issn.1006-6810.2006.03.031 |
| [18] | 李鸿飞, 孙宇, 卿德刚, 倪慧, 贾晓光, 张娟. 进口维药白花丹与国产白花丹的比较[J]. 新疆中医药, 2014, 32: 68–70. |
| [19] | 国家药典委员会. 中华人民共和国药典[S]. 四部. 北京: 中国医药科技出版社, 2015: 2202. |
 2017, Vol. 38
2017, Vol. 38