心脏瓣膜置换或成形术是在全麻体外循环下进行的手术,患者一般病情较重,术后常需进入重症监护病房(ICU),并给予机械通气辅助呼吸,维持呼吸和循环系统功能的稳定[1]。术后患者因受手术创伤、疼痛、ICU特殊环境、各种医疗操作及治疗等影响,常发生焦虑及躁动,从而不利于病情的稳定及快速康复。理想的镇静治疗有利于减轻术后患者应激反应,减少患者与呼吸机间的对抗,稳定血流动力学,减少谵妄或躁动发生,保证各项操作的完成[2-4]。右美托咪定(dexmedetomidine)和丙泊酚(propofol)是当前ICU镇静治疗中最常用的药物。右美托咪定是一种α2肾上腺素受体激动剂,具有镇静和镇痛作用,对血流动力学影响小,无蓄积,不影响呼吸,不会引起恶心、呕吐等[5-6];丙泊酚具有起效快、持续时间短、苏醒迅速而平稳、后遗效应轻的特点,临床上普遍用于麻醉诱导、麻醉维持以及ICU危重患者的镇静[7-8]。本研究旨在比较这两种药物对心脏瓣膜术后患者的镇静效果及血流动力学的影响。
1 对象和方法 1.1 研究对象选取2014年8月至2015年7月在第二军医大学长征医院胸心外科行心脏瓣膜手术、术前心功能Ⅱ~Ⅲ级、预计术后机械通气时间 > 12 h的患者。排除标准:年龄≤18岁或 > 85岁;存在颅内疾病、精神类疾病、严重睡眠紊乱者;长期酗酒者;心肺转流(cardiopulmonary bypass, CPB)后2 h手术未结束;术后12 h内出现严重并发症如心跳骤停,再行剖胸探查术等。最终纳入患者60例,年龄19~81(53.59±15.15) 岁,其中男性28例、女性32例。所有患者术前均进行心脏超声检查,采用Simpson法测量左心室射血分数(left ventricular ejection fraction, LVEF)。所有患者均经口气管插管,接呼吸机(德国Drager Evita 4) 辅助通气。术后呼吸机参数采用同步间歇指令通气(synchronized intermittent mandatory ventilation, SIMV)模式,氧浓度(FiO2)40%,潮气量8 mL/kg,呼吸频率12~16次/min,呼吸末正压通气(PEEP)5 cmH2O(1 cmH2O=0.098 kPa),支持压力(PS) 10 cmH2O,维持动脉血氧饱和度95%以上。本研究经第二军医大学长征医院伦理委员会审核批准。
1.2 分组方法纳入本研究的所有患者采用简单随机分组,分为右美托咪定组(D组,n=30) 和丙泊酚组(P组,n=30)。将所有患者按照纳入的先后予以编号:01~60(每位患者的编号为两位数),利用Excel软件产生随机数字表,排除相同数字后,按产生的先后次序一一对应患者编号,然后对随机数字进行升序排序,前30者进入D组,后30者进入P组。
1.3 给药方法D组:通过微量注射泵持续静脉注入右美托咪定0.2~0.7 μg/(kg·h)+舒芬太尼0.15 μg/(kg·h);P组:通过微量注射泵持续静脉注入丙泊酚1.2~3.0 mg/(kg·h)+舒芬太尼0.15 μg/(kg·h)。设定镇静目标为维持脑电双频指数(bispectral index, BIS)值70~85和Richmond躁动镇静评分(Richmond agitation-sedation scale, RASS)-2~-3分,根据患者镇静目标对镇静镇痛药物进行剂量调节。
1.4 监测指标应用脉搏指示连续心排血量法(PiCCO)监测心率(heart rate, HR)、平均动脉压(mean arterial pressure, MAP),每2 h行血气分析,关注动脉血乳酸(lactate, Lac)含量。分别于术前(T1)、CPB结束后2 h (T2)、术后4 h (T3)和术后12 h (T4)进行血流动力学测定,指标包括心指数(cardiac index, CI)、全身血管阻力指数(systemic vascular resistance index,SVRI)、每搏输出量(stroke volume,SV)、右心室射血分数(right ventricular ejection fraction, RVEF)、混合静脉血氧饱和度(oxygen saturation of mixed venous blood,SvO2)。记录两组RASS评分及BIS值,累计各血管活性药物应用总量,观察两组镇静期间是否出现心动过缓、MAP下降、躁动或术后谵妄。
1.5 观测方法患者经右颈内静脉置入双腔中心静脉导管,并经床边X线检查证实导管尖端位于上腔静脉内,再置入右颈内静脉鞘管(美国Arrow公司),内置入Swan-Ganz漂浮导管接Vigilance Ⅱ监测系统(美国Edwards Lifesciences公司),联合监护仪(荷兰Philips MP70型)监测血流动力学。心动过缓定义为HR < 60/min或低于术前基础值的30%;MAP下降定义为MAP < 65 mmHg(1 mmHg=0.133 kPa)或低于术前基础值的30%;患者手术结束后入ICU时,由ICU医师对患者进行序贯器官衰竭评估(sequential organ failure assessment, SOFA);RASS评分由责任护士每2~4 h评估1次,根据RASS评分及BIS值调节药物剂量。浅镇静定义为RASS评分-2~-3分,BIS值维持在70~85;深镇静定义为RASS评分-4~-5分,BIS值维持在40~69。谵妄评估采用ICU谵妄评估诊断表(confusion assessment method for the ICU,CAM-ICU),若结果为阳性,再由医师进行鉴别诊断,排除低氧血症、中枢神经系统病变等,判定为谵妄。
1.6 统计学处理应用SPSS 21.0软件进行统计分析。计量资料以x±s表示,组间比较采用t检验;计数资料以频数表示,组间比较采用χ2检验。检验水准(α)为0.05。
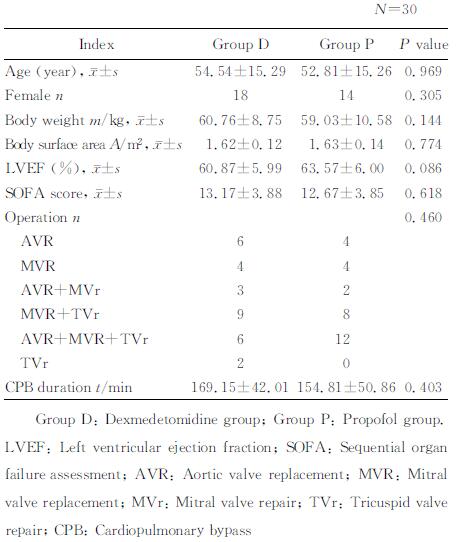
2 结果 2.1 患者一般资料D组平均年龄(54.54±15.29) 岁,男性12例、女性18例; P组平均年龄(52.81±15.26) 岁,男性16例、女性14例。两组年龄、性别、体质量、体表面积、术前LVEF、SOFA评分、手术类型、CPB时间差异无统计学意义(P > 0.05),详见表 1。
|
|
表 1 两组患者一般资料 Tab 1 Baseline characteristics of patients in two groups |
2.2 两组镇静效果比较
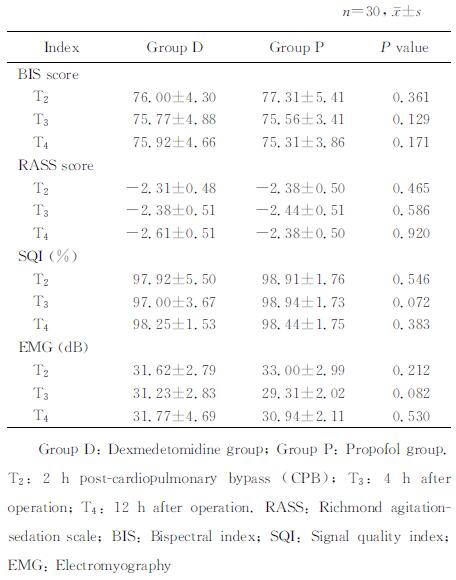
通过调节镇静药物剂量,两组均可维持BIS值为70~85,RASS评分-2~-3分。信号质量指数(signal quality index,SQI)均 > 92%,BIS相关监测指标结果可信,两组BIS值及RASS评分在T2、T3、T4时间点差异无统计学意义(P > 0.05),表明两组患者均取得较好的镇静效果。详见表 2。
|
|
表 2 两组患者镇静指标比较 Tab 2 Comparison of sedative indices of patients in two groups |
2.3 镇静前后两组血流动力学比较
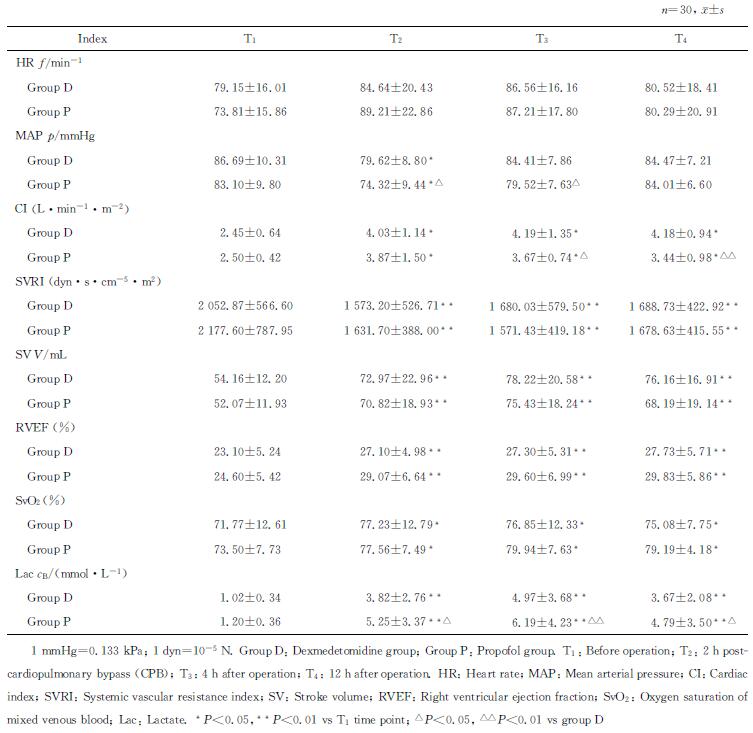
应用镇静药物前(T1时间点),D组与P组患者HR、MAP、CI、SVRI、SV、RVEF、SvO2等各项血流动力学指标差异无统计学意义(P > 0.05)。与T1时间点比较,两组患者在T2时间点的MAP有所下降(P < 0.05), P组较D组下降更为明显,此时P组的MAP值小于D组(P < 0.05)。两组在T2、T3、T4时间点的CI均较T1时间点上升(P < 0.05),在T3、T4时间点,D组CI高于P组(P < 0.05,P < 0.01)。两组在T2、T3、T4时间点动脉血Lac含量均较T1时间点升高(P < 0.01),且P组的动脉血Lac含量较D组升高明显(P < 0.05,P < 0.01)。两组SVRI在T2、T3、T4时间点均较T1时间点降低,但两组间差异均无统计学意义(P > 0.05)。两组SV、RVEF、SvO2在T2、T3、T4时间点均较T1时间点升高(P < 0.05,P < 0.01),但两组间差异均无统计学意义(P > 0.05),详见表 3。
|
|
表 3 两组患者镇静前后血流动力学指标比较 Tab 3 Comparison of hemodynamic parameters of patients in two groups before and after sedation |
2.4 两组血管活性药物用量比较
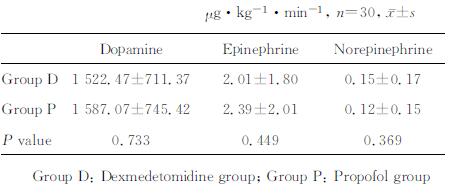
两组患者各血管活性药物用量差异无统计学意义(P > 0.05),见表 4。
|
|
表 4 两组血管活性药物用量比较 Tab 4 Comparison of vasoactive drug dosages in two groups |
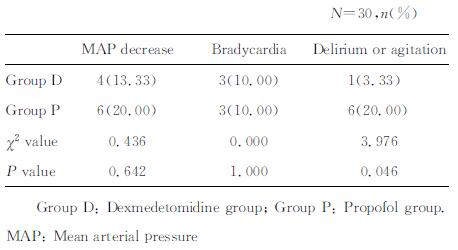
2.5 两组不良事件发生率比较
两组患者在机械通气过程中,在镇静目标范围内MAP下降、心动过缓发生率差异无统计学意义(P > 0.05),D组躁动或谵妄发生率低于P组(P < 0.05),详见表 5。
|
|
表 5 两组不良事件发生率比较 Tab 5 Comparison of the incidence of adverse events in two groups |
3 讨论
心脏瓣膜手术是临床上创伤最大的手术之一,大多数患者术后需进入ICU监护,并需要机械通气辅助呼吸。由于存在各种有创管路、有创操作、外界长时间声光刺激以及患者本身对疾病预后的焦虑等多种因素,心脏瓣膜术后患者常处于强烈的应激环境中。应激可导致交感神经兴奋,可引起人机对抗、HR增快、血压波动、氧耗量增加等。此外应激也可引起患者焦虑、躁动甚至谵妄,严重时可导致意外拔管。因此,心脏术后患者在机械通气情况下严密监护,通过适当的镇静镇痛维持患者于基础代谢状态、维持循环呼吸稳定是非常重要的[9-10]。然而,有文献报道,过度镇静可能因降低呼吸道廓清阻力、抑制循环以及减弱胃肠蠕动等镇静药物的药理作用而对机体产生不良影响,延长患者机械通气时间、ICU停留时间及住院时间[11-14]。因此,2013版美国镇痛、镇静、谵妄指南[15]推荐监护病房应用浅镇静治疗方案使机械通气患者受益。浅镇静是指保留患者语言和触觉,并使其存在有意识的主观反应,而对呼吸循环无抑制的一种镇静状态。本研究遵循指南推荐,运用两种不同的镇静药物制定以浅镇静为目标导向的镇静方案。
α2受体激动剂是目前唯一具有镇静镇痛双重效应的一类药物,代表药物为早期的可乐定和近期的右美托咪定。有研究表明,右美托咪定可兼顾患者的舒适性和浅镇静目标,并强调以患者为中心,保留患者认知功能的长期疗效[16]。目前ICU常用的镇静药物主要是丙泊酚及右美托咪定,但其实两者对于血流动力学有不同的影响,当镇静药物应用于心脏外科术后患者时,此方面需要被重视。丙泊酚具有中度的血管舒张作用,对生命体征不平稳及心功能较差的患者可能会导致临床显著的低血压,同时有引发呼吸抑制的可能[17];右美托咪定是高度特异性的α2肾上腺素受体激动剂,能够降低交感神经活性,减少交感神经冲动的传出和儿茶酚胺的释放,还存在增强心脏迷走神经活动等作用[12, 18]。本研究发现应用右美托咪定和丙泊酚镇静后均能使MAP不同程度地下降,由于心脏瓣膜术后患者常使用临时起搏器,因此未观察到HR明显下降。文献报道镇静后患者心排血量下降[19],而本研究中两组患者CI在T3、T4时间点显著上升,考虑可能由于纳入患者为机械通气 > 12 h、入组患者数量偏少、病情轻重存在差别,因此术后心排血量研究结果较其他研究存在差异。P组患者CI显著低于D组,需考虑与丙泊酚直接抑制心肌收缩力有关,主要机制为丙泊酚可减少心肌肌质网钙离子内流导致收缩力下降以及丙泊酚可使心肌β受体下调而对自身儿茶酚胺类药物不敏感所致。
躁动或谵妄在ICU患者中的发生率高达60%~80%,是重症患者认知功能损害、住院日延长、费用增加和死亡的独立预测因素[20]。以往的镇静多采用苯二氮
右美托咪定常见不良反应为心动过缓、血压降低,多由于注入速度过快导致。本研究采用微量注射泵注入,不仅镇静效果满意,而且尽量避免了相关并发症的发生。本研究中患者心动过缓的发生率未增加,可能由于术后起搏器的应用,而心脏外科术后起搏器的应用较为常见,多数患者都会在术后安置心外膜起搏导线,故此不良反应可以认为是可控的。研究结果还显示MAP下降发生率也未增加,说明右美托咪定的使用是安全的。近期研究也发现右美托咪定在心脏保护方面(如抗缺血再灌注损伤、抗心律失常)具有一定作用,可以降低术后心脏相关并发症的发生率,其抗缺血再灌注损伤作用机制可能通过抑制中枢的交感活性,降低HR,增加氧供,降低氧耗作用[26-27],这一特点尤其适用于心脏术后患者,氧供氧耗方面可作为我们下一步研究的方向。
本研究在评估镇静状态时,采用客观的BIS指标联合主观RASS评分,减少了主观性评分带来的偏差。本研究也存在不足之处如样本量较少,为单中心研究,且未对右美托咪定不同剂量的镇静效果进行评价等,有待进一步研究。
综上所述,右美托咪定和丙泊酚镇静效果确切,与丙泊酚相比,右美托咪定对血压、CI等影响较小,患者躁动或谵妄的发生率较低,可作为心脏瓣膜术后机械通气患者安全、有效的镇静治疗药物。
| [1] | HUFFMYER J L, GROVES D S. Pulmonary complications of cardiopulmonary bypass[J]. Best Pract Res Clin Anaesthesiol, 2015, 29: 163–175. DOI: 10.1016/j.bpa.2015.04.002 |
| [2] | STEPHENS R S, WHITMAN G J. Postoperative critical care of the adult cardiac surgical patient. Part Ⅰ:routine postoperative care[J]. Crit Care Med, 2015, 43: 1477–1497. DOI: 10.1097/CCM.0000000000001059 |
| [3] | HERR D L, SUM-PING S T, ENGLAND M. ICU sedation after coronary artery bypass graft surgery:dexmedetomidine-based versus propofol-based sedation regimens[J]. J Cardiothorac Vasc Anesth, 2003, 17: 576–584. DOI: 10.1016/S1053-0770(03)00200-3 |
| [4] | DJAIANI G, SILVERTON N, FEDORKO L, CARROLL J, STYRA R, RAO V, et al. Dexmedetomidine versus propofol sedation reduces delirium after cardiac surgery:a randomized controlled trial[J]. Anesthesiology, 2016, 124: 362–368. DOI: 10.1097/ALN.0000000000000951 |
| [5] | BEKKER A, STURAITIS M K. Dexmedetomidine for neurological surgery[J]. Neurosurgery, 2005, 57(Suppl 1): 1–10. |
| [6] | GURBET A, BASAGAN-MOGOL E, TURKER G, UGUN F, KAYA F N, OZCAN B. Intraoperative infusion of dexmedetomidine reduces perioperative analgesic requirements[J]. Can J Anesth, 2006, 53: 646–652. DOI: 10.1007/BF03021622 |
| [7] | DEVLIN J W, ROBERTS R J. Pharmacology of commonly used analgesics and sedatives in the ICU:benzodiazepines, propofol, and opioids[J]. Criti Care Clin, 2009, 25: 431–449. DOI: 10.1016/j.ccc.2009.03.003 |
| [8] | BARR J, EGAN T D, SANDOVAL N F, ZOMORODI K, COHANE C, GAMBUS P L, et al. Propofol dosing regimens for ICU sedation based upon an integrated pharmacokinetic-pharmacodynamic model[J]. Anesthesiology, 2001, 95: 324–333. DOI: 10.1097/00000542-200108000-00011 |
| [9] | OSTERMANN M E, KEENAN S P, SEIFERLING R A, SIBBALD W J. Sedation in the intensive care unit:a systematic review[J]. JAMA, 2000, 283: 1451–1459. DOI: 10.1001/jama.283.11.1451 |
| [10] | YOUNG C, KNUDSEN N, HILTON A, REVES J G. Sedation in the intensive care unit[J]. Crit Care Med, 2000, 28: 854–866. DOI: 10.1097/00003246-200003000-00041 |
| [11] | KOLLEF M H, LEVY N T, AHRENS T S, SCHAIFF R, PRENTICE D, SHERMAN G. The use of continuous i.v. sedation is associated with prolongation of mechanical ventilation[J]. Chest, 1998, 114: 541–548. DOI: 10.1378/chest.114.2.541 |
| [12] | KLOMPAS M, LI L, SZUMITA P, KLEINMAN K, MURPHY M V, CDC Prevention Epicenters Program. Associations between different sedatives and ventilator-associated events, length-of-stay, and mortality in mechanically ventilated patients[J]. Chest, 2015, 149: 1373–1379. |
| [13] | RANZANI O T, SIMPSON E S, AUGUSTO T B, CAPPI S B, NORITOMI D T, AMIL Critical Care Group. Evaluation of a minimal sedation protocol using ICU sedative consumption as a monitoring tool:a quality improvement multicenter project[J]. Crit Care, 2014, 18: 580. DOI: 10.1186/s13054-014-0580-3 |
| [14] | 陶然, 陈利群, 吴俊梅, 方芳. 上海市三级甲等医院ICU机械通气患者镇静护理实践的现状调查[J]. 护理学杂志, 2012, 27: 13–16. DOI: 10.3760/cma.j.issn.1673-4351.2012.01.006 |
| [15] | BARR J, FRASER G L, PUNTILLO K, ELY E W, GÉLINAS C, DASTA J, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit:executive summary[J]. Am J Health Syst Pharm, 2013, 70: 53–58. |
| [16] | SHEHABI Y. Early goal directed sedation, a bridge to better clinical outcomes[J]. Chin Med J (Engl), 2014, 127: 1969–1972. |
| [17] | CONTI G, RANIERI V M, COSTA R, GARRATT C, WIGHTON A, SPINAZZOLA G, et al. Effects of dexmedetomidine and propofol on patient-ventilator interaction in difficult-to-wean, mechanically ventilated patients:a prospective, open-label, randomised, multicentre study[J]. Crit Care, 2016, 20: 1–8. |
| [18] | YU S B. Dexmedetomidine sedation in ICU[J]. Korean J Anesthesiol, 2012, 62: 405–411. DOI: 10.4097/kjae.2012.62.5.405 |
| [19] | MARTIN E, RAMSAY G, MANTZ J, SUM-PING S T. The role of the alpha2-adrenoceptor agonist dexmedetomidine in postsurgical sedation in the intensive care unit[J]. J Intensive Care Med, 2003, 18: 29–41. DOI: 10.1177/0885066602239122 |
| [20] | SHEHABI Y, RIKER R R, BOKESCH P M, WISEMANDLE W, SHINTANI A, ELY E W, SEDCOM (Safety and Efficacy of Dexmedetomidine Compared with Midazolam) Study Group. Delirium duration and mortality in lightly sedated, mechanically ventilated intensive care patients[J]. Crit Care Med, 2010, 38: 2311–2318. DOI: 10.1097/CCM.0b013e3181f85759 |
| [21] | 朱成云. 右美托咪定联合氯胺酮用于小儿眼科手术的临床观察[J]. 中国临床新医学, 2014, 7: 39–42. DOI: 10.3969/j.issn.1674-3806.2014.01.14 |
| [22] | 王舜尧, 祝利华. 右美托咪定和咪达唑仑复合芬太尼对ICU术后机械通气患者镇静的影响[J]. 实用药物与临床, 2014, 17: 308–310. |
| [23] | 李志鹏, 柳垂亮. 右美托咪定的临床应用进展[J]. 实用医学杂志, 2013, 29: 3254–3256. DOI: 10.3969/j.issn.1006-5725.2013.19.059 |
| [24] | RIKER R R, SHEHABI Y, BOKESCH P M, CERASO D, WISEMANDLE W, KOURA F, et al. Dexmedetomidine vs midazolam for sedation of critically ill patients:a randomized trial[J]. JAMA, 2009, 301: 489–499. DOI: 10.1001/jama.2009.56 |
| [25] | ZELLER A, ARRAS M, LAZARIS A, JURD R, RUDOLPH U. Distinct molecular targets for the central respiratory and cardiac actions of the general anesthetics etomidate and propofol[J]. FASEB J, 2005, 19: 1677–1679. |
| [26] | 张加强, 张卫. 右美托咪定对心脏瓣膜置换术患者的心肌保护作用[J]. 临床麻醉学杂志, 2014, 30: 426–429. |
| [27] | 涂杰, 梁东科, 韦秋英, 李涛, 何芳, 张炳东. 右美托咪定对窒息型大鼠心肺复苏后心肌损伤的保护作用[J]. 广东医学, 2013, 34: 2454–2457. DOI: 10.3969/j.issn.1001-9448.2013.16.008 |
 2017, Vol. 38
2017, Vol. 38