尿道口癌是女性泌尿生殖系统罕见恶性肿瘤,且大多数尿道口癌都继发于膀胱癌、阴道癌,原发者罕见[1]。原发性女性尿道癌占女性恶性肿瘤的0.02%,约占所有女性泌尿生殖系统肿瘤的1%以下[2~4]。女性尿道癌与男性尿道癌的比例为4:1,是泌尿系肿瘤中唯一的女性多于男性的恶性肿瘤[3]。因国内大部分中老年女性自我查体及体检普及的欠缺,大部分女性患者以局部肿块、出血来院检查,就诊时肿块往往已较大,提高了手术风险及难度。既往对于尿道口肿瘤患者前尿道部分切除的报道主要为尿道口癌行尿道根治性切除加全膀胱切除术/尿流改道术 (尿道切除膀胱永久造瘘、回肠膀胱术、输尿管皮肤造口),手术创伤大,后期生活质量差,很多女性患者不能接受[5],甚至有部分患者为了保留正常控尿放弃手术而选择局部放射治疗。早期尿道癌前尿道切除术后尿失禁发生率高达70%[3]。因女性尿道短,仅30~50 mm,在保留尿道括约肌的同时需要一定长度的功能性尿道,才能达到有效的控尿机制。本研究采用会阴部环形皮瓣修复前尿道,延长功能性尿道,能够提高肿瘤完整切除率,降低尿失禁的发生率,现报告如下。
1 资料和方法 1.1 研究人群纳入2013年1月至2016年1月第二军医大学长海医院收治的女性尿道口早期恶性肿瘤患者29例;年龄32~83岁,平均 (61.4±14.4) 岁。纳入标准:(1) 女性;(2) 临床分期为Ⅰ期,病变局限于尿道的前一半以内,尿道口活检病理报告示恶性肿瘤;(3) 膀胱镜检查示膀胱各壁未见明显异常,肿瘤局限于尿道前1/2段;(4) 静脉肾盂造影未见明显异常;(5) 盆腔CT示肿瘤局限于尿道海绵体,无周围浸润性生长,无盆腔淋巴结肿大。排除标准:(1) 膀胱镜下离膀胱颈2 cm内的尿道肿瘤; (2) 盆腔MRI示尿道全层浸润并伴有尿道周围组织浸润性改变的患者;(3) 有明显髂内外淋巴结肿大的的患者;(4) 尿道尿路癌合并膀胱多发肿瘤需要行全膀胱切除的患者。本研究经第二军医大学长海医院医学伦理委员会同意并批准。
1.2 尿道口癌临床分期尿道口癌临床分期共分4期。Ⅰ期:病变局限于前尿道的一半以内;Ⅱ期:病变侵及全尿道及尿道周围,但未累及阴唇及膀胱颈;Ⅲ期:病变侵及阴唇、阴道黏膜或膀胱颈;Ⅳ期:病变侵及子宫穹隆周围,或发生腹股沟淋巴结、盆腔淋巴结、腹主动脉淋巴结转移及远处转移[6]。
1.3 手术方法根据肿瘤大小 (图 1A)、局部尿道口及尿道前庭之间的距离与侵犯关系,离肿瘤边缘10 mm以上周边距离环状完整游离尿道口,呈隧道样内游离,离肿瘤边缘5 mm处完整切除肿瘤。近心端送冰冻病理,报告切缘为阴性。近心端尿道再游离20 mm切除 (图 1B、1C)。切缘3:00、6:00、9:00、12:00位置用5-0可吸收线性局部固定牵拉。会阴前庭向周围游离环形皮瓣约30~40 mm长,与尿道近心残端内嵌式端端吻合 (图 1D)。缝合完毕留置20号导尿管3周。切除的肿瘤标本送病理检查。根据病理结果,弥漫大B细胞淋巴瘤的患者术后常规化疗;低级别尿路上皮癌的患者术后24 h内即刻灌注丝裂霉素40 mg+50 mL生理盐水1次,高级别膀胱尿路上皮癌患者常规膀胱灌注化疗每周1次连续6次后改为每2周1次连续6次、后续1个月1次维持至1年;恶性黑素瘤如有腹股沟淋巴结肿大者给予淋巴结清扫,如有转移后续需继续行化疗。
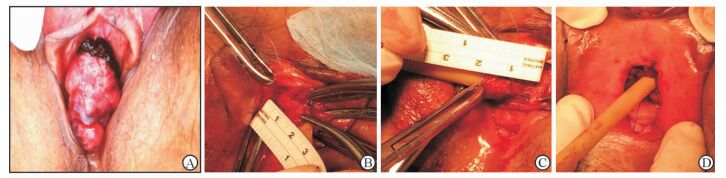
|
图 1 采用会阴环形皮瓣一期吻合修复女性尿道口癌控尿性前尿道缺失 A:尿道口恶性肿瘤,大小约2.5 cm×3 cm;B,C:切除肿瘤后,采用隧道样近心端游离,切除近心端尿道2 cm;D:吻合完成后尿道口创面 |
1.4 随访
术后每3个月定期进行尿道镜+膀胱镜检查,定期复查盆腔CT、胸部CT、肝胆胰脾彩色超声、双侧腹股沟淋巴结彩色超声。2年后改为每半年1次随访复查。随访截止时间为2017年1月。
1.5 统计学处理采用SPSS 21.0软件进行统计学分析。手术前后最大尿流率、平均尿流率、排尿时间、达峰时间、尿流量均呈正态分布,数据用x±s表示,采用配对t检验比较手术前后的差异。检验水准 (α) 为0.05。
2 结果 2.1 手术情况手术时间0.45~1.50 h,平均 (0.51±0.30) h。手术一期成功率为100%,无尿道狭窄、尿失禁等情况发生。术后尿道口形状接近生理结构,排尿通畅,无明显梗阻。所有患者均能很好地控尿 (表 1)。所有患者均未见并发症。切除的肿瘤最大的达到50 mm,小的约20 mm,平均 (32.0±4.7) mm。术后病理结果及手术方式、辅助治疗方法见表 2。
|
|
表 1 手术前后尿流动力学比较 |
|
|
表 2 一期手术后的病理结果 |
2.2 随访结果
术后随访12~48个月,平均 (32.6±3.5) 个月。其中1例尿道口鳞癌患者术后2年出现腹股沟淋巴结转移行髂腹股沟淋巴结清扫 (年龄较大, 故未给行化疗),二次术后1年因弥漫性肺转移于2016年6月死亡;1例鳞癌患者术后13个月腹股沟淋巴结肿大,行髂腹股沟淋巴结清扫,术后病理报告为腹股沟转移性鳞癌。至随访截止时间,其余患者病情控制良好,均未复发、死亡。
3 讨论早期尿道肿瘤全尿道切除尿道重建问题一直是临床面临的棘手问题[7~9]。早在20世纪70年代至80年代初期,有学者尝试使用化学合成材料如硅胶管、聚四氟乙烯材料及透明质酸合成的可降解的支架材料重建尿道,但术后结果均不满意[10]。目前国内外学者均主张原位尿道肿瘤切除,但早期尿道肿瘤切除后行膀胱造瘘术严重影响患者生活质量,而采用保留膀胱颈的膀胱壁肌瓣代尿道手术虽然术后尿失禁并发症报道少,但尿道狭窄并发症时有发生,须定期行尿道扩张术[11]。因此,要减少术后尿道狭窄、移植物挛缩、尿漏、尿道憩室、尿失禁等并发症,改善患者术后生活质量,增加手术成功率,术中、术后各环节的处理都十分重要。既往经验发现,选择合适手术适应证、证实切端为阴性、切取膀胱黏膜大小及厚薄适中、膀胱黏膜袖套状外翻、防止术后感染及尿漏、常规耻骨上膀胱造瘘、使用多侧孔硅胶管作支架及引流等术前、术中及术后各种细节,可以不同程度地减少术后并发症[11]。
本研究首次采用会阴部环形皮瓣修复前尿道、延长功能性尿道,根据29例患者的资料发现,该术式能够增大肿瘤完整切除率,术后所有患者均未出现尿道狭窄及尿失禁,即便是经过较长的随访时间,患者均能很好地控尿。保留膀胱颈端2 cm原始尿道,保证括约肌功能,同时能保证肿瘤切缘。皮瓣移植尿道达到2 cm以上,在保留有效尿道括约肌的前提下保障有效的功能尿道,方能够达到完好控尿。本研究的经验是会阴前庭向周围游离环皮瓣约30~40 mm长,与尿道近心残端内嵌式端端吻合,缝合完毕留置20号导尿管3周防止吻合口瘢痕狭窄。低级别膀胱尿路上皮癌患者术后24 h内即刻灌注丝裂霉素40 mg+50 mL生理盐水1次,高级别膀胱尿路上皮癌患者同样采用丝裂霉素40 mg+50 mL生理盐水、保留40 min的膀胱灌注化疗,每周1次连续6次后改为每2周1次连续6次、后续每个月1次维持至1年。所有患者术后尿道口形状接近生理结构,排尿通畅,最大尿流率12.8~33.0 mL/s,平均 (19.3±8.7) mL/s,较术前均明显改善;一期成功率为100%,术后近、远期均无尿道狭窄、无尿失禁。
女性尿道口淋巴结回流随部位不同而变化,其中虽然可能存在交叉和交通支,但是后尿道淋巴瘤主要回流至髂外、髂内和闭孔淋巴结。前尿道和阴唇淋巴主要回流至浅表淋巴结,然后回流至腹股沟深淋巴结。目前无法预知淋巴结的微转移,故目前国际上无规范性定论是否常规需要行淋巴结清扫。在本研究所收治的尿道口鳞癌病例中,如术前体检或超声发现有腹股沟淋巴结转移的常规给予尿道癌根治性切除术后双侧腹股沟淋巴结清扫,如腹股沟深淋巴结术中冰冻病理发现有转移的患者继而给予一期髂腹股沟淋巴结清扫 (清扫范围包括髂内、髂外、闭孔淋巴结)。12例尿道口鳞癌患者中8例行腹股沟淋巴结清扫,其中4例腹股沟深淋巴结阳性病例行髂腹股沟淋巴结清扫。1例尿道口鳞癌患者术后2年出现腹股沟淋巴结转移行髂腹股沟淋巴结清扫 (年龄较大, 故未行化疗),二次术后1年因弥漫性肺转移于2016年6月死亡;1例鳞癌患者术后13个月腹股沟淋巴结肿大,行髂腹股沟淋巴结清扫,术后病理报告为腹股沟转移性鳞癌。其余目前均无转移及复发。2例恶性黑素瘤患者一期行双侧髂腹股沟淋巴结清扫。所有患者术后均无并发症。这说明根据病理类型判断是否行腹股沟淋巴结清扫可以有效提高生存率。
目前普遍认为尿道括约肌部位尿道上皮为尿路上皮,此处好发尿路上皮癌;中段、前段尿道所附着的黏膜为复层鳞状上皮细胞所覆盖,此处主要以鳞状上皮癌为主[3]。但本研究收治的29例患者中,也发现了8例尿道前段及尿道口的尿路上皮癌,其报道极为罕见。目前病因不明确,需要后续进一步研究证实其发病机制。
综上,本研究发现女性保膀胱控尿性前尿道切除术是治疗早期尿道口癌安全有效的手术方式。鉴于女性原发性尿道癌是一种罕见的泌尿外科疾病,预后较差,本研究病例资料数量有限,因此仍需要更多的病例加入,以便进一步研究此病的病因、治疗及影响预后的因素等。同时需延长随访时间,评估其远期治疗效果。
| [1] | SUI W, ROYCHOUDHURY A, WENSKE S, DECASTRO G J, MCKIERNAN J M, ANDERSON C B. Outcomes and prognostic factors of primary urethral cancer[J]. Urology, 2017, 100: 180–186. DOI: 10.1016/j.urology.2016.09.042 |
| [2] | KURODA N, SHIOTSU T, OHARA M, HIROUCHI T, MIZUNO K, MIYAZAKI E. Female urethral adenocarcinoma with a heterogeneous phenotype[J]. APMIS, 2006, 114: 314–318. DOI: 10.1111/apm.2006.114.issue-4 |
| [3] | MCDOUGAL W S, WEIN A J, KAVOUSSI L R, NOVICK A C. Campbell-Walsh urology 10th edition review[M]. Amsterdam: Elsevier Medicine, 2011. |
| [4] | PONZONE R, BIGLIA N, JACOMUZZI M E, MARIANI L, DOMINGUEZ A, SISMONDI P. Antihormones in prevention and treatment of breast cancer[J]. Ann N Y Acad Sci, 2006, 1089: 143–158. DOI: 10.1196/annals.1386.037 |
| [5] | DIMARCO D S, DIMARCO C S, ZINCKE H, WEBB M J, BASS S E, SLEZAK J M, et al. Surgical treatment for local control of female urethral carcinoma[J]. Urol Oncol, 2004, 22: 404–409. DOI: 10.1016/S1078-1439(03)00174-1 |
| [6] | SRINIVAS V, KHAN S A. Female urethral cancer-an overview[J]. Int Urol Nephrol, 1987, 19: 423–427. DOI: 10.1007/BF02550360 |
| [7] | BERJEAUT R H, PERSAUD M D, SOPKO N, BURNETT A L. Urethral carcinoma in situ:recognition and management[J]. Int Urol Nephrol, 2017, 49: 637–641. DOI: 10.1007/s11255-017-1512-3 |
| [8] | ZINMAN L N, VANNI A J. Management of proximal primary urethral cancer:should multidisciplinary therapy be the gold standard?[J]. Urol Clin North Am, 2016, 43: 505–513. DOI: 10.1016/j.ucl.2016.06.011 |
| [9] | WESSELLS H, ANGERMEIER K W, ELLIOTT S, GONZALEZ C M, KODAMA R, PETERSON A C, et al. Male urethral stricture:American Urological Association Guideline[J]. J Urol, 2017, 197: 182–190. DOI: 10.1016/j.juro.2016.07.087 |
| [10] | KARNES R J, BREAU R H, LIGHTNER D J. Surgery for urethral cancer[J]. Urol Clin North Am, 2010, 37: 445–457. DOI: 10.1016/j.ucl.2010.04.011 |
| [11] | FAIENA I, KOPROWSKI C, TUNUGUNTLA H. Female urethral reconstruction[J]. J Urol, 2016, 195: 557–567. DOI: 10.1016/j.juro.2015.07.124 |
 2017, Vol. 38
2017, Vol. 38


