2. 第二军医大学长海医院中医科, 上海 200433
2. Department of Traditional Chinese Medicine, Changhai Hospital, Second Military Medicine University, Shanghai 200433, China
据统计,乳腺癌发病率已位居女性恶性肿瘤发病率首位[1]。目前认为,乳腺癌的发生是一个多阶段的模式,即“正常细胞→一般增生→不典型增生→癌”的逐渐演变过程[2]。如果能在癌前病变阶段将其阻断,将有助于降低乳腺癌的发病率,意义深远。研究发现乳腺癌前病变的发生与发展和细胞的增殖与凋亡密切相关[3],磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶 (PI3K/Akt) 信号通路参与并促进了肿瘤的侵袭与转移,PI3K、Akt和PTEN (phosphatase and tensin homolog deleted on chromosome ten) 几种功能不同的蛋白均参与了乳腺癌发生、发展的过程,是治疗乳腺癌的重要靶点[4~6]。本课题组结合中医“治未病”的思想,将乳腺癌治疗关口前移,以中药组方消痰解郁方用于治疗乳腺癌前病变,临床效果显著[7],但具体机制不明。本实验拟围绕PI3K/Akt通路,探讨消痰解郁方治疗乳腺癌前病变可能的作用机制和有效靶点,为其提供现代分子生物学依据。
1 材料和方法 1.1 药品与试剂LY294002(PI3K激酶选择性抑制剂),Sigma公司,货号L9908-1MG;CCK-8试剂盒,日本同仁化学研究所;DMEM/F-12培养基、胎牛血清 (FBS),Gibco公司;胰蛋白酶 (Trypsin)、DMSO,Amresco公司;FITC-AnnexinⅤ细胞凋亡检测试剂盒,BD Pharmingen公司;TRIzol试剂为Invitrogen公司产品,其余常规生化试剂均为国产分析纯。乳腺癌癌前病变细胞MCF-10AT由上海舜田生物公司提供。PTEN抗体:Anti-PTEN antibody (Abcam,货号ab31392,兔多抗);PI3K抗体:Anti-PI3K p85 antibody (Abcam,货号ab189403,鼠单抗);p-Akt抗体:Anti-Akt (phospho T308) antibody (Abcam,货号ab38449,兔多抗);β-actin抗体:Anti-β-actin antibody (Abcam,货号ab8226,鼠单抗)。
消痰解郁方浸膏由上海张江药谷药业制备。取制南星、制半夏、山慈菇、柴胡、杭白芍、炒白术、陈皮、茯苓、当归等12味中药,8倍量水提取3次,第1次2 h,后2次各1 h,收集提取液,过滤、浓缩,浓缩液加2倍量乙醇醇沉48 h,取上清液滤过,回收乙醇制得浸膏 (相当于生药材3.35 g/mL)。浸膏加5倍量水,1 200 r/min离心10 min,弃去残渣,上清液过滤,-80 ℃冻干,培养液流通蒸汽灭菌30 min,将浸膏冻干粉溶解其中,0.22 μm微孔滤膜除菌过滤,即得消痰解郁方浸膏保存液,浓度为10 mg/mL (相当于生药材0.22 g/mL)。
1.2 细胞培养分组与药物干预MCF-10AT细胞以含10% FBS的DMEM/F-12培养液培养于37 ℃、5% CO2培养箱,48 h换液传代1次。实验分为消痰解郁方组、PI3K激酶选择性抑制剂LY294002组 (抑制剂组)、消痰解郁方+抑制剂组和对照组。将对数生长期的MCF-10AT细胞按1×104/mL的密度接种到96孔板,每孔接种100 μL。消痰解郁方浓度的确定:加入不同浓度梯度的消痰解郁方处理MCF-10AT细胞,24 h后用CCK-8检测光密度 (D) 值,重复3次,计算消痰解郁方对MCF-10AT细胞的半数抑制浓度 (IC50),得到IC50值 (以生药材计) 为11 mg/mL,确定为本实验消痰解郁方的浓度。抑制剂组LY294002浓度为5 μg/mL。
1.3 CCK-8法检测药物对细胞的抑制率将MCF-10AT细胞调整密度为1×104/mL,接种于96孔板,每孔100 μL,按照分组进行药物干预。细胞培养于37 ℃、5%CO2培养箱,分别于培养24 h及48 h后更换培养液,加入10 μL CCK-8继续培养3 h,于450 nm处检测D值,重复3次。按下式计算细胞抑制率:细胞抑制率 (%)=[1-(实验组D值/对照组D值)]×100%。
1.4 流式细胞术检测细胞周期各组细胞培养至48 h后,加入胰蛋白酶消化,与培养液一起制备细胞悬液,1 000×g、4 ℃离心5 min,弃上清,收集各时间点细胞,分别用预冷的PBS洗2~3次。加碘化丙啶 (PI) 至终浓度为50 mg/L,室温孵育30 min,200目滤网过滤,重复3次,用流式细胞仪测定DNA细胞周期分布。
1.5 蛋白质印迹法检测PI3K、p-Akt、PTEN蛋白表达当细胞生长融合至50%~60%时,向MCF-10AT细胞的培养液加入不同药物,作用48 h,细胞裂解后用BCA法测定蛋白浓度,定量后取等量样本进行SDS-PAGE分离,然后将蛋白转移至PVDF膜上,用5%脱脂奶粉封闭液室温封闭2 h;用封闭液稀释一抗,稀释比1:1 000,4 ℃孵育过夜。TBST洗膜5 min×3次,加入ECL显影液后放入化学发光检测仪中进行检测,将目的蛋白所测值与内参 (β-actin) 相比进行半定量分析。
1.6 统计学处理采用SPSS 19.0软件进行统计学分析。计量资料以x±s表示,多组间均数的比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准 (α) 为0.05。
2 结果 2.1 消痰解郁方对MCF-10AT细胞增殖的影响药物作用24 h后,消痰解郁方组、抑制剂组、消痰解郁方+抑制剂组MCF-10AT细胞的D值分别为0.82±0.03、0.89±0.02、0.55±0.04,3个药物干预组与对照组 (1.68±0.02) 相比均降低,差异有统计学意义 (P<0.05);药物作用48 h后,消痰解郁方组、抑制剂组、消痰解郁方+抑制剂组MCF-10AT细胞的D值分别为0.54±0.02、0.61±0.02、0.36±0.04,3组与对照组 (2.48±0.03) 相比均降低,差异有统计学意义 (P<0.05)。由图 1可见,24 h、48 h时各给药组对细胞均有明显抑制,且48 h时的抑制率高于24 h (P<0.05);消痰解郁方+抑制剂组的细胞增殖抑制率高于消痰解郁方组和抑制剂组 (P<0.05),而消痰解郁方组与抑制剂组对细胞增殖的抑制率差异无统计学意义。
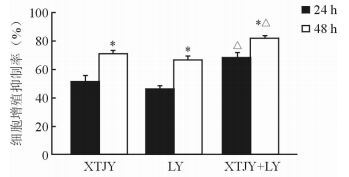
|
图 1 药物干预24 h和48 h各组对MCF-10AT细胞的增殖抑制率 XTJY:消痰解郁方; LY:抑制剂LY294002. *P<0.05与本组24 h比较; △P<0.05与XTJY组和LY组比较.n=3, x±s |
2.2 消痰解郁方对MCF-10AT细胞周期的影响
由图 2可见,与对照组相比,药物作用48 h后消痰解郁方组、抑制剂组、消痰解郁方+抑制剂组的G0/G1期细胞比例升高,S期及G2/M期比例降低,差异有统计学意义 (P<0.05);消痰解郁方+抑制剂组对细胞周期的改变更为明显,与消痰解郁方组和抑制剂组比较差异有统计学意义 (P<0.05)。提示消痰解郁方和抑制剂可导致MCF-10AT细胞在G0/G1期阻滞。
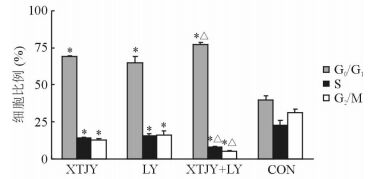
|
图 2 药物干预48 h后各组细胞周期变化 XTJY:消痰解郁方; LY:抑制剂LY294002; CON:对照组. *P<0.05与CON组比较; △P<0.05与XTJY组和LY组比较.n=3, x±s |
2.3 消痰解郁方对MCF-10AT细胞PI3K、p-Akt、PTEN蛋白表达的影响
由图 3可见,与对照组比较,消痰解郁方组、抑制剂组、消痰解郁方+抑制剂组PI3K、p-Akt蛋白表达均减弱,PTEN蛋白表达均增强,差异有统计学意义 (P<0.05);其中消痰解郁方+抑制剂组对PI3K、p-Akt蛋白表达减弱和PTEN蛋白表达增强作用最明显,与抑制剂组和消痰解郁方组相比差异有统计学意义 (P<0.05)。
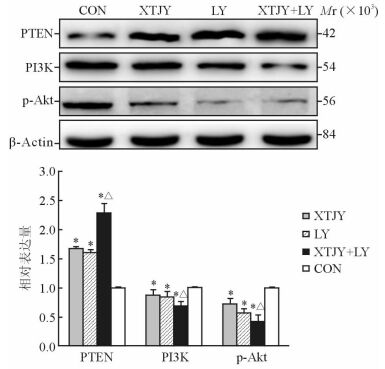
|
图 3 药物干预48 h后各组蛋白相对表达量 CON:对照组; XTJY:消痰解郁方; LY:抑制剂LY294002. *P<0.05与CON组比较; △P<0.05与XTJY组和LY组比较.n=3, x±s |
3 讨论
消痰解郁方是魏品康教授经过多年的临床观察及经验总结确立的经验处方,该方是根据药物功效命名。临床工作发现消痰解郁方可有效治疗乳腺癌前病变,减轻甚至逆转病理状态[7]。初步药效学实验也证明消痰解郁方对S180荷瘤小鼠具有一定的抑瘤作用[8]。本研究用消痰解郁方干预人乳腺癌前病变细胞MCF-10AT,结果发现消痰解郁方能够抑制MCF-10AT细胞增殖,将细胞周期阻滞于G0/G1期而不能进入S期,诱导细胞凋亡,从诱导细胞凋亡和抑制细胞增殖的角度佐证了消痰解郁方在乳腺癌前病变中的治疗作用。
研究发现PI3K-Akt信号通路在乳腺癌中活化高达70%[9]。PI3K-Akt信号通路是调节乳腺癌细胞存活、生长、增殖的主要通路,通过对肿瘤细胞的高度激活,进一步对乳腺癌细胞的生长、增殖起促进作用。在乳腺癌中,这条通路最主要的基因变异体现在PI3K的突变、Akt的磷酸化以及PTEN活性缺失[10~11]。LY294002是应用最早、最广泛的PI3K-Akt信号通路抑制剂,通过竞争性抑制PI3K的ATP结合位点,对Akt磷酸化的过程进行抑制并诱导细胞凋亡[12~13]。
本研究结果显示,消痰解郁方组PI3K、p-Akt蛋白表达均较对照组下降,PTEN蛋白表达上升,说明消痰解郁方对PI3K-Akt信号通路有影响,其作用与PI3K-Akt通路抑制剂LY294002类似。表明消痰解郁方抑制乳腺癌前细胞MCF-10AT的作用机制与PI3K-Akt信号通路密切相关,可能是一种PI3K-Akt信号通路的天然抑制剂。组间比较结果提示:消痰解郁方+抑制剂组对MCF-10AT细胞及细胞内PI3K-Akt通路的抑制作用较消痰解郁方组和抑制剂组强,印证消痰解郁方在与抑制剂联合用药时能更有效地抑制细胞增殖和蛋白表达,提示消痰解郁方可能通过多靶点多通道发挥对癌前病变的治疗作用。我们下一步将通过检测消痰解郁方对PI3K-Akt信号通路下游靶点的影响,进一步探讨消痰解郁方治疗乳腺癌前病变的机制。
| [1] | JEMAL A, BRAY F, CENTER M M, FERLAY J, WARD E, FORMAN D. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61: 69–90. DOI: 10.3322/caac.v61:2 |
| [2] | 北京协和医院. 北京协和医院医疗诊疗常规:乳腺疾病诊疗常规[M]. 北京: 人民卫生出版社, 2012: 18. |
| [3] | 李静蔚, 刘晓菲, 陈宏志. 温阳散结法干预乳腺癌癌前病变MCF-10AT细胞的生长抑制及诱导凋亡研究[J]. 中医药学报, 2013, 41: 41–45. DOI: 10.3969/j.issn.1007-5615.2013.03.025 |
| [4] | 黄秀兰, 崔国辉, 周克元. PI3K-Akt信号通路与肿瘤细胞凋亡关系的研究进展[J]. 癌症, 2008, 27: 331–336. DOI: 10.3321/j.issn:1000-467X.2008.03.022 |
| [5] | 龚晓萌, 王黎明. 乳腺癌组织中PI3K/AKT信号通路相关蛋白表达[J]. 中国组织化学与细胞化学杂志, 2011, 20: 76–79. |
| [6] | 廖明娟, 陈红风. PI3K/Akt/mTOR信号通路抑制剂在乳腺癌中的研究进展[J]. 中华肿瘤防治杂志, 2012, 19: 230–233. |
| [7] | 赵婧, 魏品康. 魏品康运用消痰解郁方治疗乳腺癌前病变经验[J]. 上海中医药杂志, 2015, 49: 15–17. |
| [8] | 修丽娟, 魏品康. 消痰解郁方对小鼠强迫游泳不动时间及S180肉瘤生长的影响[J]. 山东中医药大学学报, 2007, 31: 343–345. DOI: 10.3969/j.issn.1007-659X.2007.04.030 |
| [9] | LÓPEZ-KNOWLES E, O'TOOLE S A, MCNEIL C M, MILLAR E K, QIU M R, CREA P, et al. PI3K pathway activation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality[J]. Int J Cancer, 2010, 126: 1121–1131. DOI: 10.1002/ijc.24831 |
| [10] | WANG L L, HAO S, ZHANG S, GUO L J, HU C Y, ZHANG G, et al. PTEN/PI3K/AKT protein expression is related to clinicopathological features and prognosis in breast cancer with axillary lymph node metastases[J]. Hum Pathol, 2017, 61: 49–57. DOI: 10.1016/j.humpath.2016.07.040 |
| [11] | PATEL L, PASS I, COXON P, DOWNES C P, SMITH S A, MACPHEE C H. Tumor suppressor and anti-inflammatory actions of PPARgamma agonists are mediated via upregulation of PTEN[J]. Curr Biol, 2001, 11: 764–768. DOI: 10.1016/S0960-9822(01)00225-1 |
| [12] | 陈培, 张钦宪. PTEN-PI3K/AKT细胞信号转导通路与肿瘤[J]. 癌变·畸变·突变, 2010, 22: 484–487. DOI: 10.3969/j.issn.1004-616X.2010.06.019 |
| [13] | 种树彬, 杨柳. 乳腺癌癌前病变的癌变机制研究进展[J]. 现代中西医结合杂志, 2007, 16: 3758–3759. DOI: 10.3969/j.issn.1008-8849.2007.25.132 |
 2017, Vol. 38
2017, Vol. 38


