2. 浙江嘉兴学院医学院药学系, 嘉兴 314001;
3. 第二军医大学海军医学系放射医学教研室, 上海 200433
2. Department of Pharmacy, College of Medicine, Jiaxing University, Jiaxing 314001, Zhejiang, China;
3. Department of Radiation Medicine, Faculty of Naval Medicine, Second Military Medical University, Shanghai 200433, China
乳腺癌是女性恶性肿瘤死亡威胁的第二大元凶,需耗费巨额的人力、物力、财力用于乳腺癌治疗的研究[1]。研发一种新的乳腺癌药物,平均要花费6.1亿美元,还要进行为期37个月的动物实验[2]。因此,研究者们前期会应用乳腺癌动物模型来筛选有效的治疗方法,以期为后续的临床试验提供强有力的保证。即便如此,很多在动物模型上有效的治疗方法在临床患者身上并不是很有效[3~4]。目前最大的挑战在于用于乳腺癌药物研发的动物模型要能更有效地诱发癌变,并对结果解释产生较少的混杂变量,这就要求乳腺癌动物模型要尽可能地模拟人乳腺癌发生发展的过程[5~6]。
常见的乳腺癌动物模型主要包括自发癌模型、化学诱癌模型以及移植瘤模型。随着转基因小鼠及胚胎干细胞技术的发展,自发癌模型的应用越来越广泛,此类模型通过人为改变小鼠的基因组而使得相关基因异常表达,从而影响相关癌变的发生与发展。人类表皮生长因子受体2 (human epidermal growth factor receptor-2,Her2) 基因定位于染色体17q12-21.32上,编码相对分子质量为185 000的跨膜受体样蛋白,具有酪氨酸激酶活性。在人类上皮来源的许多肿瘤如乳腺癌、卵巢癌和胃癌等肿瘤细胞中,Her2基因常异常扩增或过表达, Her2的表达水平与肿瘤的发生、发展及预后有密切关系[7]。免疫组化染色发现,乳腺癌细胞的Her2蛋白水平比邻近正常乳腺上皮高10~100倍[8]。鉴于Her2阳性乳腺癌对人类健康的严重危害,有必要进行更多有益的病理机制及治疗方法探讨。因此,建立人源Her2高表达乳腺癌动物模型,对探讨Her2高表达对肿瘤发病的促进作用机制、在活体动物水平评价针对性治疗措施的有效性 (如特异性Her2靶向治疗的单克隆抗体药物的评价[9]) 具有一定意义。
1 材料和方法 1.1 实验动物及主要试剂4周龄SPF级C57BL/6J小鼠购于南京生物医药研究院[动物生产许可证号:SCXK (苏)2015-0001],饲养至实验所需周龄。所有实验动物均在SPF级动物房饲养和繁殖。温度控制在22 ℃,湿度70%,自动光控 (12 h明/12 h暗),自由采食和饮水。
制备转基因小鼠的相关试剂均购自南京生物医药研究院,质粒提取试剂盒购于北京天根生化,胶回收试剂盒购于Promega,核酸内切酶为NEB产品,PCR引物合成及测序由Invitrogen公司完成,PCR相关试剂购自TaKaRa公司。HPR标记山羊抗兔IgG、BCA蛋白定量试剂盒均购自上海碧云天生物技术有限公司。Kodak BioMax MR X线片来自Kodak公司。Her2兔单克隆抗体为CST公司产品,按1:1 000稀释。其他常用试剂均属于国产或进口的分析纯试剂。
1.2 pMD18T-MMTV-huHER2-EGFP重组质粒的构建与鉴定提取MMTV-Cre鼠尾部组织DNA,以其为模板扩增MMTV启动子序列;以pENTR23.1-ERBB2质粒为模板扩增huHERP2 CDS片段;以pCAG-Cre-EGFP质粒为模板扩增EGFP序列;以pMD18-T为模板扩增pMD18-T骨架序列,将以上片段SLIC连接,构建的载体为pMD18T-MMTV-huHER2-EGFP。测序验证无突变后用Xho Ⅰ与Xba Ⅰ双酶切pMD18T-MMTV-huHER2-EGFP,克隆至pInsulator工具质粒,挑取抗Amp的阳性克隆扩增后,提取质粒进行PCR和测序验证。
1.3 Her2转基因小鼠的制备选取7~8周龄雌性C57BL/6J小鼠作为供体,与同种雄鼠合笼;另取数只2个月龄以上的母鼠作为受体,与经过输精管结扎的雄鼠合笼,形成假孕母鼠。有精栓者手术取出输卵管,进而取出受精卵,培养后用注射针把转基因载体分别移入受精卵,然后将卵巢连同输卵管放回供体鼠腹腔。加强受体母鼠及其后代子鼠的日常饲养管理。
1.4 PCR鉴定Her2转基因小鼠的基因型新生鼠2周龄时取尾部组织 (约5 mm) 常规方法提取组织DNA,用PCR对Her2片段进行检测;选取检测阳性的小鼠与野生型C57BL/6J小鼠交配传代,子代经同法检测并再传代。检测5′端正向引物序列为5′-CGG TTC CCA GGG CTT AAG TAA G-3′,反向引物序列为5′-TTG GTG GGC AGG TAG GTG AGT T-3′;检测3′端正向引物序列为5′-ACT ACC TGA GCA CCC AGT CC-3′,反向引物序列为5′-GTG GTA TTT GTG AGC CAG GGC AT-3′。PCR扩增条件:95 ℃预变性5 min;然后98 ℃变性30 s、65 ℃复性30 s、72 ℃延伸40 s,进行30个循环;72 ℃延伸10 min。
1.5 蛋白质免疫印迹检测Her2的表达在4 ℃条件下,取6周龄鼠乳腺组织,加入裂解液提取Her2蛋白,用BCA蛋白定量试剂盒测定样品蛋白含量。每个样本取10 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至PVDF膜上,用5%脱脂奶粉封闭液室温下置摇床上封闭1 h,再用TBST稀释的羊抗兔源重组的Her2单克隆抗体 (1:1 000稀释)4 ℃摇床杂交过夜;待恢复室温后,TBST洗3次,每次10 min,置入TBST稀释的辣根过氧化物酶标记的羊抗小鼠抗体 (1:5 000稀释) 室温杂交1 h,洗3次,每次10 min。将膜置于化学发光液中,X线胶片曝光、显影及定影。
1.6 病理学观察选取12周龄未生育、12周龄已生育、16周龄未生育及25周龄未生育的Her2阳性小鼠,颈椎脱臼法处死,进行详细尸体解剖检查。对乳腺取材,经Bouns’液固定,常规石蜡包埋、切片,H-E染色,镜检。
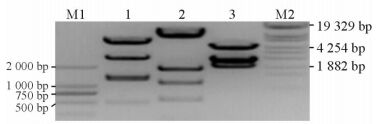
2 结果 2.1 重组质粒pMD18T-MMTV-huHER2-EGFP的构建与酶切鉴定、序列分析重组质粒分别经Xho Ⅰ与Xba Ⅰ双酶切后,将目的基因Her2插入双酶切位点之间 (图 1)。1%琼脂糖凝胶电泳分离均可见2个片段,酶切产物长684 bp。重组质粒经ApaL Ⅰ、BamH Ⅰ、Sca Ⅰ酶切,经琼脂糖凝胶电泳验证与预期结果一致 (图 2)。GenBank BLAST分析显示,重组质粒目的基因测序结果与GenBank已报道序列完全一致。

|
图 1 Her2真核表达载体的构建示意图 Fig 1 Structure of pMD18T-MMTV-huHER2-EGFP vector |
|
图 2 重组pMD18T-MMTV-huHER2-EGFP质粒的PCR鉴定结果 Fig 2 Identification of the recombinant plasmid pMD18T-MMTV-huHER2-EGFP by PCR M1: Marker DL 2000; 1, 2, 3: pMD18T-MMTV-huHER2-EGFP cleaved by ApaL Ⅰ, BamH Ⅰand Sca Ⅰ, respectively; M2: Marker T14 |
2.2 首建鼠及子代小鼠的PCR鉴定
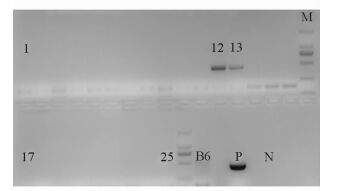
将带有包装质粒的受精卵植入代孕母鼠后,分娩得到60只小鼠,部分PCR鉴定结果如图 3所示。结果显示Her2基因片段已经成功插入小鼠的基因组内,经测序后验证基因序列与原序列吻合,并得到9只Her2高表达首建小鼠。9只首建鼠分别与野生型小鼠交配,继续传代。经过4代筛选,筛选出了1个子代阳性率在40%左右且能稳定遗传的转基因小鼠系。
|
图 3 Her2高表达转基因首建小鼠的PCR检测结果 Fig 3 PCR results of Founder transgenic mice with Her2 overexpression PCR detection results of Number 1-25 mice. B6: Her2 transgenic mice (-); P: Positive control group; N: Negative control group; 12 and 13: Her2 transgenic mice (+); M: DNA Ladder |
2.3 蛋白质免疫印迹检测Her2的表达
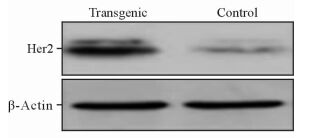
F2代6周龄转基因小鼠的乳腺组织中Her2蛋白的表达量高于对照组的野生型小鼠 (图 4)。
|
图 4 蛋白质免疫印迹检测Her2蛋白在乳腺组织的表达 Fig 4 Expression of Her2 protein in breast tissue of control and transgenic mice by Western blotting |
2.4 人源Her2阳性转基因小鼠乳腺组织病理变化观察
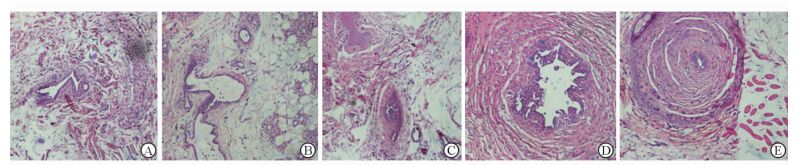
小鼠乳腺癌的发生与其生长发育的不同阶段存在一定关联。因此本研究选取了12周龄已生育、12周龄未生育、16周龄未生育和25周龄未生育Her2阳性转基因小鼠作为观察对象,另选12周龄野生型对照鼠作为阴性对照 (图 5A),每组小鼠数目为3只。其中12周龄已生育小鼠乳腺导管扩张明显,结缔组织中有异常细胞,乳腺增生明显 (图 5B);12及16周龄未生育小鼠有乳腺增生 (图 5C、5D);25周龄未生育小鼠乳腺增生明显,且出现异型细胞,有癌变倾向 (图 5E)。结果说明本项目构建的Her2转基因小鼠能够在25周左右自发产生乳腺癌癌变倾向,初步说明本研究成功构建乳腺癌动物模型。
|
图 5 转基因小鼠乳腺组织的病理变化观察 Fig 5 Pathological changes of breast tissue in transgenic mice A: Control mice of 12 weeks old; B: Transgenic mice of 12 weeks old which has been given birth; C: Transgenic mice of 12 weeks old which has not been given birth; D: Transgenic mice of 16 weeks old which has not been given birth; E: Transgenic mice of 25 weeks old which has not been given birth. Original magnification: ×100 |
3 讨论
乳腺癌依据分子标志物的不同分为4种分子亚型:Luminal A型、Luminal B型、Her-2过表达型和三阴型[10]。Her-2型乳腺癌在临床上约占20%~30%,虽然比例不是最高,但由于Her-2原癌基因多拷贝的性质使得该型肿瘤患者有生存率低、恶性程度高、病情发展迅速、易复发和临床预后较差的特点,因此被称为“最危险的乳腺癌”[11~12]。选择和研究Her2阳性乳腺癌小鼠模型能更为真实地反映药物作用对疾病影响,从而探讨药物作用的分子机制,为临床研究提供借鉴依据。
本实验以人源Her2为靶基因,成功构建了携带乳腺组织特异性启动子的pMD18T-MMTV-huHER2-EGFP打靶载体,通过显微注射技术建立了人源Her2高表达转基因小鼠。获得9只转基因首建小鼠,将这些小鼠与C57BL/6J野生型小鼠交配产生F1代转基因小鼠。PCR检测结果显示Her2基因片段已经成功插入小鼠的基因组内。本研究取材6周龄的小鼠乳腺组织用于蛋白质免疫印迹检测,结果显示Her2阳性小鼠Her2蛋白的表达量高于野生型小鼠。另外,本研究还分别取材12周龄未生育、12周龄已生育、16周龄未生育及25周龄未生育的Her2阳性小鼠乳腺组织做病理切片,结果显示12周龄已生育及25周龄未生育转基因阳性小鼠的乳腺均发生明显的癌变。根据癌变程度,初步推测乳腺癌的产生与小鼠乳腺的发育周期及生育因素密切相关,有待进一步深入研究。
Leder实验室创建了第一个在小鼠乳腺肿瘤病毒 (mouse mammary tumor virus,MMTV) 驱动下表达Neu基因的ERBB2转基因乳腺癌模型MMTV-NEU-NT[13]。Neu基因和Her2基因序列相似性达到80%以上,其基因编码产物的氨基酸排列的相似性达到85%以上,鉴于Her2与Neu高度同源,目前国际上广泛使用的乳腺癌动物模型多是选择高表达鼠源Neu基因,带有Neu乳腺癌原癌基因的母鼠会在8个月左右发生原发性的乳腺肿瘤[14~15]。本研究所构建的人源Her2高表达转基因小鼠是以人源Her2基因为靶基因,是对目前广泛使用的鼠源Neu基因乳腺癌的进一步优化,对Her2阳性乳腺癌发生机制和Her2阳性乳腺癌靶向治疗药物开发具有十分重要的意义。
| [1] | BODAI B I, TUSO P. Breast cancer survivorship:a comprehensive review of long-term medical issues and lifestyle recommendations[J]. Perm J, 2015, 19: 48–79. |
| [2] | LIGHT D W. Global drug discovery:Europe is ahead[J]. Health Aff (Millwood), 2009, 28: w969–w977. DOI: 10.1377/hlthaff.28.5.w969 |
| [3] | SCHUH J C. Trials, tribulations, and trends in tumor modeling in mice[J]. Toxicol Pathol, 2004, 32(Suppl 1): 53–66. |
| [4] | JOHNSON J I, DECKER S, ZAHAREVITZ D, RUBINSTEIN L V, VENDITTI J M, SCHEPARTZ S, et al. Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials[J]. Br J Cancer, 2001, 84: 1424–1431. DOI: 10.1054/bjoc.2001.1796 |
| [5] | TALMADGE J E, SINGH R K, FIDLER I J, RAZ A. Murine models to evaluate novel and conventional therapeutic strategies for cancer[J]. Am J Pathol, 2007, 170: 793–804. DOI: 10.2353/ajpath.2007.060929 |
| [6] | CORBETT T, POLIN L, LORUSSO P, VALERIOTE F, PANCHAPOR C, PUGH S, et al. In vivo methods for screening and preclinical testing[M]//Teicher B A. Anticancer drug development guide:preclinical screening, clinical trials, and approval. Totowa, NJ:Humana Press Inc, 1998:99-123. |
| [7] | CADOO K A, FORNIER M N, MORRIS P G. Biological subtypes of breast cancer:current concepts and implications for patterns[J]. Q J Nucl Med Mol Imaging, 2013, 57: 312–321. |
| [8] | MOREY A L, BROWN B, FARSHID G, FOX S B, FRANCIS G D, MCCUE G, et al. Determining HER2(ERBB2) amplification status in women with breast cancer:final results from the Australian in situ hybridisation program[J]. Pathology, 2016, 48: 535–542. DOI: 10.1016/j.pathol.2016.05.007 |
| [9] | BECHMANN T, MADSEN J S, BRANDSLUND I, LUND E D, ORMSTRUP T, HUGGER E, et al. Predicting brain metastases of breast cancer based on serum S100B and serum HER2[J]. Oncol Lett, 2013, 6: 1265–1270. |
| [10] | 宫国良, 陈静宁, 刘晓雨, 刘志军. β-Atenin、GSK-3β在不同分子分型乳腺癌中的表达及意义[J]. 齐齐哈尔医学院学报, 2015, 36: 1252–1255. |
| [11] | NUNES R A, HARRIS L N. The HER2 extracellular domain as a prognostic and predictive factor in breast cancer[J]. Clin Breast Cancer, 2002, 3: 125–135. DOI: 10.3816/CBC.2002.n.017 |
| [12] | 吴雪卿, 万华, 李欣荣, 冯佳梅, 姜晓燕, 瞿文超, 等. 乳癌术后方对HER2/neu转基因小鼠乳腺癌发生中免疫应答的影响[J]. 中国中西医结合杂志, 2010, 30: 717–719. |
| [13] | MULLER W J, SINN E, PATTENGALE P K, WALLACE R, LEDER P. Single-step induction of mammary adenocarcinoma in transgenic mice bearing the activated c-neu oncogene[J]. Cell, 1988, 54: 105–115. DOI: 10.1016/0092-8674(88)90184-5 |
| [14] | WANG C, SCHWAB L P, FAN M, SEAGROVES T N, BUOLAMWINI J K. Chemoprevention activity of dipyridamole in the MMTV-PyMT transgenic mouse model of breast cancer[J]. Cancer Prev Res (Phila), 2013, 6: 437–447. DOI: 10.1158/1940-6207.CAPR-12-0345 |
| [15] | KNUTSON K L, ALMAND B, DANG Y, DISIS M L. Neu antigen-negative variants can be generated after neu-specific antibody therapy in neu transgenic mice[J]. Cancer Res, 2004, 64: 1146–1151. DOI: 10.1158/0008-5472.CAN-03-0173 |
 2017, Vol. 38
2017, Vol. 38


