2. 中韩生物医学工程中心, 上海 201802;
3. 第二军医大学药学院有机化学教研室, 上海 200433
2. China-South Korea Biomedical Engineering Center, Shanghai 201802, China;
3. Department of Organic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
骨质疏松症是以骨量减少、骨组织微细结构破坏为特征,伴骨脆性和骨折危险性增加的一种全身性骨骼疾病。骨质疏松症在绝经后的老年女性人群中高发,绝经后骨质疏松症的防治是临床医师面临的重要问题。以往研究表明,Wnt信号通路对骨代谢的调节作用具有重要影响,对骨的维持和修复至关重要[1-2]。β-链蛋白 (β-catenin) 是经典Wnt通路的重要成员,早期成骨细胞的增殖分化和破骨细胞的抑制都需要β-catenin的参与,β-catenin的积聚可促进骨生成。绝经后骨质疏松症患者血清β-catenin水平显著低于正常人群[3],因此通过Wnt信号通路对β-catenin进行精密的调控有望成为治疗绝经后骨质疏松症的一种新策略。
靶向Axin蛋白-β-catenin复合物的α螺旋订书肽 (SAHPA1) 是一种新型调控β-catenin水平的药物[4]。SAHPA1具有稳定的α螺旋结构,与靶标的结合能力能够提高上千倍,通过与β-catenin的结合可以有效地打破内源的Axin蛋白-β-catenin复合物的生成,提高β-catenin水平。体外实验表明SAHPA1可以高度特异性地激活Wnt/β-catenin信号通路[4]。鉴于此,我们认为SAHPA1有望成为治疗骨质疏松症的药物,但相关动物体内实验尚未见报道。本研究通过建立绝经后骨质疏松症动物模型,评估SAHPA1对绝经后骨质疏松症的治疗效果。
1 材料和方法 1.1 实验动物和模型建立8周龄雌性C57小鼠15只,购自上海斯莱克实验动物有限公司[实验动物生产许可证号:SCXK (沪)2012-0002]。将小鼠随机分为3组,分别为假手术组、骨质疏松模型组 (模型组)、骨质疏松模型治疗组 (治疗组),每组5只。假手术组仅实施手术暴露卵巢后缝合切口;模型组和治疗组经背部切口分离暴露出双侧卵巢,切除后缝合切口,建立去卵巢骨质疏松小鼠模型。治疗组在切除卵巢后即刻开始每日肌注SAHPA1(由第二军医大学药学院胡宏岗课题组参照文献[4]方法合成),剂量为10 mg/kg;假手术组和模型组每日肌注同等剂量的生理盐水。连续处理8周。动物饲养于SPF级动物实验室,温度22~25 ℃,相对湿度40%~70%,自动光控 (12 h明/12 h暗),自由采食、饮水。
1.2 骨质疏松监测指标实验后8周将小鼠处死,取股骨行骨组织切片,H-E染色鉴定骨组织形态。同时取小鼠股骨进行micro-CT扫描测定骨形态计量学参数。
1.2.1 骨组织学检测剔除小鼠后肢骨附着软组织,经4%多聚甲醛固定、EDTA脱钙、冲洗、梯度乙醇脱水后常规石蜡包埋,做5 μm厚的连续切片。取股骨远端干骺端的骨组织切片,经H-E染色后,在普通光学显微镜下观察。
1.2.2 Micro-CT检测小鼠处死后剥离后肢骨,剔除附着软组织,经4%多聚甲醛固定后,于SCANCO Medical micro-CT (SCANCO Medical AG, Switzerland) 进行扫描,预装64位图像处理软件行三维重建并进行骨组织形态计量学分析。
1.3 统计学处理应用SPSS 15.0软件进行统计学分析。计量资料结果用x±s表示,采用方差分析和LSD-t检验比较组间差异。检验水准 (α) 为0.05。
2 结果 2.1 各组小鼠股骨H-E染色形态学观察股骨远端干骺端的骨组织切片经H-E染色后,在光镜下观察骨组织形态。可见与假手术组相比,模型组小鼠骨小梁数量明显减少,小梁厚度较薄,而骨小梁间隙增宽,骨髓中可见较多的脂肪组织。治疗组小鼠的骨小梁数目和厚度均较模型组有所增加,脂肪组织有所减少,但与假手术组相比仍有一定差距 (图 1)。

|
图 1 各组小鼠股骨干骺端组织切片的H-E染色结果 Original magnification: ×10 |
2.2 各组小鼠股骨micro-CT扫描计量学参数
取小鼠后肢股骨进行micro-CT扫描。股骨远端三维重建图像显示模型组小鼠骨小梁数目明显少于假手术组,小梁间隙增加。而治疗组小鼠的骨小梁数目及间隙与模型组相比均有一定改善,但相比假手术组仍有一定差异 (图 2)。
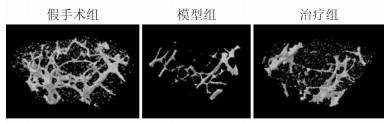
|
图 2 各组小鼠股骨骨小梁的micro-CT三维重建图像 |
骨组织形态计量学相关分析结果如表 1所示。模型组小鼠骨小梁厚度 (Tb.Th)、骨小梁数量 (Tb.N) 以及骨密度 (BMD) 与假手术组相比明显降低,差异有统计学意义 (P < 0.05)。治疗组小鼠骨小梁数量以及骨密度与模型组相比有明显提升 (P < 0.05),但与假手术组相比仍有显著差距 (P < 0.05);骨小梁厚度也得到一定的提升,但与模型组和假手术组相比差异均无统计学意义 (P > 0.05)。
|
|
表 1 各组小鼠股骨计量学参数 |
3 讨论
绝经后骨质疏松症是最常见的一种继发性骨质疏松症,老年女性由于雌激素缺乏导致骨量减少及骨组织结构变化,使骨脆性增高易于骨折。研究表明,成体骨组织处于骨重建的平衡之中,即成骨细胞介导的新骨形成和破骨细胞介导的骨吸收[5]之间处于相对平衡的状态。雌激素与骨代谢有着密切的联系,它能帮助钙的吸收,对骨生成产生直接作用,使骨吸收和重建达到平衡,老年女性由于雌激素缺乏,从而使得骨重建平衡被破坏[6-7]。补充雌激素有助于预防骨质疏松,但雌激素不良反应多,且可能会增加妇科疾病和乳腺癌的发病风险,因此人们在尝试探寻其他治疗绝经后骨质疏松症的途径。
经典的Wnt/β-catenin信号通路激活后,能够有效促进新骨形成[1]。前期研究中发现绝经后骨质疏松患者的血清β-catenin水平显著降低[3]。而另一项体外研究发现,对体外培养的去卵巢大鼠间充质干细胞给予雌激素作用后,能够有效增加β-catenin表达,间充质干细胞的成骨分化能力得到了恢复[8]。推测雌激素增加间充质干细胞成骨能力的过程与β-catenin水平有关,提示激活该通路可能成为治疗绝经后骨质疏松的策略之一。
既往的体外实验已明确SAHPA1能够特异性地激活体内的Wnt/β-catenin信号通路[4]。本研究通过骨组织学检测来评价SAHPA1对去卵巢骨质疏松小鼠的治疗效果。结果发现模型小鼠在接受SAHPA1治疗8周后能有效缓解骨丢失症状,表现为骨小梁数目和骨密度有所增加,以及骨小梁厚度也相对增加。并且H-E染色还发现模型组小鼠骨髓出现大量脂肪化现象,与临床观察结果[9]一致,但SAHPA1处理后骨髓脂肪组织明显减少。这些结果说明SAHPA1激活的Wnt/β-catenin信号通路能够有效改善绝经后骨质疏松症的临床表现,缓解骨丢失,抑制骨髓脂肪化。Micro-CT测定结果显示SAHPA1治疗组小鼠的骨小梁数量和骨密度等虽然得到明显改善,但与假手术组相比仍有差距,说明肌注SAHPA1尚不能完全将骨丢失恢复到正常水平。因此,虽然SAHPA1激活的Wnt/β-catenin信号通路能有效缓解激素抑制的成骨分化、促进新骨形成,但未能完全恢复新骨形成的能力,推测可能是由于Wnt/β-catenin信号通路并非唯一影响绝经后骨质疏松的信号通路,SAHPA1只能部分改善绝经后骨质疏松症。已有大量文献证实除Wnt/β-catenin信号通路以外,MAPK[10]、PI3K/Akt[11]、RANKL/RANK/OPG[12]、Hedgehog[13]和Notch[14]等信号通路均在骨质疏松的发病机制中起着重要调节作用,因此理论上SAHPA1难以完全抑制骨质疏松症的发生。另一方面,SAHPA1作为一种新型的多肽类药物,前期只进行了细胞实验[4],使用剂量在本动物实验开展时缺乏可供借鉴的经验。为检验药物的有效性,我们参考了临床和文献中其他多肽类药物的使用剂量,选择了10 mg/kg这一我们认为较大的剂量,未设置其他剂量分组。对于SAHPA1的剂量相关的药效作用,还有待进一步的工作探索。
本研究证实SAHPA1激活的Wnt/β-catenin信号通路能有效促进新骨形成、缓解骨丢失,但在不高于10 mg/kg的剂量下不能完全抑制去卵巢小鼠骨质疏松的发生。SAHPA1促进体内新骨形成的机制及对绝经后骨质疏松症的防治作用有待于进一步研究。
| [1] | KARNER C M, LONG F. Wnt signaling and cellular metabolism in osteoblasts[J]. Cell Mol Life Sci, 2017, 74: 1649–1657. DOI: 10.1007/s00018-016-2425-5 |
| [2] |
陈晓, 苏佳灿. 骨质疏松研究热点:骨髓间充质干细胞分化命运[J]. 第二军医大学学报, 2017, 38: 397–404.
CHEN X, SU J C. New focus on osteoporosis: differentiation fate of bone marrow-derived mesenchymal stem cells[J]. Acad J Sec Mil Med Univ, 2017, 38: 397–404. |
| [3] | XU X J, SHEN L, YANG Y P, ZHU R, SHUAI B, LI C G, et al. Serum β-catenin levels associated with the ratio of rankl/opg in patients with postmenopausal osteoporosis[J]. Int J Endocrinol, 2013, 2013: 534352. DOI: 10.1155/2013/534352.22 |
| [4] | CUI H K, ZHAO B, LI Y, GUO Y, HU H, LIU L, et al. Design of stapled α-helical peptides to specifically activate Wnt/β-catenin signaling[J]. Cell Res, 2013, 23: 581–584. DOI: 10.1038/cr.2013.30 |
| [5] | ABDELGAWAD M E, DELAISSE J M, HINGE M, JENSEN P R, ALNAIMI R W, ROLIGHED L, et al. Early reversal cells in adult human bone remodeling: osteoblastic nature, catabolic functions and interactions with osteoclasts[J]. Histochem Cell Biol, 2016, 145: 603–615. DOI: 10.1007/s00418-016-1414-y |
| [6] | ERIKSEN E F, HODGSON S F, EASTELL R, CEDEL S L, O'FALLON W M, RIGGS B L. Cancellous bone remodeling in type Ⅰ (postmenopausal) osteoporosis: quantitative assessment of rates of formation, resorption, and bone loss at tissue and cellular levels[J]. J Bone Miner Res, 1990, 5: 311–319. DOI: 10.1002/jbmr.5650050402 |
| [7] | XIAO W, LI S, PACIOS S, WANG Y, GRAVES D T. Bone remodeling under pathological conditions[J]. Front Oral Biol, 2016, 18: 17–27. |
| [8] | LI L, YAO X L, HE X L, LIU X J, WU W C, KUANG W, et al. Role of mechanical strain and estrogen in modulating osteogenic differentiation of mesenchymal stem cells (MSCs) from normal and ovariectomized rats[J]. Cell Mol Biol (Noisy-le-grand), 2013(Suppl 59): OL1889–OL1893. |
| [9] | AGRAWAL K, AGARWAL Y, CHOPRA R K, BATRA A, CHANDRA R, THUKRAL B B. Evaluation of MR spectroscopy and diffusion-weighted mri in postmenopausal bone strength[J]. Cureus, 2015, 7: e327. DOI: 10.7759/cureus.327 |
| [10] | CHOI S W, PARK K I, YEON J T, RYU B J, KIM K J, KIM S H. Anti-osteoclastogenic activity of matairesinol via suppression of p38/ERK-NFATc1 signaling axis[J]. BMC Complement Altern Med, 2014, 14: 35. DOI: 10.1186/1472-6882-14-35 |
| [11] | LIU Y, KOU X, CHEN C, YU W, SU Y, KIM Y, et al. Chronic high dose alcohol induces osteopenia via activation of mTOR signaling in bone marrow mesenchymal stem cells[J]. Stem Cells, 2016, 34: 2157–2168. DOI: 10.1002/stem.2392 |
| [12] | WOLSKI H, DREWS K, BOGACZ A, KAMIŃSKI A, BARLIK M, BARTKOWIAK-WIECZOREK J, et al. The RANKL/RANK/OPG signal trail: significance of genetic polymorphisms in the etiology of postmenopausal osteoporosis[J]. Ginekol Pol, 2016, 87: 347–352. DOI: 10.5603/GP.2016.0014 |
| [13] | NAKAMURA T, NARUSE M, CHIBA Y, KOMORI T, SASAKI K, IWAMOTO M, et al. Novel hedgehog agonists promote osteoblast differentiation in mesenchymal stem cells[J]. J Cell Physiol, 2015, 230: 922–929. DOI: 10.1002/jcp.24823 |
| [14] | ZANOTTI S, CANALIS E. Notch signaling in skeletal health and disease[J]. Eur J Endocrinol, 2013, 168: R95–-R103. DOI: 10.1530/EJE-13-0115 |
 2017, Vol. 38
2017, Vol. 38


