2. 广东药科大学基础学院生物化学与分子生物学教研室, 广州 510006
2. Department of Biochemistry and Molecular Biology, School of Basic Courses, Guangdong Pharmaceutical University, Guangzhou 510006, Guangdong, China
2型糖尿病 (type 2 diabetes mellitus,T2DM) 是一种以高血糖为主要特征的内分泌代谢性疾病,胰岛素分泌异常和胰岛素抵抗是其主要的病理机制[1]。随着高血糖的持续和胰岛素抵抗的加剧,胰岛素分泌功能会进一步衰退[2],主要表现为β细胞分泌胰岛素的功能下降和β细胞数量的减少[3~5]。因此,增加胰岛β细胞的数量和保护胰岛β细胞的功能已成为降糖药物研发的有价值的发展方向之一[6]。目前研究发现多种中药可以通过修复与保护胰岛β细胞,达到对T2DM的治疗效果[7~9]。黄芪多糖 (Astragalus polysaccharides,APS) 是豆科植物黄芪Astragalus membranaceus (Fisch.) Bge.的有效活性成分,是治疗T2DM的传统中药,具有改善消化系统功能、调节机体免疫、改善糖脂代谢等作用[10]。研究表明,APS治疗T2DM能够有效降低血糖[2, 11],但是其降糖机制并未完全阐明。本研究拟从APS对胰岛β细胞功能和数量的影响来探讨APS治疗T2DM大鼠的作用机制。
1 材料和方法 1.1 实验动物SPF级SD雄性大鼠由广州中医药大学动物中心提供,动物生产许可证号:SCXK (粤)2013-0020;SD大鼠在广东药科大学实验动物中心喂养,动物使用许可证号:SYXK (粤)2012-012。
1.2 T2DM大鼠模型的构建及药物干预SPF级SD雄性大鼠24只,体质量180~200 g,饲养于广东药科大学实验动物中心,室温26 ℃,相对湿度60%,每日光照12 h,自由摄食、饮水。适应性饲养1周后,随机将大鼠分为T2DM模型组 (16只) 和正常对照组 (NC组,8只)。T2DM模型组大鼠给以高脂饲料 (基础饲料58%、猪油18%、蔗糖20%、蛋黄3%,由广东省医学实验动物中心提供) 喂养,喂养8周后,禁食12 h,一次性腹腔注射30 mg/kg链脲佐菌素 (streptozotocin,STZ;临用前用柠檬酸缓冲溶液配制成pH为4.2~4.5、浓度为1%的STZ溶液)。NC组大鼠以普通饲料喂养8周后,一次性腹腔注射等体积的柠檬酸缓冲液。1周后,尾部采血,用血糖仪检测T2DM模型组大鼠禁食12 h的空腹血糖 (fasting blood glucose,FBG)。FBG≥11.1 mmol/L并伴有“三多一少”症状的大鼠即为建模成功的T2DM模型大鼠。随后,将T2DM模型大鼠随机分为APS治疗组和T2DM组,每组8只,分别以APS[700 mg/(kg·d),西安瑞林生物技术公司,采用超声波提取法提取APS,利用紫外分光光度法检测APS含量为70%]和等体积的蒸馏水灌胃8周 (1次/d)。药物干预期间,NC组大鼠继续给予正常饲料喂养,T2DM组和APS治疗组大鼠继续给予高脂饲料喂养。
1.3 检测指标 1.3.1 血清中生化指标的测定采用全自动生化分析仪检测实验大鼠血清中FBG、三酰甘油 (triglyceride,TG)、总胆固醇 (total cholesterol,TC)、高密度脂蛋白胆固醇 (high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇 (low density lipoprotein cholesterol,LDL-C) 的水平;采用酶联免疫吸附试验 (enzyme linked immunosorbent assay,ELISA) 测定空腹胰岛素 (fasting insulin,FINS) 水平,按Insulin Human ELISA Kit (Abcam,USA) 说明书操作,并用胰岛素分泌指数HOMA-β来评价大鼠胰岛β细胞的功能,HOMA-β=20×FINS/(FBG-3.5)。
1.3.2 胰腺病理组织学检查和免疫组织化学染色药物干预8周后,禁食12 h,处死大鼠后取胰腺,生理盐水冲洗后用滤纸拭干,浸泡于10%中性甲醛溶液中固定,Leica EG1160石蜡包埋机 (德国) 包埋,连续切取2~3 μm厚的切片。
苏木精-伊红 (Hematoxylin-Eosin,H-E) 染色:切片脱蜡至水后,H-E染色、乙醇分化、氨水返蓝后脱水封片。
免疫组织化学染色:切片脱蜡至水后,按Super SensitiveTM IHC Detection System Kit (Bioworld,USA) 试剂盒说明书操作。具体操作如下:加内源性过氧化氢酶阻断剂室温孵育10 min,PBS冲洗后加封闭剂封闭5 min,PBS冲洗后加抗胰岛素抗体 (1:500,Abcam,USA)4 ℃孵育过夜。次日取出室温平衡30 min,PBS冲洗后,加抗体放大剂室温孵育10 min,PBS冲洗后,加高敏酶标抗小鼠/兔IgG聚合物室温孵育10 min,PBS冲洗,DAB显色后,苏木精复染,乙醇分化、氨水返蓝后脱水封片。
使用Olymplus BX51生物显微镜在100倍和200倍的视野下观察各组大鼠的胰腺组织病理学特征,并计数胰岛β细胞 (棕褐色的胰岛素免疫反应阳性细胞即为β细胞),每例均对整张组织切片中的所有胰岛β细胞进行计数。
1.4 统计学处理实验数据采用GraPhad Prism 5.0统计软件 (GraphPad Software,Inc.) 进行分析,组内比较采用配对t检验,组间比较采用非配对t检验,检验水准 (α) 为0.05。大鼠胰腺组织免疫组化实验结果采用Image-Pro Plus 6.0专业图像分析软件 (Media Cybernetics,美国) 进行分析。
2 结果 2.1 T2DM大鼠模型的构建和APS的降糖效果STZ注射前,各组大鼠的FBG为3.6~5.8 mmol/L,组间差异无统计学意义;STZ注射后1周,T2DM模型大鼠的FBG均>11 mmol/L,并伴有“三多一少”症状。测定APS干预8周后各组大鼠的FBG,结果如表 1所示。与NC组比较,T2DM组大鼠的FBG升高 (P < 0.05);与T2DM组比较,APS治疗组大鼠的FBG降低 (P < 0.05)。
|
|
表 1 各组大鼠的FBG、TG、TC、HDL-C、LDL-C、FINS和HOMA-β水平 Tab 1 Levels of FBG, TG, TC, HDL-C, LDL-C, FINS and HOMA-β of rats in three groups |
2.2 APS对T2DM大鼠脂代谢的影响
由表 1可知,与NC组比较,T2DM组大鼠的TG和LDL-C升高,HDL-C降低 (P < 0.05);与T2DM组比较,APS治疗组大鼠的TG和LDL-C均降低 (P < 0.05)。
2.3 APS对T2DM大鼠FINS水平和HOMA-β值的影响由表 1可知,与NC组比较,T2DM组大鼠的FINS和HOMA-β值均降低 (P < 0.05);与T2DM组比较,APS治疗组大鼠的FINS和HOMA-β值均升高 (P < 0.05)。
2.4 APS对T2DM大鼠胰腺组织的影响 2.4.1 大鼠胰腺组织病理学变化本实验采用H-E染色法观察大鼠胰腺组织的病理学变化,结果如图 1所示。(1) NC组 (图 1A、1B):镜下胰岛细胞着色较浅、细胞核蓝色着染,胰腺外分泌腺粉红色着染;胰岛呈圆形或椭圆形团状,散在分布于胰腺外分泌腺中;胰岛界限清楚,胰岛细胞胞质丰富,胰岛细胞未见变性。(2) T2DM组 (图 1C、1D):与NC组比较,T2DM组大鼠胰岛呈不规则状,散在分布于胰腺外分泌腺中;胰岛数目显著减少,胰岛体积显著缩小,结构不清,8只大鼠胰岛内细胞数量均减少并伴有颗粒脱失、空泡变性。(3) APS治疗组 (图 1E、1F):与T2DM组比较,APS治疗组大鼠的胰岛体积增大,胰岛内细胞数量增多,颗粒脱失和空泡变性现象有所改善。
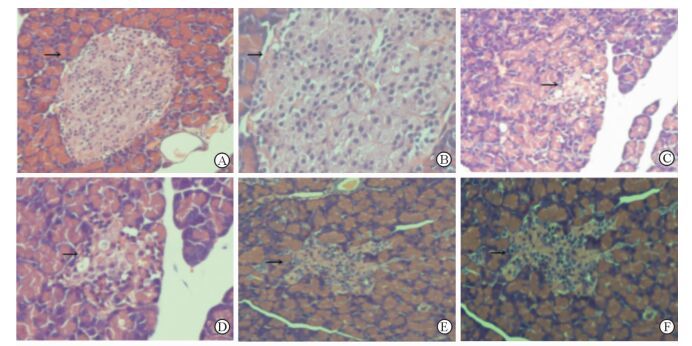
|
图 1 各组大鼠胰腺组织苏木精-伊红染色 Fig 1 Hematoxylin-eosin (H-E) staining of pancreatic tissue of rats in three groups A, B: NC group; C, D: T2DM group; E, F: APS treatment group. NC: Normal control; T2DM: Type 2 diabetes mellitus; APS: Astragalus polysaccharides. Islets are indicated by the black arrows. Original magnification: ×100 (A, C, E), ×200 (B, D, F) |
2.4.2 大鼠胰岛β细胞数量变化
本实验采用免疫组织化学染色法观察并计数胰岛β细胞,结果见图 2。(1) NC组 (图 2A、2B):低倍镜下可见胰岛多数呈圆形或椭圆形,胰岛内有大量β细胞,且占据胰岛的绝大部分,排列紧密;高倍镜下可见胰岛β细胞胞质内阳性反应产物呈颗粒状,即胰岛素分泌颗粒,胰岛素分泌颗粒在胞质内存在丰富、着色深。(2) T2DM组 (图 2C、2D):与NC组比较,低倍镜下可见T2DM组大鼠的胰岛形状多不规则,边缘不整齐,胰岛内β细胞数量显著减少,胰岛内常出现较大的空隙;高倍镜下可见胰岛β细胞胞质内胰岛素分泌颗粒减少甚至缺失,颗粒着色浅、分布不均匀。(3) APS治疗组 (图 2E、2F):与T2DM组比较,低倍镜下可见APS治疗组大鼠胰岛β细胞数量增加,散在分布在胰岛中央;高倍镜下可见胰岛β细胞胞质内胰岛素分泌颗粒显著增多,颗粒着色深,分布较集中。
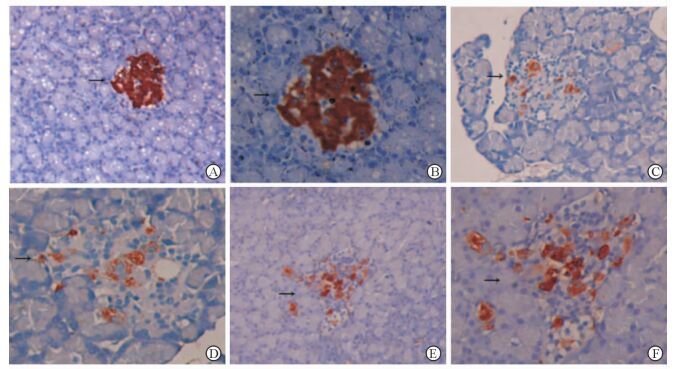
|
图 2 各组大鼠胰岛β细胞免疫组化染色 Fig 2 Immunohistochemical staining of pancreatic islet β cells of rats in three groups A, B: NC group; C, D: T2DM group; E, F: APS treatment group. NC: Normal control; T2DM: Type 2 diabetes mellitus; APS: Astragalus polysaccharides. Islets are indicated by the black arrows. Original magnification: ×100 (A, C, E), ×200 (B, D, F) |
3 讨论
黄芪始载于《神农本草经》,被列为上品,味甘,微温;归肺,脾经,有补气升阳、固表止汗之效。研究发现,黄芪是古代治疗消渴的高频用药之一,在消渴病 (糖尿病属于中医学“消渴”范畴) 的治疗中发挥重要作用[12]。APS是黄芪中一种有较强生物活性的大分子化合物,具有增强免疫[13]、降血糖[14]、抗炎[15]等多种药理作用,研究表明APS对T2DM及其并发症有明显的治疗效果,能够有效地降低T2DM患者的血糖,但目前APS治疗T2DM的作用机制还不明确。
本实验发现,APS可以降低T2DM大鼠的FBG、TG和LDL-C,升高FINS和HOMA-β值,改善T2DM大鼠胰岛组织的病理学形态,增加胰岛β细胞的数量,提示APS可能通过改善T2DM大鼠糖脂代谢紊乱、保护胰岛β细胞功能,从而延缓T2DM病程的发展。
T2DM是因胰岛素分泌和功能异常而引起的糖类、脂肪等代谢紊乱的一种慢性疾病。刘洪凤等[16]研究APS对高脂饮食 (碳水化合物50%,蛋白质13%,脂肪30%,其他成分7%) 联合STZ诱导的T2DM大鼠血脂的影响发现,APS能降低T2DM大鼠血清中TG、胆固醇、低密度脂蛋白的含量,同时能升高高密度脂蛋白的含量。但也有研究发现APS只能降低单纯STZ诱导的T2DM大鼠的TG或TC,而对LDL-C和HDL-C没有影响[17~18]。本实验发现,APS可以降低高脂饮食 (基础饲料58%、猪油18%、蔗糖20%、蛋黄3%) 联合STZ诱导的T2DM大鼠血清中TG和LDL-C的含量,升高HDL-C的含量,但对TC没有影响。本研究与其他研究结果不一致的原因可能与T2DM大鼠的造模方式、高脂饲料的配方及喂养时间等有关。
目前对APS治疗T2DM的机制研究主要集中在改善胰岛素抵抗和增加胰岛素分泌两方面。裴文丽[19]研究发现,T2DM大鼠建模成功后血清FINS水平增加,而APS可以降低T2DM大鼠血清的FINS水平,改善胰岛素抵抗。胡琛琛等[20]和Wu等[21]研究也发现,APS对T2DM大鼠血清FINS水平没有影响,但可以显著增加T2DM大鼠胰岛素敏感性。还有研究发现T2DM大鼠建模成功后血清中FINS的水平降低,APS有增加T2DM大鼠血清FINS水平的趋势,还可以增加胰岛素敏感性[22~23]。Li等[13]也发现,APS可以增加1型糖尿病小鼠的血清FINS水平,增加胰岛素敏感性。本实验发现T2DM大鼠建模成功后血清FINS水平降低,APS可以增加T2DM大鼠的血清FINS水平、升高HOMA-β值,但对T2DM大鼠的胰岛素敏感性没有影响。本实验用H-E染色法观察胰腺组织病理学变化,发现APS可以部分修复胰岛细胞的病理形态,改善颗粒脱失和空泡变性现象;另外采用免疫组化法观察并检测胰岛β细胞的数量还发现APS可以增加β细胞的数量。由此推测APS增加T2DM大鼠的血清中FINS水平可能是通过保护胰岛β细胞的功能、促进胰岛β细胞增生或者抑制胰岛β细胞凋亡来实现的。陈玉涛和薛承锐[24]从分子生物学角度探讨了APS的降糖机制,发现APS可以上调慢性胰腺炎大鼠胰腺Kir6.2的表达,促进胰岛素的分泌。李琳等[25]研究也发现APS可以使胰岛MIN6细胞的增殖活性升高、细胞凋亡率下降和胰岛素分泌功能升高。
综上所述,APS能够明显改善T2DM大鼠的糖脂代谢,其机制可能是通过对T2DM大鼠胰岛β细胞的保护作用进而促进FINS的分泌来实现的。本研究结果为APS治疗T2DM的可行性提供了新证据,同时为APS治疗T2DM的机制研究提供了新方向,但APS改善胰岛β细胞的分子机制还有待进一步的研究。
| [1] | 郑丽, 徐涛. 糖尿病研究进展[J]. 生命科学, 2012, 24: 606–610. |
| [2] | UNGER R H, GRUNDY S. Hyperglycaemia as an inducer as well as a consequence of impaired islet cell function and insulin resistance:implication for the management of diabetes[J]. Diabetologia, 1985, 28: 119–121. |
| [3] | 孙志, 马丽, 邱玉芹, 韩海容. 2型糖尿病发病机制及胰岛β细胞功能障碍的研究进展[J]. 医学综述, 2008, 14: 1371–1373. DOI: 10.3969/j.issn.1006-2084.2008.09.036 |
| [4] | LEAHY J L, HIRSCH L B, PETERSON K A, SCHNEIDER D. Targeting β-cell function early in the course of therapy for type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2010, 95: 4206–4216. DOI: 10.1210/jc.2010-0668 |
| [5] | MEECE J. Pancreatic islet dysfunction in type 2 diabetes:a rational target for incretin-based therapies[J]. Curr Med Res Opin, 2007, 23: 933–944. DOI: 10.1185/030079906X167336 |
| [6] | 柳军, 张陆勇. 基于β细胞为靶标的2型糖尿病药物治疗研究进展[J]. 中国临床药理学与治疗学, 2010, 15: 588–595. |
| [7] | 甄仲, 刘文科, 张京华, 陈良, 仝小林. 中医药防治2型糖尿病胰岛β细胞功能损伤研究进展[J]. 中华中医药学刊, 2010, 28: 957–960. |
| [8] | 周嘉, 寻英, 黄松, 罗佐杰, 秦映芬. 复方丹参滴丸对2型糖尿病大鼠模型胰岛β细胞功能的影响[J]. 中成药, 2015, 37: 1807–1810. |
| [9] | 胥冰, 刘娟, 田磊, 马晓军. 针刺联合中药对糖尿病模型大鼠胰岛的保护作用[J]. 中国老年学杂志, 2015, 35: 751–753. DOI: 10.3969/j.issn.1005-9202.2015.03.084 |
| [10] | 段炼, 李会军, 闻晓东, 李萍. 黄芪治疗糖尿病研究进展[J]. 中国新药杂志, 2013, 22: 776–781. |
| [11] | 石永芳. 黄芪多糖对Ⅱ型糖尿病小鼠血糖的影响[J]. 安徽农业科学, 2015, 43: 29–30. DOI: 10.3969/j.issn.0517-6611.2015.13.012 |
| [12] | 高美风. 黄芪治疗消渴病的药证规律分析[J]. 亚太传统医药, 2010, 6: 148–152. |
| [13] | LI R J, QIU S D, CHEN H X, TIAN H, WANG H X. The immunotherapeutic effects of Astragalus polysaccharide in type 1 diabetic mice[J]. Biol & Pharm Bull, 2007, 30: 470–476. |
| [14] | ZOU F, MAO X Q, WANG N, LIU J, OUYANG J P. Astragalus polysaccharides alleviates glucose toxicity and restores glucose homeostasis in diabetic states via activation of AMPK[J]. Acta Pharmacol Sin, 2009, 30: 1607–1615. DOI: 10.1038/aps.2009.168 |
| [15] | LU J, CHEN X, ZHANG Y, XU J, ZHANG L, LI Z, et al. Astragalus polysaccharide induces anti-inflammatory effects dependent on AMPK activity in palmitate-treated RAW264.7 cells[J]. Int J Mol Med, 2013, 31: 1463–1470. |
| [16] | 刘洪凤, 郭新民, 王桂云, 冯芹喜, 包海花, 崔荣军. 黄芪多糖对2-DM胰岛素抵抗大鼠血糖及血脂的影响[J]. 牡丹江医学院学报, 2007, 28: 18–20. DOI: 10.3969/j.issn.1001-7550.2007.01.010 |
| [17] | 陈蔚, 陈雯洁, 夏燕萍, 陆怡, 俞茂华. 黄芪多糖对糖尿病仓鼠脂代谢紊乱及心肌PPAR-α表达的影响[J]. 复旦学报:医学版, 2010, 37: 194–197. |
| [18] | CHEN W, XIA Y P, CHEN W J, YU M H, LI Y M, YE H Y. Improvement of myocardial glycolipid metabolic disorder in diabetic hamster with Astragalus polysaccharides treatment[J]. Mol Biol Rep, 2012, 39: 7609–7615. DOI: 10.1007/s11033-012-1595-y |
| [19] | 裴文丽. 黄芪多糖对2型糖尿病大鼠血清IL-1β、IL-6、IL-18的影响作用[J]. 中医临床研究, 2016, 8: 10–13. DOI: 10.3969/j.issn.1674-7860.2016.02.004 |
| [20] | 胡琛琛, 毕会民, 张叶敏, 欧阳静萍. 黄芪多糖对2型糖尿病大鼠肝脏CHOP表达的影响[J]. 微循环学杂志, 2010, 20: 1–3. DOI: 10.3969/j.issn.1005-1740.2010.01.001 |
| [21] | WU Y, OUYANG J P, WU K, WANG Y, ZHOU Y F, WEN C Y. Hypoglycemic effect of Astragalus polysaccharide and its effect on PTP1B1[J]. Acta Pharm Sin, 2005, 26: 345–352. DOI: 10.1111/aphs.2005.26.issue-3 |
| [22] | WANG N, ZHANG D, MAO X, ZOU F, JIN H, OUYANG J. Astragalus polysaccharides decreased the expression of PTP1B through relieving ER stress induced activation of ATF6 in a rat model of type 2 diabetes[J]. Mol Cell Endocrinol, 2009, 307: 89–98. DOI: 10.1016/j.mce.2009.03.001 |
| [23] | 李楠, 范颖, 贾旭鸣, 林庶茹, 马哲. 黄芪及其有效部位对糖尿病模型大鼠AdipoR1、AMPK mRNA表达的影响[J]. 华中医药杂志, 2011, 26: 1176–1181. |
| [24] | 陈玉涛, 薛承锐. 黄芪多糖对胰源性糖尿病大鼠胰腺Kir6.2表达的干预研究[J]. 医学综述, 2010, 16: 767–770. DOI: 10.3969/j.issn.1006-2084.2010.05.043 |
| [25] | 李琳, 刘瑜, 刘屏, 李春霖, 胡园, 谷昭燕, 等. 黄芪多糖对MIN6细胞增殖、凋亡及胰岛素分泌的影响[J]. 中国新药杂志, 2011, 20: 2139–2142. |
 2017, Vol. 38
2017, Vol. 38


