2. 新疆额敏县人民医院妇产科, 新疆 834600
2. Department of Obstetrics and Gynecology, People's Hospital of Emin County, Emin 834600, Xinjiang, China
女性患者,58岁,因“下腹坠胀伴尿频、尿急、尿不尽半年”于2015年10月7日收入院。患者已绝经7年,绝经后未口服激素类药物,绝经后无阴道流血流液。近半年自觉下腹部坠胀,伴尿频、尿急、尿不尽感,偶有腰酸、乏力,无畏寒、发热等不适。2015年9月23日于外院行阴道超声检查示:宫颈处见范围8.9 cm×8.2 cm低回声区。盆腔CT提示盆腔占位97 mm×89 mm。10月8日于第二军医大学长海医院经腹部B超提示子宫形态不规则,肌层回声不均匀,宫腔见范围1.9 cm×1.0 cm无回声区,节育器距离宫底2.3 cm,宫体下段见范围9.5 cm×9.0 cm实性低回声结节,边界不清,内回声不均,双侧卵巢未显示。患者否认高血压、糖尿病、冠心病病史;无肝炎、结核等传染病;否认手术史;否认药物过敏史。15岁初潮,5~6/30~31 d,51岁绝经;25岁结婚,1-0-2-1,1981年顺产一女,宫内节育器避孕,配偶及子女健康状况良好。入院体检:生命体征平稳,心肺听诊未及明显异常,腹软,腹部未触及明显包块,无压痛、反跳痛。四肢活动正常,未见明显肿胀。妇科检查:外阴正常,阴道通畅,宫颈光滑,子宫后方可触及一直径约10 cm肿物,质硬,向阴道突出,活动度差,双侧附件未扪及。初步诊断:宫颈肌瘤?子宫后壁肌瘤?术前相关检查未见明显异常。于2015年10月9日择期手术,全麻下术中探查见盆腔淡黄色积液约50 mL,子宫萎缩,双侧附件外观未见异常,包块来源于子宫直肠凹阴道直肠隔内,直径约10 cm,质硬,向阴道后壁突出,遂行全子宫+双附件+阴道后壁肿物切除术。术中沿穹窿切除全子宫时宫腔内流出黄色黏稠脓液。于肿物突出处切开阴道后壁,肿瘤组织实性,质脆,取出过程中肿瘤破碎,检查创面基本无肿瘤残留后间断缝合囊腔及创面。切除过程中出血偏多,术中出血约3 500 mL。术中输红细胞悬液1 800 mL,血浆600 mL。术后病理标本镜检示:肿瘤细胞梭形,呈束状及交织状排列,核卵圆及杆状,紧密排列,可见重叠现象,核分裂象4~6/50 HP (图 1)。免疫组化示SMA (+)、ER (+)、C-Kit (+)、S-100(-)、ABC (-)、Ki-67(5%)、PR (-)、Dog-1(+)、CD34(+)、NGFR (-)、SOX-10(-)、CALP (-)、Des (-)、EZH2(5%)、TLE-1(-)、P16(-)。C-Kit、PDGFRA基因突变检测报告示:C-Kit第9、11和PDGFRA第12、18号外显子全长序列发现C-Kit第11号为突变型,而C-Kit第9和PDGFRA第12、18号外显子均为野生型。故病理诊断为阴道直肠隔胃肠外间质瘤 (EGIST),倾向高危型。患者术后恢复好,于10月15日出院。出院后开始服用伊马替尼 (格列卫) 治疗至今,400 mg/d口服,随访5个月无复发迹象。
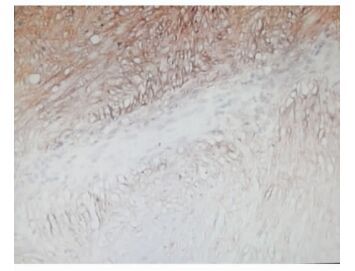
|
图 1 术后病理结果 C-Kit免疫组化染色. Original magnification:×200 |
2 讨论
胃肠间质瘤 (gastrointestinal stromal tumors, GIST) 是胃肠道最常见的间叶源性肿瘤,在人群中发病率约十万分之一到十万分之二[1]。GIST可以起源于胃肠道的任何部位,其中最常发生的部位是胃 (60%) 和小肠 (30%),其次好发的部位包括十二指肠 (4%~5%)、直肠 (4%)、结肠和阑尾 (1%~2%) 以及食管 (1%)[1]。还有一部分起源于消化道外 (网膜、肠系膜、后腹膜等) 的间质瘤被称之为EGIST,其病例较为少见,而原发于女性生殖系统的EGIST十分罕见。国内外近年来相关报道也较少,根据报道总结相关病例资料见表 1。
|
|
表 1 国内外报道的EGIST发生于阴道或直肠阴道的病例资料 |
EGIST早期多无明显症状,一般患者出现腹部包块、腹胀、尿频和便秘等压迫症状时才就诊。症状加重或包块生长迅速时往往可能出现肿瘤出血坏死,自发破裂时引起腹痛或发热。腹部检查及妇科检查可扪及实性包块,界限清楚,部分患者可触及压痛。当肿物位于阴道壁及阴道直肠间隔内时,可于阴道壁触及肿物。影像学上无特异性表现, B超也缺乏特异性图像,CT平扫可见圆形或椭圆形肿物影,边界不清,如有出血坏死图像上常可见肿物密度不均匀、高低密度混杂。强化后可见肿物周边实体强化明显。其表现易与子宫平滑肌瘤、附件肿瘤、阴道肿瘤等妇科肿瘤造成混淆。因EGIST临床表现无明显特点,且发生率极低,多数临床医生对该病认识欠缺,术前很难做出正确诊断,很容易漏诊或误诊。本例肿瘤直径约10 cm,为查阅到的至今报道的病例中肿瘤直径最大的。
EGIST诊断主要依靠临床病理检查及免疫组化结果。组织病理学上一般表现为梭形细胞和上皮样细胞,梭形细胞和上皮样细胞混合存在时,称为混合型。有时与平滑肌瘤很容易混淆。免疫组化CD117或CD34阳性对确诊有绝对意义,大多数病例具有C-Kit或PDGFRA活化突变[12~13]。CD117是C-Kit基因的蛋白产物,PDGFRA是PDGFRA基因激活突变的产物。基因突变检测十分重要,对预测分子靶向治疗药物的疗效和指导临床治疗具有重要意义。
对于EGIST,外科手术仍为首选的治疗方式,手术治疗的彻底性与疾病预后密切相关,推荐行病灶的整块完整切除。在部分患者中,因周围组织广泛粘连或播散,有的也仅行姑息性手术以达到明确诊断或减瘤而缓解症状的目的。本例中,因术前考虑为宫颈肌瘤可能性大,腹腔镜操作困难,故采取开腹手术,考虑患者58岁,拟行全子宫切除术。但术中肿瘤破裂,且出血较多,增加了医源性播散可能,故术前诊断或治疗对于EGIST显得尤为重要。必要时可在术前进行分子靶向药物治疗,以减小肿瘤体积,降低手术风险,可以减少术中破裂出血风险较大的患者发生医源性播散的可能性[14]。
因EGIST病例较少,现无EGIST诊断与肿瘤恶性风险评估的统一标准,故EGIST的恶性风险评估比照GIST进行。本例患者肿瘤直径约10 cm,镜下核分裂象4~6/50 HP,发生在阴道直肠隔,根据Joensuu[15]对GIST切除后的危险度分级,本例属高危。中高危复发风险患者术后需辅助治疗。GIST/EGIST对常规放化疗不敏感。对于基因检测为基因突变的患者,术后辅助治疗获益较大。目前推荐伊马替尼作为辅助治疗的一线药物。伊马替尼属于苯胺嘧啶衍生物,为酪氨酸激酶抑制剂,通过抑制Kit的突变和PDGFRA而产生抗肿瘤细胞增殖的效应。伊马替尼除可抑制EGIST细胞的增殖外,还可促进EGIST细胞凋亡,抑制有丝分裂原激活的蛋白激酶以及PI3K信号转导通路。一般主张初始推荐剂量为400 mg/d,持续用药1年并随访。因EGIST术后可出现腹膜和肝脏转移,中、高危患者应该每3个月进行1次CT或MRI检查,持续3年,然后每6个月1次,直至5年;5年后每年随访1次。低危患者应每6个月进行1次CT或MRI检查,持续5年。由于肺部和骨骼转移发生率相对较低,建议至少每年1次胸部X线检查,在出现相关症状情况下推荐进行ECT骨扫描,必要时进行全身PET/CT检查[14]。
阴道直肠隔的EGIST易被误诊为常见妇科肿瘤,因手术前评估不充分,术中易造成医源性播散,影响预后。希望通过本病例增加同行对此疾病的认识,尽量降低误诊率,使患者得到最大获益。
| [1] | 郁雷, 梁小波. 胃肠道间质瘤诊治指南解读[J/CD]. 中华结直肠疾病电子杂志, 2015, 4: 8-14. |
| [2] | NASU K, UEDA T, KAI S, ANAI H, KIMURA Y, YOKOYAMA S, et al. Gastrointestinal stromal tumor arising in the rectovaginal septum[J]. Int J Gynecol Cancer, 2004, 14: 373–377. DOI: 10.1111/ijg.2004.14.issue-2 |
| [3] | CEBALLOS K M, FRANCIS J A, MAZURKA J L. Gastrointestinal stromal tumor presenting as a recurrent vaginal mass[J]. Arch Pathol Lab Med, 2004, 128: 1442–1444. |
| [4] | WEPPLER E H, GAERTNER E M. Malignant extragastrointestinal stromal tumor presenting as a vaginal mass:report of an unusual case with literature review[J]. Int J Gynecol Cancer, 2005, 15: 1169–1172. DOI: 10.1111/ijg.2005.15.issue-6 |
| [5] | TAKANO M, SAITO K, KITA T, FURUYA K, AIDA S, KIKUCHI Y. Preoperative needle biopsy and immunohistochemical analysis for gastrointestinal stromal tumor of the rectum mimicking vaginal leiomyoma[J]. Int J Gynecol Cancer, 2006, 16: 927–930. DOI: 10.1111/ijg.2006.16.issue-2 |
| [6] | LAM M M, CORLESS C L, GOLDBLUM J R, HEINRICH M C, DOWNS-KELLY E, RUBIN B P. Extragastrointestinal stromal tumors presenting as vulvovaginal/rectovaginal septal masses:a diagnostic pitfall[J]. Int J Gynecol Pathol, 2006, 25: 288–292. DOI: 10.1097/01.pgp.0000215291.22867.18 |
| [7] | NAGASE S, MIKAMI Y, MORIYA T, NⅡKURA H, YOSHINAGA K, TAKANO T, et al. Vaginal tumors with histologic and immunocytochemical feature of gastrointestinal stromal tumor:two cases and review of the literature[J]. Int J Gynecol Cancer, 2007, 17: 928–933. DOI: 10.1111/ijg.2007.17.issue-4 |
| [8] | ZHANG W, PENG Z, XU L. Extragastrointestinal stromal tumor arising in the rectovaginal septum:report of an unusual case with literature review[J]. Gynecol Oncol, 2009, 113: 399–401. DOI: 10.1016/j.ygyno.2009.02.019 |
| [9] | MOLINA I, SEAMON L G, COPELAND L J, SUAREZ A. Reclassification of leiomyosarcoma as an extra-gastrointestinal stromal tumor of the gynecologic tract[J]. Int J Gynecol Pathol, 2009, 28: 458–463. DOI: 10.1097/PGP.0b013e31819c7fc1 |
| [10] | VÁZQUEZ J, PÉREZ-PEÑA M, GONZÁLEZ B, SÁNCHEZ A. Gastrointestinal stromal tumor arising in the rectovaginal septum[J]. J Low Genit Tract Dis, 2012, 16: 158–161. DOI: 10.1097/LGT.0b013e31823b52af |
| [11] | MELÉNDEZ M N, REVELLO R, CUERVA M J, DE SANTIAGO J, ZAPARDIEL I. Misdiagnosis of an extragastrointestinal stromal tumor in the rectovaginal septum[J/OL]. J Low Genit Tract Dis, 2014, 18:e66-e70. doi:10.1097/LGT.0b013e3182a72156. |
| [12] | FLETCHER C D, BERMAN J J, CORLESS C, GORSTEIN F, LASOTA J, LONGLEY B J, et al. Diagnosis of gastrointestinal stromal tumors:a consensus approach[J]. Int J Surg Pathol, 2002, 10: 81–89. DOI: 10.1177/106689690201000201 |
| [13] | 贺慧颖, 方伟岗, 钟镐镐, 李燕, 郑杰, 杜娟, 等. 165例胃肠道间质瘤中C-kit和PDGFRA基因突变的检测和临床诊断意义[J]. 中华病理学杂志, 2006, 35: 262–266. DOI: 10.3760/j.issn:0529-5807.2006.05.003 |
| [14] | 中国CSCO胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识 (2013年版)[J]. 中华胃肠外科杂志, 2014, 17: 393–398. DOI: 10.3760/cma.j.issn.1671-0274.2014.04.022 |
| [15] | JOENSUU H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39: 1411–1419. DOI: 10.1016/j.humpath.2008.06.025 |
 2017, Vol. 38
2017, Vol. 38


