2. 上海交通大学医学院附属新华医院口腔科, 上海 200092
2. Department of Stomatology, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200092, China
口腔黏膜损伤有很多易感因素,如感染、自体免疫紊乱、外科损伤或自伤等,同时还包括牙龈或牙周炎的因素。然而,对口腔黏膜损伤愈合的影响因素却少有报道[1]。伤口愈合是十分复杂的过程,包括多种不同类型细胞的相互作用,不同生长因子、细胞外基质蛋白的相互作用等[2]。在伤口区域的上皮组织中富含类炎性介质,如白介素1(interleukin-1, IL-1)、肿瘤坏死因子α (tumor necrosis factor-α, TNF-α) 等;同样还含有生长因子,如血管内皮生长因子 (vascular endothelial growth factor,VEGF) 等。伤口中的角质细胞可以通过产生和释放可溶性细胞因子来调节成纤维细胞的转化以及血管内皮细胞的生成,从而影响伤口愈合[3]。
VEGF是最强的血管生成因子之一,也是伤口愈合过程中最主要的血管生成因子,其产物能够刺激毛细血管生长,从而给伤口区运送足够的营养物质、氧气和炎性细胞。在伤口愈合过程中,VEGF-A主要来源于结缔组织中的角质细胞、巨噬细胞、成纤维细胞等[4-6]。
叉头框蛋白O1(forkhead box O1,FOXO1) 是叉头转录因子大家族中的一员,参与多种细胞进程,包括细胞周期阻滞、DNA修复、细胞凋亡、氧化压力的抵抗和糖代谢等[7]。近年来研究发现,FOXO1在伤口愈合过程中可能扮演了关键角色。Mori等[8]研究表明,皮肤出现伤口1 d后基底层和边缘角质细胞中FOXO1显著激活。Ponugoti等[9]研究显示,在普通伤口处上调转化生长因子β1(transforming growth factor β1,TGF-β1) 能提高FOXO1的表达。在角质细胞中特异性敲除FOXO1能干扰角质细胞在普通皮肤伤口和黏膜伤口中的迁徙[9-11]。本实验运用体外实验方法特异性沉默角质细胞中的FOXO1基因,评价FOXO1对VEGF-A的调节作用,探究FOXO1能否诱导VEGF-A的转录激活和表达,从而调节伤口修复。
1 材料和方法 1.1 细胞培养与转染人永生化牙龈角质细胞 (human immortalized gingival keratinocyte,HIGK) 由Jeffrey J. Mans (University of Florida, Gainesville, FL) 提供。HIGK保存在含有角质细胞生长因子的KGM-2培养基中 (Lonza Inc., US)。所有细胞培养均在含有5%CO2的37 ℃培养箱中进行。将实验细胞分为3组:空白组 (NT组)、scrambled siRNA转染组 (siScr组) 和FOXO1 siRNA转染组 (siFOXO1组)。NT组不进行siRNA转染,siScr组使用ON-TARGET plus Non-targeting Control Pool siRNA (GE Healthcare,US) 进行转染,siFOXO1组使用ON-TARGET plus SMART pool抗人FOXO1 siRNAs (GE Healthcare,US) 进行转染。转染时使用GenMute siRNA转染剂 (SignaGen Laboratories,US)。实验前2 d将细胞、siRNA和转染试剂共同培育6 h进行转染。转染完成后冲洗细胞,转移回相应培养基中继续培养。分别使用基本培养基 (basal media) 与模拟正常细胞环境和生长因子富集的培养基 (enriched media) 模拟伤口愈合时的细胞环境。
1.2 体外免疫荧光分析使用96孔板分别培养转染了FOXO1或scrambled siRNA的HIGK。KBM-2基质培养24 h后,用10%甲醛溶液固定细胞,0.5% Triton X-100使细胞膜通透,分别加入一抗抗FOXO1抗体 (rabbit; Santa Cruz Biotechnology, Inc.),抗VEGF-A抗体 (rabbit; Santa Cruz Biotechnology, Inc.) 和阴性对照IgG后于4 ℃过夜。二抗使用生物素化二抗,用链霉亲和素标记的Alexa Fluor®546(streptavidin-conjugated Alexa Fluor® 546,Abcam) 进行染色。染色过程中使用ABC (avidin-biotin peroxidase enzyme complex,Vector Laboratories) 和TSA (tyramide signal amplification,Adipogen, San Diego, CA, USA) 进行信号放大,细胞核进行DAPI染色。使用荧光显微镜 (Nikon) 和NIS Elements AR software (Nikon) 软件进行图像捕捉和平均免疫荧光强度 (mean fluorescence intensity,MFI) 测量。实验重复3次。
1.3 荧光素酶实验在48孔板中使用Lipofectamine 3000 (Invitrogen) 进行荧光酶素报告子转染实验。在培养基中培养HIGK 5 d后,分别用VEGF-A荧光酶素报告子、活化的FOXO1-AAA质粒、pRL-TK luciferase control vector进行转染。然后采用FOXO1和scrambled siRNA转染细胞,转染2 d后裂解细胞,使用双荧光酶素报告子试剂盒 (Promega, Madison, WI) 测量荧光素酶报告活性。实验重复3次。
1.4 统计学处理采用SPSS 19.0软件进行数据处理,所有结果以x±sx表示。免疫荧光结果使用方差分析 (ANOVA),并进行事后比较鉴定 (Scheffe’s post-hoc test);荧光素酶实验结果使用2-tailed Student’s t检验。检验水准 (α) 为0.05。
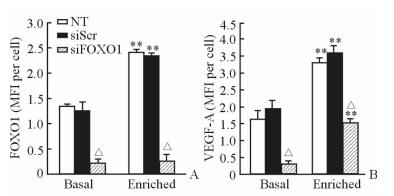
2 结果 2.1 体外细胞转染实验结果结果 (图 1A) 显示,生长因子富集培养基中NT组和siScr组细胞中FOXO1的表达相比基本培养基均增加 (P < 0.01),而两种培养基中siFOXO1组细胞中FOXO1的表达水平差异无统计学意义。在两种培养基中,siFOXO1组HIGK中FOXO1的表达水平均低于siScr组 (P < 0.05),分别降低了80%和85%。结果表明在两种培养基中,FOXO1 siRNA转染后HIGK中FOXO1的表达受到了显著抑制。
|
图 1 各组HIGK中FOXO1(A) 和VEGF-A (B) 的MFI Fig 1 Mean fluorescence intensity (MFI) of FOXO1 (A) and VEGF-A (B) in human immortalized gingival keratinocyte (HIGK) FOXO1: Forkhead box O1; VEGF-A: Vascular endothelial growth factor-A; NT: No treatment; siScr: Small interfering scramble RNA; siFOXO1: Small interfering FOXO1 RNA. **P < 0.01 vs basal media; △P < 0.05 vs siScr group. n=3, x±s |
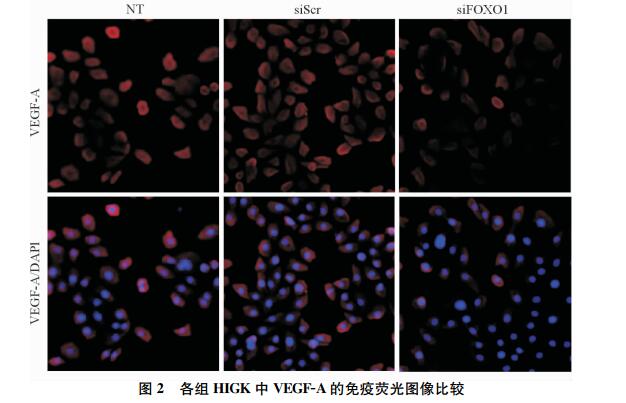
生长因子富集培养基中的3组细胞VEGF-A的表达均高于基本培养基 (P < 0.01)。此外,在生长因子富集培养基中,siFOXO1组HIGK中VEGF-A的表达低于siScr组,降低了57%(P < 0.05;图 1B,图 2)。结果提示在模拟伤口愈合环境的富集培养基中,FOXO1沉默显著降低了HIGK中VEGF-A的表达。
|
图 2 各组HIGK中VEGF-A的免疫荧光图像比较 Fig 2 Representative images of VEGF-A immunofluorescence in human immortalized gingival keratinocyte (HIGK) VEGF-A: Vascular endothelial growth factor-A; NT: No treatment; siScr: Small interfering scramble RNA; siFOXO1: Small interfering FOXO1 RNA; FOXO1: Forkhead box O1. Original magnification: ×40 |
2.2 荧光素酶实验
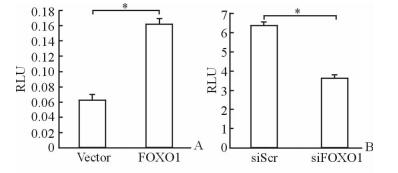
荧光素酶分析结果显示,过表达FOXO1使细胞中VEGF-A的转录表达活性增加了2.1倍 (P < 0.05,图 3A)。而FOXO1沉默时,细胞中VEGF-A的转录表达活性减少了20%~43%(P < 0.05,图 3B)。结果提示角质细胞中FOXO1表达与VEGF-A的转录表达活性呈正相关。
|
图 3 HIGK中VEGF-A的荧光酶素报告活性 Fig 3 Luciferase activity of VEGF-A human immortalized gingival keratinocyte (HIGK) A: FOXO1 overexpression; B: FOXO1 silencing. VEGF-A: Vascular endothelial growth factor-A; FOXO1: Forkhead box O1; siScr: Small interfering scramble RNA; siFOXO1: Small interfering FOXO1 RNA; RLU: Relative light unit. *P < 0.05. n=3, x±s |
3 讨论
VEGF-A被认为是最有效和特异性的血管生长因子之一[12],它具有促使内皮细胞分裂[13]、趋化[14]和诱导血管渗透[15]等作用。VEGF-A能够影响伤口愈合的多个阶段,包括伤口愈合过程中的血管生成、再上皮化和胶原沉积[16]。Rossiter等[17]通过抑制小鼠角质细胞中VEGF-A的表达,发现小鼠黏膜伤口中的血管减少,愈合减慢。Detmar等[18]通过培养人上皮角质细胞,研究生长因子对血管通透因子 (VPF)/VEGF mRNA和蛋白的表达影响,以及VPF/VEGF对人上皮毛细管内皮细胞生长的影响,结果发现未血管化的上皮角质细胞可以通过旁分泌的方式分泌VEGF-A,从而调节上皮生长。这些研究结果说明VEGF-A在伤口愈合过程中具有重要作用。
上皮角质细胞是VEGF-A的主要来源[17, 19-20]。在正常皮肤内VEGF-A的表达水平很低,但当皮肤损伤后其表达水平会大大提高[19],这与本研究的观点一致。本研究使用生长因子富集培养基模拟损伤环境,发现FOXO1未沉默的HIGK中VEGF-A的表达水平相比正常培养基大大增加。
此外,在体外实验中,使用FOXO1 siRNA沉默HIGK中的FOXO1后,VEGF-A蛋白的表达水平显著减少,VEGF-A启动子活性也明显降低;同时,在荧光素酶实验中使HIGK过表达FOXO1,可发现VEGF-A启动子活性显著增加。实验结果表明上皮角质细胞中FOXO1基因与VEGF-A的表达相关。有学者还提出,伤口愈合过程中角质细胞中FOXO1的缺失和血管生成能力的降低也会影响结缔组织的愈合能力,主要体现为成纤维细胞增殖降低和凋亡增加[21]。这些改变可能是通过间接减少血管生成或者直接改变VEGF-A而产生的[22]。VEGF-A在慢性伤口中的表达异常低,从而导致伤口没有有效的血管形成而愈合不良[22]。Brem等[21]证实VEGF-A能直接影响成纤维细胞在伤口愈合中的行为,包括成纤维细胞的迁移等。这些结果提示FOXO1可能通过调节VEGF-A的活性来影响其对伤口愈合的作用;同时还提示FOXO1不仅能影响上皮组织的愈合,还能影响结缔组织的愈合,但具体机制尚未明确报道。
当然,关于FOXO1对伤口愈合的影响机制也存在一些不同观点。有研究显示,FOXO1能显著抑制内皮细胞的迁徙[23],并且能够调节抗血管生成因子[24]。但本实验发现,FOXO1基因似乎有着相反的作用。从实验结果来看,上皮细胞来源的FOXO1能正向调节VEGF-A表达。分析其原因可能是来自不同细胞的FOXO1在不同的组织中对伤口愈合的作用机制不同,尚需进一步研究探讨。
综上所述,VEGF-A是调节血管生成和组织愈合的重要一员,其表达和转录的变化可能会影响伤口的愈合进程。同时,角质细胞中的FOXO1能够调节VEGF-A的表达,从而影响伤口愈合。本实验结果为进一步的研究提供了基础,未来我们拟在动物模型上皮中特异性敲除FOXO1,评价伤口中血管生成数量,成纤维细胞、肌成纤维细胞数量的变化,为本研究设想提供更全面的论证。
| [1] | McGRORY K, FLAITZ C M, KLEIN J R. Chemokine changes during oral wound healing[J]. Biochem Biophys Res Commun, 2004, 324: 317–320. DOI: 10.1016/j.bbrc.2004.09.056 |
| [2] | SHARMA A, SINGH A K, WARREN J, THANGAPAZHAM R L, MAHESHWARI R K. Differential regulation of angiogenic genes in diabetic wound healing[J]. J Invest Dermatol, 2006, 126: 2323–2331. DOI: 10.1038/sj.jid.5700428 |
| [3] | TANDARA A A, KLOETERS O, MOGFORD J E, MUSTOE T A. Hydrated keratinocytes reduce collagen synthesis by fibroblasts via paracrine mechanisms[J]. Wound Repair Regen, 2007, 15: 497–504. DOI: 10.1111/wrr.2007.15.issue-4 |
| [4] | NISSEN N N, POLÜERINI P J, KOCH A E, VOLIN M V, GAMELLI R L, DIPIETRO L A. Vascular endothelial growth factor mediates angiogenic activity during the proliferative phase of wound healing[J]. Am J Pathol, 1998, 152: 1445–1452. |
| [5] | SHIOTA N, NISHIKORI Y, KAKIZOE E, SHIMOURA K, NIIBAYASHI T, SHIMBORI C, et al. Pathophysiological role of skin mast cells in wound healing after scald injury: study with mast cell-deficient W/WV mice[J]. Int Arch Allergy Immunol, 2010, 151: 80–88. DOI: 10.1159/000232573 |
| [6] | KOH T J, DIPIETRO L A. Inflammation and wound healing: the role of the macrophage[J]. Expert Rev Mol Med, 2011, 13: e23. DOI: 10.1017/S1462399411001943 |
| [7] | CARTER M E, BRUNET A. FOXO transcription factors[J]. Curr Biol, 2007, 17: R113–R114. DOI: 10.1016/j.cub.2007.01.008 |
| [8] | MORI R, TANAKA K, DE KERCKHOVE M, OKAMOTO M, KASHIYAMA K, TANAKA K, et al. Reduced FOXO1 expression accelerates skin wound healing and attenuates scarring[J]. Am J Pathol, 2014, 184: 2465–2479. DOI: 10.1016/j.ajpath.2014.05.012 |
| [9] | PONUGOTI B, XU F, ZHANG C, TIAN C, PACIOS S, GRAVES D T. FOXO1 promotes wound healing through the up-regulation of TGF-β1 and prevention of oxidative stress[J]. J Cell Biol, 2013, 203: 327–343. DOI: 10.1083/jcb.201305074 |
| [10] | XU F, OTHMAN B, LIM J, BATRES A, PONUGOTI B, ZHANG C, et al. Foxo1 inhibits diabetic mucosal wound healing but enhances healing of normoglycemic wounds[J]. Diabetes, 2015, 64: 243–256. DOI: 10.2337/db14-0589 |
| [11] | ZHANG C, PONUGOTI B, TIAN C, XU F, TARAPORE R, BATRES A, et al. FOXO1 differentially regulates both normal and diabetic wound healing[J]. J Cell Biol, 2015, 209: 289–303. DOI: 10.1083/jcb.201409032 |
| [12] | ELLIS L M, HICKLIN D J. VEGF-targeted therapy: mechanisms of anti-tumour activity[J]. Nat Rev Cancer, 2008, 8: 579–591. DOI: 10.1038/nrc2403 |
| [13] | LEUNG D W, CACHIANES G, KUANG W J, GOEDDEL D V, FERRARA N. Vascular endothelial growth factor is a secreted angiogenic mitogen[J]. Science, 1989, 246: 1306–1309. DOI: 10.1126/science.2479986 |
| [14] | YOSHIDA A, ANAND-APTE B, ZETTER B R. Differential endothelial migration and proliferation to basic fibroblast growth factor and vascular endothelial growth factor[J]. Growth Factors, 1996, 13(1/2): 57–64. |
| [15] | SENGER D R, GALLI S J, DVORAK A M, PERRUZZI C A, HARVEY V S, DVORAK H F. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid[J]. Science, 1983, 219: 983–985. DOI: 10.1126/science.6823562 |
| [16] | BAO P, KODRA A, TOMIC-CANIC M, GOLINKO M S, EHRLICH H P, BREM H. The role of vascular endothelial growth factor in wound healing[J]. J Surg Res, 2009, 153: 347–358. DOI: 10.1016/j.jss.2008.04.023 |
| [17] | ROSSITER H, BARRESI C, PAMMER J, RENDL M, HAIGH J, WAGNER E F, et al. Loss of vascular endothelial growth factor a activity in murine epidermal keratinocytes delays wound healing and inhibits tumor formation[J]. Cancer Res, 2004, 64: 3508–3516. DOI: 10.1158/0008-5472.CAN-03-2581 |
| [18] | DETMAR M, YEO K T, NAGY J A, VAN DE WATER L, BROWN L F, BERSE B, et al. Keratinocyte-derived vascular permeability factor (vascular endothelial growth factor) is a potent mitogen for dermal microvascular endothelial cells[J]. J Invest Dermatol, 1995, 105: 44–50. DOI: 10.1111/1523-1747.ep12312542 |
| [19] | BROWN L F, YEO K T, BERSE B, YEO T K, SENGER D R, DVORAK H F, et al. Expression of vascular permeability factor (vascular endothelial growth factor) by epidermal keratinocytes during wound healing[J]. J Exp Med, 1992, 176: 1375–1379. DOI: 10.1084/jem.176.5.1375 |
| [20] | MIRZA R E, KOH T J. Contributions of cell subsets to cytokine production during normal and impaired wound healing[J]. Cytokine, 2015, 71: 409–412. DOI: 10.1016/j.cyto.2014.09.005 |
| [21] | BREM H, KODRA A, GOLINKO M S, ENTERO H, STOJADINOVIC O, WANG V M, et al. Mechanism of sustained release of vascular endothelial growth factor in accelerating experimental diabetic healing[J]. J Invest Dermatol, 2009, 129: 2275–2287. DOI: 10.1038/jid.2009.26 |
| [22] | JOHNSON K E, WILGUS T A. Vascular endothelial growth factor and angiogenesis in the regulation of cutaneous wound repair[J]. Adv Wound Care (New Rochelle), 2014, 3: 647–661. DOI: 10.1089/wound.2013.0517 |
| [23] | POTENTE M, URBICH C, SASAKI K, HOFMANN W K, HEESCHEN C, AICHER A, et al. Involvement of Foxo transcription factors in angiogenesis and postnatal neovascularization[J]. J Clin Invest, 2005, 115: 2382–2392. DOI: 10.1172/JCI23126 |
| [24] | SRIVASTAVA R K, UNTERMAN T G, SHANKAR S. FOXO transcription factors and VEGF neutralizing antibody enhance antiangiogenic effects of resveratrol[J]. Mol Cell Biochem, 2010, 337: 201–212. DOI: 10.1007/s11010-009-0300-5 |
 2017, Vol. 38
2017, Vol. 38


