肺泡巨噬细胞 (alveolar macrophage,AM) 是由单核细胞迁移至肺组织中发育而成,是呼吸道防御致病微生物的第一道防线。作为一种重要的炎性细胞,AM主要通过分泌炎性因子、趋化因子在急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS) 中发挥其炎性效应[1]。
MicroRNA (miRNA) 是一类长度约为22个核苷酸的非编码单链小分子RNA,主要通过结合靶基因的3′-UTR抑制下游基因的转录,是基因表达的重要调控者,可以调控细胞生理过程的各个方面[2-3]。有研究表明,miRNA可以调节免疫、免疫细胞的增殖和分化及抗体生成,是炎性介质发挥炎性作用的关键因子[4-5]。作为miRNA的一员,miRNA-142-3p (miR-142-3p) 在炎性疾病的发生、发展中也起到了重要作用,IPA、Targetscan等网站预测miR-142-3p可调控高迁移率族蛋白B1(high-mobility group box 1, HMGB1)。HMGB1是一种新发现的晚期炎性细胞因子,能刺激其他炎症因子如白介素 (IL)-1β、IL-6和IL-8等的释放,在炎症反应中具有重要作用。研究发现,在非小细胞肺癌及神经母细胞瘤中,HMGB1受miR-142-3p的调控[6-7];Kanaan等[8]在脂多糖 (lipopolysaccharide, LPS) 诱导的小鼠腹膜炎模型中发现,HMGB1表达与miR-142-3p呈负相关;而在ARDS的发生和发展中,有关miR-142-3p与HMGB1调控关系的研究尚未见报道。本研究通过LPS体外诱导大鼠AM产生炎症反应,在细胞内导入miR-142-3p拟似物 (miR-142-3p mimic) 上调miR-142-3p的表达,采用实时定量PCR (qPCR) 及酶联免疫吸附测定 (ELISA) 等方法检测miR-142-3p的表达量和HMGB1的含量,进一步研究LPS体外诱导的大鼠AM的炎症反应模型中miR-142-3p对HMGB1表达的调控及其分子机制。
1 材料和方法 1.1 实验材料大鼠AM NR8383细胞 (中国科学院上海细胞库),F12K细胞培养液、Lipofectamine 2000、DMEM培养液 (Life Technology),胰酶 (碧云天生物技术研究所),D-PBS (Life Science Products),胎牛血清 (FBS,Gibco),LPS (Sigma),平底6孔、24孔细胞培养板 (Corning),鼠HMGB1 ELISA试剂盒 (上海信然生物有限公司),qPCR试剂 (Promega),miR-142-3p mimic (上海锐博生物有限公司,序列:5′-UGU AGU GUU UCC UAC UUU AUG GA-3′, 编号MIMAT0000848),抗HMGB1抗体、抗β-actin抗体 (Abcam)。
1.2 LPS体外诱导大鼠AM炎症反应使用F12K完全培养液培养大鼠AM NR8383细胞,收集对数生长期细胞,将细胞以1×106/mL的密度接种于6孔板,每孔2 mL,37 ℃、5%CO2培养箱中培养1 h。分别用100 ng/mL的LPS刺激细胞0、6、24、48 h后收集上清液和细胞。每组设3个复孔。
1.3 qPCR检测细胞中miR-142-3p和HMGB1的表达细胞经相应处理后,PBS漂洗3次,按QIAGEN试剂盒说明书抽提细胞miRNA,并按反转录试剂盒 (天晶生物) 说明书进行RNA反转录;反转录产物行qPCR扩增,U6作为内参,测定各基因的相对表达量。miR-142-3p上游引物为:5′-TGT AGT GTT TCC TAC TTT ATG GA-3′,下游引物为:5′-CCA GTG CAG GGT CCG AGG T-3′;HMGB1上游引物为:5′-GCC TCC TTC GGC CTT CTT CT-3′,下游引物为:5′-TCA GCT TGG CGG CCT TCT TT-3′;U6上游引物为:5′-CTC GCT TCG GCA GCA CA-3′, 下游引物为:5′-AAC GCT TCA CGA ATT TGC GT-3′。
1.4 ELISA法测定上清液中HMGB1的含量细胞经相应处理后,收集细胞培养液,离心取上清,按照HMGB1 ELISA试剂盒说明书检测上清液中HMGB1的含量。
1.5 蛋白质印迹法检测细胞中HMGB1蛋白的表达细胞经相应的处理后,PBS漂洗3次,按文献[9]所述方法操作,多功能成像系统成像、拍照,使用Quantity One软件进行结果分析。
1.6 细胞转染miR-142-3p mimic取对数生长期细胞,用F12K完全培养液调整细胞密度为2×106/mL,接种于24孔板中,每孔0.5 mL。37 ℃培养箱中孵育1 h,将lipo2000混合液 (lipofectamine 2000 2 μL + OMEM 48 μL) 和mimic混合液 (miR-142-3p mimic 2.5 μL + OMEM 47.5 μL、miR-142-3p mimic 0 μL + OMEM 47.5 μL) 混合均匀后加入到24孔板中,每孔50 μL,37 ℃培养箱中孵育24 h,用100 ng/mL的LPS刺激细胞0、6、24、48 h后分别收集上清液和细胞。
1.7 qPCR检测AM中肿瘤坏死因子α (tumor necrosis factor α,TNF-α)、IL-6、IL-1β和巨噬细胞炎症蛋白2β(macrophage inflammatory protein-2β,MIP-2β) mRNA的表达按照1.3项下方法测定各炎症因子的表达水平。TNF-α上游引物为:5′-ACC AGC AGA TGG GCT GTA CC-3′,下游引物为:5′-TGG GCT CAT ACC AGG GCT TG-3′;IL-6上游引物为:5′-GCC ACT CAC CTC TTC AGA ACG-3′,下游引物为:5′-CAG TGC CTC TTT GCT GCT TTC-3′;IL-1β上游引物为:5′-GGG AAG AAT CTA TAC CTG TCC-3′,下游引物为:5′-TGC TCT GCT TGA GAG GTG CT-3′;MIP-2β上游引物为:5′-CCA CTC GCC AGC TCC TCA AT-3′,下游引物为:5′-CCC TGT ACC CTG ATG GTT GGT-3′。
1.8 统计学处理应用SPSS 21.0软件进行数据分析,实验重复3次。所有计量资料以x±s表示,两组间比较采用t检验。检验水准 (α) 为0.05。
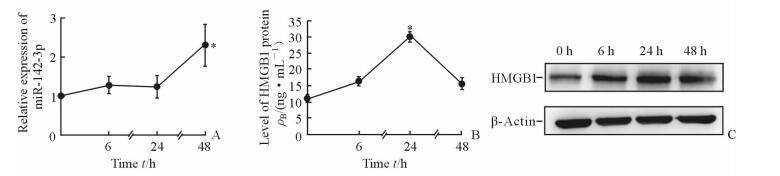
2 结果 2.1 LPS诱导miR-142-3p及HMGB1的表达与0 h时相比,LPS刺激后6、24、48 h时miR-142-3p在AM NR8383细胞中的表达均升高;在48 h时达到高峰,与0 h时相比差异有统计学意义 (P < 0.05,图 1A)。HMGB1的表达随LPS刺激时间的延长而逐渐升高,在24 h时达到高峰,与0 h时相比差异有统计学意义 (P < 0.05,图 1B、1C),而在48 h时又下降到一定水平。
|
图 1 LPS处理后AM NR8383细胞中miR-142-3p (A) 和HMGB1(B, C) 的表达水平及与时间的效应关系 Fig 1 Relationship between time effect and expressions of miR-142-3p (A) and HMGB1 (B, C) in AM NR8383 cells stimulated with LPS LPS: Lipopolysaccharide; AM: Alveolar macrophage; HMGB1: High-mobility group box 1. *P < 0.05 vs 0 h. n=3, x±s |
2.2 miR-142-3p下调HMGB1的表达
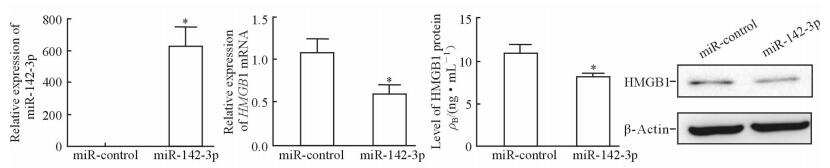
在大鼠AM NR8383细胞中转染miR-142-3p mimic后,检测NR8383细胞中HMGB1 mRNA的表达水平和细胞培养液及细胞中HMGB1蛋白的表达水平。结果 (图 2) 显示,转染miR-142-3p mimic后,NR8383细胞中miR-142-3p的表达升高 (P < 0.05),而HMGB1 mRNA及蛋白的表达均降低 (P < 0.05)。
|
图 2 miR-142-3p对AM NR8383细胞HMGB1表达的影响 Fig 2 Effect of miR-142-3p on HMGB1 expression in AM NR8383 cells AM: Alveolar macrophage; HMGB1: High-mobility group box 1. *P < 0.05 vs miR-control group. n=3, x±s |
2.3 LPS诱导的AM中miR-142-3p负向调控HMGB1的表达
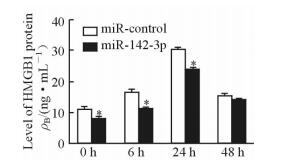
转染miR-142-3p mimic 24 h后,加入LPS分别诱导AM 0、6、24、48 h,用ELISA试剂盒检测转染组和未转染组上清中HMGB1的含量。结果 (图 3) 显示,培养0、6、24 h时miR-142-3p mimic转染组中HMGB1的含量均低于未转染组 (P < 0.05)。表明过表达miR-142-3p能够负向调控HMGB1的表达水平。
|
图 3 miRNA-142-3p负向调控HMGB1的表达 Fig 3 miRNA-142-3p downregulates expression of HMGB1 protein HMGB1: High-mobility group box 1. *P < 0.05 vs miR-control group. n=3, x±s |
2.4 LPS诱导的AM中miR-142-3p下调炎症因子mRNA的表达
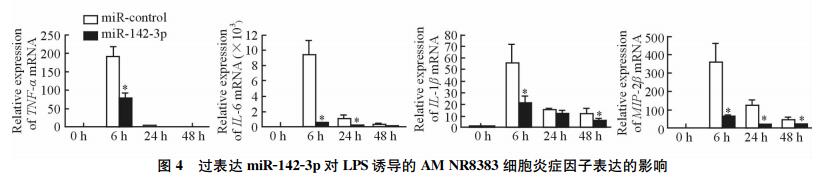
大鼠AM转染miR-142-3p mimic后,分别加入LPS诱导AM 0、6、24、48 h,qPCR检测AM中TNF-α、IL-6、IL-1β和MIP-2β mRNA的表达水平。结果 (图 4) 显示,与未转染组相比,转染miR-142-3p mimic后NR8383细胞中TNF-α、IL-6、IL-1β以及MIP-2β mRNA的表达水平均降低,差异有统计学意义 (P < 0.05)。
|
图 4 过表达miR-142-3p对LPS诱导的AM NR8383细胞炎症因子表达的影响 Fig 4 Influence of miR-142-3p overexpression on inflammatory factors in AM NR8383 cells stimulated with LPS LPS: Lipopolysaccharide; AM: Alveolar macrophage; TNF-α: Tumor necrosis factor-α; IL-6: Interleukin-6; IL-1β: Interleukin-1β; MIP-2β: Macrophage inflammatory protein-2β. *P < 0.05 vs miR-control group. n=3, x±s |
3 讨论
ARDS是由肺内外因素引起的毛细血管内皮细胞弥漫性受损,可出现肺水肿及肺不张等不良表现[10],表现为顽固性低氧血症,进而出现多器官功能衰竭。ARDS临床病死率高,且发生和发展过程复杂,发病机制尚未完全阐明。有研究表明,ARDS的发生和发展与炎症反应、水通道蛋白、凝血/纤溶系统失衡、肺细胞 (AM、肺泡上皮细胞等) 凋亡等有关[11-14],而在众多机制中,炎性反应可能是其发病机制的“中心环节”[11]。研究发现,miRNA在炎症反应中具有重要的生物学功能,其中miR-142-3p已经被证实在小鼠的基底膜、脾脏及胸腺中均有表达,特别是在B细胞亚群和T细胞亚群中高表达[15-16]。此外,在LPS诱导树突细胞建立的炎症模型中,miR-142-3p的表达明显上升[17],提示miR-142-3p在炎症发展中可能具有重要作用,但其对炎症因子的影响机制尚不明确。有研究发现,在感染牛结核杆菌的巨噬细胞中,miR-142-3p可通过调控IRAK-1基因的表达抑制炎症因子 (TNF-α、IL-1、IL-8) 的表达[18]。HMBG1是一种非组蛋白核蛋白,可在大多数真核细胞的胞质、胞核中表达,而在AM胞核中的表达仅维持在基础水平;在炎症反应过程中,HMGB1可作为一种重要的炎症介质促进免疫细胞 (淋巴细胞、树突细胞、单核巨噬细胞等) 分泌炎性因子 (TNF-α、IL-1、IL-8等)[19-20]。Li等[21]发现在呼吸机及脓毒症引起的肺损伤中,HMGB1可通过诱导线粒体氧化性损伤和增加肺内皮细胞通透性加重肺损伤。Jiang等[22]发现,在LPS诱导的小鼠ALI/ARDS模型中,HMGB1的表达明显增加,表明HMGB1可能参与LPS诱导的ALI/ARDS的发病机制。
本研究通过LPS体外诱导大鼠AM产生炎症反应,并检测了miR-142-3p的表达情况,结果显示LPS刺激后miR-142-3p的表达上升,且在48 h时达到高峰。在LPS诱导的大鼠AM中转染miR-142-3p mimic上调miR-142-3p的表达后,与未转染组相比,miR-142-3p过表达组细胞中各种炎症细胞因子 (TNF-α、IL-6、IL-1β和MIP-2β) mRNA的表达均显著下降,表明miR-142-3p参与了LPS诱导的AM的炎症反应过程。Kanaan等[8]研究发现,在LPS诱导的小鼠腹膜炎模型中,刺激24 h和48 h后miR-142-3p的表达均升高,而HMGB1的表达降低,表明HMGB1与miR-142-3p呈负相关。为探究miR-142-3p调控LPS诱导的AM炎症反应过程的具体机制,本实验检测了LPS处理后不同时间点HMGB1蛋白的表达情况,结果显示,LPS刺激6 h后HMGB1的表达略微增加,至24 h时达到高峰,而至48 h时又下降到一定水平,表明miR-142-3p可能负向调控HMGB1的表达。为验证这一推测,本研究在大鼠AM中转染miR-142-3p mimic上调细胞中miR-142-3p表达,然后使用LPS分别诱导转染组和非转染组,检测LPS诱导的大鼠AM中过表达miR-142-3p对HMGB1 mRNA和蛋白的调控作用,结果显示与未转染组相比,miR-142-3p过表达组细胞中HMGB1 mRNA和蛋白的表达均显著下降。但miR-142-3p对HMGB1的影响机制尚不明确。有研究发现,miRNA可通过调控TRAF6和IRAK1等激活TLR4下游信号,从而促进TNF-α、IL-6、IL-1β等炎症因子大量释放,导致炎症反应加重[23]。Qi等[24]发现,在鼠巨噬细胞体外实验中,上调miRNA的表达可负向调控NF-κB1的表达,减少炎症因子分泌,而下调miRNA的表达可正向调控NF-κB1表达,增加炎症因子分泌。研究表明,在缺氧/复氧诱导的小鼠心肌细胞中过表达miR-142-3p和抑制HMGB1基因的表达都可以抑制TGF-β1/Smad3信号通路,表明miR-142-3p可能通过TGF-β1/Smad3信号通路负向调控HMGB1[25]。Wang等[26]研究发现,在小鼠骨关节炎模型中,miR-142-3p抑制HMGB1的表达后,NF-κB通道信号减弱,提示miR-142-3p通过TGF-β1/Smad3信号通路负向调控HMGB1。miRNA调控基因表达及信号传导通路的机制复杂,单个miRNA可能调控多个靶基因,单个靶基因可能需要多个miRNA调控;同时,同一miRNA在不同细胞中也可能调控不同靶基因。
综上所述,本研究表明在利用有效浓度的LPS体外诱导大鼠AM的炎症反应过程中,miR-142-3p可能是通过负向调控HMGB1的表达发挥对炎症反应的干预作用。因此,miR-142-3p有可能成为ARDS的治疗靶点。但是本实验还存在不足之处,即miR-142-3p负向调控HMGB1的具体机制尚不明确,还需进一步的探讨和研究。
| [1] | GORDON S, PLÜDDEMANN A, MARTINEZ ESTRADA F. Macrophage heterogeneity in tissues: phenotypic diversity and functions[J]. Immunol Rev, 2014, 262: 36–55. DOI: 10.1111/imr.2014.262.issue-1 |
| [2] | TOCHIGI H, KAJIHARA T, MIZUNO Y, MIZUNO Y, TAMARU S, KAMEI Y, et al. Loss of miR-542-3p enhances IGFBP-1 expression in decidualizing human endometrial stromal cells[J]. Sci Rep, 2017, 7: 40001. DOI: 10.1038/srep40001 |
| [3] | GUPTA S, VERMA S, MANTRI S, BERMAN N E, SANDHIR R. Targeting microRNAs in prevention and treatment of neurodegenerative disorders[J]. Drug Develop Res, 2015, 76: 397–418. DOI: 10.1002/ddr.v76.7 |
| [4] | TANG S T, WANG F, SHAO M, WANG Y, ZHU H Q. MicroRNA-126 suppresses inflammation in endothelial cells under hyperglycemic condition by targeting HMGB1[J]. Vasc Pharmacol, 2016, 88: 48–55. |
| [5] | YU A, ZHANG T, ZHONG W, DUAN H, WANG S, YE P, et al. MiRNA-144 induces microglial autophagy and inflammation following intracerebral hemorrhage[J]. Immunol Lett, 2017, 182: 18–23. DOI: 10.1016/j.imlet.2017.01.002 |
| [6] | XIAO P, LIU W L. MiR-142-3p functions as a potential tumor suppressor directly targeting HMGB1 in non-small-cell lung carcinoma[J]. Int J Clin Exp Pathol, 2015, 8: 10800–10807. |
| [7] | 周显军, 陈军, 沈峰, 段于河, 耿耿, 李晓, 等. miR-142-3p调控高迁移率族蛋白1及对神经母细胞瘤顺铂化疗敏感性的影响[J]. 中华小儿外科杂志, 2015, 36: 466–471. DOI: 10.3760/cma.j.issn.0253-3006.2015.06.015 |
| [8] | KANAAN Z, BARNETT R, GARDNER S, KESKEY B, DRUEN D, BILLETER A, et al. Differential microRNA (miRNA) expression could explain microbial tolerance in a novel chronic peritonitis model[J]. Innate Immun, 2013, 19: 203–212. DOI: 10.1177/1753425912460557 |
| [9] | HUANG L, WANG H, ZHOU Y, NI D, HU Y, LONG Y, et al. Apobec-1 complementation factor (A1CF) inhibits epithelial-mesenchymal transition and migration of normal rat kidney proximal tubular epithelial cells[J]. Int J Mol Sci, 2016, 17. pii: E197. DOI: 10.3390/ijms17020197 |
| [10] | GRIFFITHS M, PROUDFOOT A. ARDS, up close and personal[J]. Thorax, 2016, 71: 1130–1136. DOI: 10.1136/thoraxjnl-2015-207886 |
| [11] | JIANG Y, ZENG Y, HUANG X, QIN Y, LUO W, XIANG S, et al. Nur77 attenuates endothelin-1 expression via downregulation of NF-κB and p38 MAPK in A549 cells and in an ARDS rat model[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 311: L1023–L1035. DOI: 10.1152/ajplung.00043.2016 |
| [12] | SEBAG S C, BASTARACHE J A, WARE L B. Therapeutic modulation of coagulation and fibrinolysis in acute lung injury and the acute respiratory distress syndrome[J]. Curr Pharm Biotechnol, 2011, 12: 1481–1496. DOI: 10.2174/138920111798281171 |
| [13] | Z'GRAGGEN B R, TORNIC J, MÜLLER-EDENBORN B, REYES L, BOOY C, BECK-SCHIMMER B. Acute lung injury: apoptosis in effector and target cells of the upper and lower airway compartment[J]. Clin Exp Immunol, 2010, 161: 324–331. |
| [14] | 陈春玲, 李涛平, 朱丽华. MAPKs信号阻断剂U0126对油酸致急性肺损伤大鼠肺泡Ⅱ型上皮细胞中AQP4表达的影响[J]. 南方医科大学学报, 2009, 29: 1525–1528. DOI: 10.3321/j.issn:1673-4254.2009.08.003 |
| [15] | LU X, LI X, HE Q, GAO J, GAO Y, LIU B, et al. MiR-142-3p regulates the formation and differentiation of hematopoietic stem cells in vertebrates[J]. Cell Res, 2013, 23: 1356–1368. DOI: 10.1038/cr.2013.145 |
| [16] | WANG X S, GONG J N, YU J, WANG F, ZHANG X H, YIN X L, et al. MicroRNA-29a and microRNA-142-3p are regulators of myeloid differentiation and acute myeloid leukemia[J]. Blood, 2012, 119: 4992–5004. DOI: 10.1182/blood-2011-10-385716 |
| [17] | SUN Y, VARAMBALLY S, MAHER C A, CAO Q, CHOCKLEY P, TOUBAI T, et al. Targeting of microRNA-142-3p in dendritic cells regulates endotoxin-induced mortality[J]. Blood, 2011, 117: 6172–6183. DOI: 10.1182/blood-2010-12-325647 |
| [18] | XU G, ZHANG Z, WEI J, ZHANG Y, ZHANG Y, GUO L, et al. MicroR-142-3p down-regulates IRAK-1 in response to Mycobacterium bovis, BCG infection in macrophages[J]. Tuberculosis (Edinb), 2013, 93: 606–611. DOI: 10.1016/j.tube.2013.08.006 |
| [19] | YANG Q W, LU F L, ZHOU Y, WANG L, ZHONG Q, LIN S, et al. HMBG1 mediates ischemia-reperfusion injury by TRIF-adaptor independent Toll-like receptor 4 signaling[J]. J Cerebr Blood F Met, 2011, 31: 593–605. DOI: 10.1038/jcbfm.2010.129 |
| [20] | THINSCHMIDT J S, COLON-PEREZ L M, FEBO M, CABALLERO S, KING M A, WHITE F A, et al. Depressed basal hypothalamic neuronal activity in type-1 diabetic mice is correlated with proinflammatory secretion of HMBG1[J]. Neurosci Lett, 2016, 615: 21–27. DOI: 10.1016/j.neulet.2016.01.014 |
| [21] | LI K, YANG J, HAN X. Ketamine attenuates sepsis-induced acute lung injury via regulation of HMGB1-RAGE pathways[J]. Int Immunopharmacol, 2016, 34: 114–128. DOI: 10.1016/j.intimp.2016.01.021 |
| [22] | JIANG Z L, ZHOU Q L, GU C L, LI D D, ZHU L. Depletion of circulating monocytes suppresses IL-17 and HMGB1 expression in mice with LPS-induced acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 312: L231–L242. DOI: 10.1152/ajplung.00389.2016 |
| [23] | SABA R, GUSHUE S, HUZAREWICH R L, MANGUIAT K, MEDINA S, ROBERTSON C, et al. MicroRNA 146a (miR-146a) is over-expressed during prion disease and modulates the innate immune response and the microglial activation state[J]. PLoS One, 2012, 7: e30832. DOI: 10.1371/journal.pone.0030832 |
| [24] | QI J, QIAO Y, WANG P, LI S Q, ZHAO W, GAO C. MicroRNA-210 negatively regulates LPS-induced production of proinflammatory cytokines by targeting NF-κB1 in murine macrophages[J]. FEBS Lett, 2012, 586: 1201–1207. DOI: 10.1016/j.febslet.2012.03.011 |
| [25] | WANG Y, OUYANG M, WANG Q, JIAN Z J. MicroRNA-142-3p inhibits hypoxia/reoxygenation-induced apoptosis and fibrosis of cardiomyocytes by targeting high mobility group box 1[J]. Int J Mol Med, 2016, 38: 1377–1386. |
| [26] | WANG X Q, GUO Y Q, WANG C Y, YU H, YU X X, YU H. MicroRNA-142-3p inhibits chondrocyte apoptosis and inflammation in osteoarthritis by targeting HMGB1[J]. Inflammation, 2016, 39: 1718–1728. DOI: 10.1007/s10753-016-0406-3 |
 2017, Vol. 38
2017, Vol. 38


