2. 重庆医科大学附属第一医院妇产科, 重庆 400016
2. Department of Obstetrics and Gynecology, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
妊娠期高血压疾病是妊娠期常见的并发症之一,在我国发病率为5%~12%, 国外的发病率大约为7%~10%,是一类以高血压和蛋白尿为主要特征的疾病,严重时可伴有全身多器官功能损害或衰竭[1]。该疾病严重影响母婴健康,是导致孕产妇和围生儿病死率升高、胎儿宫内生长受限等不良妊娠结局的主要原因之一[2-3]。研究认为子痫前期存在绒毛滋养细胞侵袭不良,进而影响“血管重铸”,导致胎盘缺血缺氧[2, 4]。
腺苷是腺嘌呤核苷酸的代谢产物和合成前体[5],在人体广泛分布。研究表明缺氧可以刺激机体释放腺苷,参与多种组织生理和病理变化过程[6-7]。在子痫前期和胎儿宫内生长受限孕妇的血浆中都可检测出腺苷浓度升高[8]。腺苷通过与腺苷受体 (adenosine receptor,AR) 结合发挥作用。AR是位于细胞膜上的G蛋白偶联受体,分为A1、A2A、A2B、A3 4种亚型[9-10]。4种亚型在胎盘组织中均有表达,且在子痫前期患者胎盘中的表达较正常孕妇胎盘均增高[11]。研究证明缺氧的滋养细胞中A2BR表达增高,加入AR激动剂可以增加环磷酸腺苷 (cAMP) 的表达水平,并增加滋养细胞的增殖和侵袭能力[12]。目前对A2R在子痫前期的表达、产生的生物学效应以及机制的研究较多,对A1R在滋养细胞中的作用尚不明确。本研究旨在阐明A1R是否参与了缺氧时胎盘功能的改变及其机制,以进一步了解妊娠期高血压疾病的发病机制。
1 材料和方法 1.1 筛选对象选择2013年3月至10月在重庆医科大学附属第二医院产科行剖宫产结束分娩的产妇共35例,经过产后随访,共选实验组20例,对照组15例。实验组孕妇包括妊娠期高血压6例、轻度子痫前期10例、重度子痫前期4例,妊娠期高血压、轻度以及重度子痫前期诊断标准参照《妇产科学》(第8版)[1]。所选病例均排除慢性高血压合并子痫前期、妊娠合并慢性高血压、妊娠期肝内胆汁淤积症、妊娠期糖尿病以及其他内科合并症。对照组孕妇系因社会因素、头盆不称、瘢痕子宫等因素行剖宫产。研究方案符合人体试验伦理学标准,并得到重庆医科大学附属第二医院伦理委员会的批准,所有研究对象均知情同意。
1.2 细胞和主要试剂HTR-8/SVneo滋养层细胞由加拿大皇后大学Charles H. Graham博士以及重庆医科大学附属第一医院妇产科漆洪波教授惠赠。兔抗人A1R第一抗体购自英国Abcam公司;胎牛血清 (FBS) 购自美国Gibco公司;RPMI 1640培养基购自美国Hyclone公司;异硫氰酸荧光素标记IgG购自美国Invitrogen公司;抗荧光淬灭封片液、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术公司;免疫组化染色试剂盒购自北京中杉金桥生物技术公司;ECL发光试剂盒购自南京凯基生物技术公司;A1R拮抗剂8-环戊基-1,3-二丙基黄嘌呤 (8-cyclopentyl-1, 3-dipropylxanthine, DPCPX) 购自美国Tocris公司;蛋白激酶A (PKA) 抗体购自北京博奥森生物技术公司;ADORA1引物 (HQP002799) 购自广州复能基因科技公司;高纯总RNA快速提取试剂盒购自北京百泰克生物技术公司;RNA反转录试剂盒购自美国Bio-Rad公司;Matrigel基质胶购自美国BD公司;Transwell小室购自美国Millipore公司。
1.3 免疫荧光方法检测胎盘组织中A1R的表达标本石蜡包埋固定后切片,常规脱蜡、水化后,PBS清洗3次,3%H2O2室温封闭,柠檬酸盐缓冲液微波修复抗原,滴加正常山羊血清封闭液后,加入1:100稀释的兔抗人A1R单克隆抗体,4 ℃过夜。滴加1:1 000异硫氰酸荧光素二抗,37 ℃孵育20 min,PBS 3 min清洗3次 (避光)。滴加DAPI避光孵育5 min,对标本进行核染色;抗荧光淬灭封片液封片,免疫荧光显微镜下观察结果并照相,设立Polyclonal Rabbit Albumin/FITC作为对照,排除非特异性荧光染色。
1.4 蛋白质印迹法检测不同类型胎盘组织中A1R的表达高速机械匀浆器将组织打碎,提取细胞总蛋白, BCA蛋白测定试剂盒测定蛋白浓度。取30 μg蛋白进行10% SDS-PAGE, 然后将蛋白转至PVDF膜上。用5%脱脂牛奶封闭2 h, 4 ℃过夜孵育一抗A1R (1:1 000)、β-actin (1:800), 洗膜。常温孵育二抗1 h, 洗膜。用ECL化学发光检测试剂盒发光显影。
1.5 建立胎盘滋养细胞缺氧及缺氧复氧模型HTR-8/SVneo细胞培养于含青霉素100 U/mL、链霉素100 μg/mL及10%FBS的RPMI 1640完全培养液中,细胞共分为6组,分别是常氧组、8 h缺氧组、8 h缺氧复氧组、24 h缺氧组、48 h缺氧组、72 h缺氧组。常氧时放置于37 ℃、5% CO2细胞培养箱孵育,缺氧时于37 ℃、5% CO2、93% N2细胞培养箱内孵育,培养总时长一致。
1.6 qPCR检测模型中A1R mRNA的表达水平收集各组细胞,按照RNA快速提取试剂盒的说明提取总RNA。采用RNA反转录试剂盒合成cDNA。qPCR检测mRNA水平。以β-actin作为内参照同时扩增。引物均由广州复能基因科技公司设计、合成并进行验证。反应结束后用软件自动分析,获得每个样品的Ct值。所有实验重复3次,取每个样品的平均Ct值进行分析。以β-actin作为内参照,用2-ΔΔCt方法分析基因表达的相对变化结果。
1.7 蛋白质印迹法检测模型中A1R蛋白的表达水平收集细胞进行裂解, 提取细胞总蛋白, 其余方法同1.4项。
1.8 Transwell检测细胞侵袭能力的变化缺氧拮抗剂组加入10 μmol/L DPCPX,与正常组一起放入37 ℃、5% CO2、93% N2细胞培养箱内预处理。正常组中不加DPCPX,置于含5% CO2、37 ℃细胞培养箱内培养。将处理后的HTR-8/SVneo细胞用胰酶消化, 无血清培养液混悬, 稀释至浓度5×105/mL。加入细胞悬液前, 先于Transwell上室中加入1:4稀释好的Matrigel基质胶50 μL, 覆盖聚碳脂膜, 置于37 ℃培养箱中过夜, 然后于下室中加入500 μL含10% FBS的RPMI 1640培养液培养。于细胞孵育48 h后从敷箱中取出小室, 弃去上室中的培养液, 用棉签擦去小室上层细胞。然后将小室放入4%多聚甲醛固定10 min, PBS漂洗3次; 结晶紫染色20 min, 清水洗净背景色,取下小室后树胶封片。再于倒置显微镜 (×200) 下每孔随机观察3个视野, 计数细胞并照相。
1.9 蛋白质印迹法检测PKA的表达变化细胞共分为3组,分别是常氧组、缺氧组、缺氧+DPCPX组。DPCPX的浓度为10 nmol/L。将常氧组细胞置于37 ℃、5% CO2细胞培养箱中培养48 h。将缺氧组、缺氧+ DPCPX组细胞置于37 ℃、5% CO2、93% N2细胞培养箱内孵育48 h。收集细胞进行裂解,提取细胞总蛋白, 其余方法同1.4项下。
1.10 统计学处理采用SPSS 17.0软件进行数据分析,多组实验数据统计时采用单因素方差分析 (one-way ANOVA检验)。所有数据以x±s表示,检验水准 (α) 为0.05。
2 结果 2.1 各组孕妇一般资料实验组孕妇年龄为23~37(28.2±4.3) 岁,孕36.4~39.0(37.6±1.2) 周。对照组孕妇年龄为22~42(29.1±5.4) 岁,孕37.5~40.2(38.5±2.1) 周。两组孕妇的年龄和孕周差异均无统计学意义 (P > 0.05)。
2.2 A1R在正常胎盘组织中的表达部位免疫荧光检测结果提示A1R主要在胎盘滋养细胞以及血管内皮细胞中表达,且分布在细胞膜上,见图 1。

|
图 1 免疫荧光检测A1R表达位置 Fig 1 Adenosine A1 receptor (A1R) expression location by immunofluorescence assay A, D: The sections of normal placenta stained with antibody against A1R (red); B, E: Nucleus (blue); C, F: Merge. Arrows in A and D point to the location of A1R in the trophoblast cells and vascular endothelial cells, respectively. Original magnification: ×200 |
2.3 A1R在妊娠期高血压以及轻度和重度子痫前期胎盘组织中的表达水平
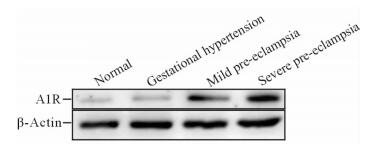
与正常胎盘相比,轻度子痫前期以及重度子痫前期的胎盘组织中A1R蛋白表达上升 (2.66±0.80 vs 0.93±0.39,P < 0.01;3.74±0.57 vs 0.93±0.39,P < 0.01)。然而,妊娠期高血压的胎盘组织中A1R蛋白的表达与正常胎盘相比差异无统计学意义 (P > 0.05),见图 2。
|
图 2 蛋白质印迹法检测胎盘组织中A1R的表达 Fig 2 Expression of adenosine A1 receptor (A1R) in placenta tissues by Western blotting analysis |
2.4 A1R mRNA和蛋白在不同缺氧程度胎盘滋养细胞模型中的表达
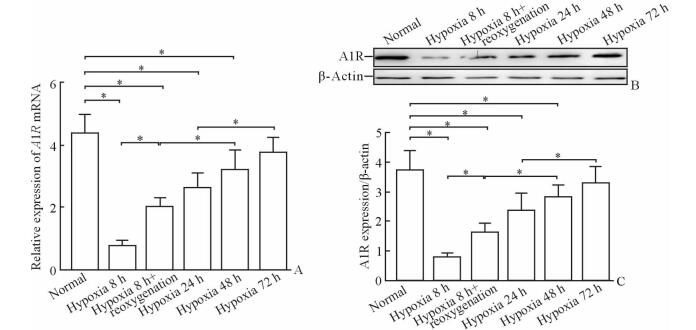
8 h缺氧、8 h缺氧复氧、24 h缺氧、48 h缺氧模型中A1R mRNA和蛋白的表达较常氧组均降低 (P < 0.05),72 h缺氧组与常氧组相比差异无统计学意义 (P > 0.05)。另外,8 h缺氧复氧较8 h缺氧、48 h缺氧较8 h缺氧复氧、72 h缺氧较24 h缺氧模型中A1R mRNA和蛋白的表达升高 (P < 0.05),见图 3。
|
图 3 实时定量PCR (A) 和蛋白质印迹法 (B, C) 检测缺氧和缺氧复氧模型细胞中A1R的表达 Fig 3 Expression of adenosine A1 receptor (A1R) of HTR-8/SVneo cells in hypoxia and hypoxia-reoxygenation models by real-time quantitative PCR (A) and Western blotting analysis (B, C) *P < 0.05. n=3, x±s |
2.5 胎盘滋养细胞缺氧模型中以及加入DPCPX后滋养细胞侵袭性的改变
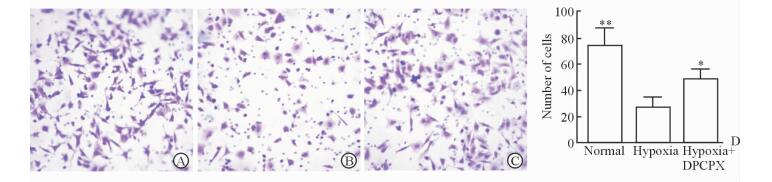
缺氧模型中滋养细胞的侵袭能力较正常组降低 (P < 0.01),但是加入A1R拮抗剂DPCPX后其侵袭能力上升 (P<0.05),见图 4。
|
图 4 HTR-8/SVneo细胞在正常、缺氧模型以及缺氧+DPCPX组中侵袭的变化 Fig 4 Invasion ability of HTR-8/SVneo in normal, hypoxia and hypoxia+DPCPX groups by Transwell assay A: Normal group; B: Hypoxia group; C: Hypoxia+DPCPX group; D: Number of cells in the 3 groups. DPCPX: 8-Cyclopentyl-1, 3-dipropylxanthine. *P < 0.05, **P < 0.01 vs hypoxia group. n=3, x±s. Original magnification: ×200 (A-C) |
2.6 胎盘滋养细胞缺氧模型中加入DPCPX后PKA的表达变化
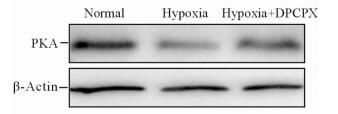
缺氧模型中PKA的表达量较正常组降低 (0.47±0.18 vs 1.80±0.52,P<0.05),但是加入DPCPX后其表达上升 (1.28±0.26 vs 0.47±0.18,P<0.05),见图 5。
|
图 5 蛋白质印迹法检测PKA在正常、缺氧模型以及缺氧+DPCPX组中的表达 Fig 5 Western blotting analysis for protein kinase A (PKA) expression of normal, hypoxia and hypoxia+DPCPX groups |
3 讨论
妊娠期高血压及子痫前期的发病机制目前尚不完全明确,普遍认为是由于绒毛滋养细胞侵袭不良影响“血管重铸”,导致血管内皮细胞缺氧,胎盘缺血缺氧释放多种胎盘因子,进而导致血管内皮受损和氧化应激等系统炎性反应,进一步引起血管痉挛。全身小动脉痉挛是其基本病变。腺苷对炎症、免疫调节[13]、血管生成[14-15]等多种生理以及病理过程起到重要的调控作用。缺血、缺氧以及炎症等都可促进腺苷的释放[16],这些也是子痫前期的病理生理因素。
本研究证实,在轻度以及重度子痫前期孕妇的胎盘中A1R表达升高 (P<0.01),与Versen-Höynck等[11]报道的子痫前期孕妇的胎盘中A1R表达升高的结果一致,证实A1R可能参与了缺氧对子痫前期的调节过程。本研究通过体外细胞实验证实细胞缺氧8~48 h时A1R的表达低于常氧组,分析其原因可能是A1R是妊娠期高血压疾病的不利因素,在缺氧初期机体会产生短暂的自我调节,通过抑制A1R的表达来控制妊娠期高血压疾病;而随着缺氧时间的延长,机体的调节作用受限,A1R的表达逐渐上升。本研究也发现,缺氧至72 h时细胞中A1R的表达和常氧组相比差异已无统计学意义。受限于在缺氧条件下进行体外细胞培养的局限性,本实验进行期间暂未找到继续增加缺氧时间而同时又不增加干扰因素的培养方法,未能继续增加缺氧时间以明确缺氧时长与A1R表达的关系。缺氧复氧组是先缺氧处理8 h后再进行16 h常氧处理,该处理模型参照Yung等[17]和Yang等[18]的报道,本实验验证了在同等缺氧时间情况下缺氧复氧组A1R的表达较缺氧组升高。本研究为短时间缺氧,但疾病发展是一个慢性长期的过程且体外研究与体内环境有所不同,所以推断A1R参与缺氧对子痫前期的调节,且随着缺氧时间的延长以及病程进展A1R的表达也逐渐上升。
最经典的AR信号转导是通过抑制或激活腺苷酸环化酶来进行信号传递的,其中A1R和A3R主要与Gi蛋白偶联。而A2AR和A2BR与Gs蛋白偶联,在一些组织器官中A2BR除了与Gs蛋白偶联外,还与Gq、Gu等多种G蛋白偶联。激活Gi蛋白可以使cAMP浓度和PKA活性下降,激活Gs蛋白可以使cAMP浓度上升,PKA活性增加。因此激活A1R和A3R可以通过激活Gi蛋白使细胞内cAMP浓度下降,进而导致PKA活性下降,而激活A2R则可以起到相反的作用[19]。
本研究发现采用2% O2缺氧处理48 h可以使胎盘滋养细胞的侵袭能力和PKA的表达降低。Kilburn等[19]发现缺氧 (2% O2) 条件下HTR-8/SVneo细胞的侵袭减少。Darashchonak等[12]的研究选用共培养模型,48 h的缺氧 (2% O2) 抑制了胎盘滋养细胞侵袭整合到血管内皮细胞中。Yang等[18]研究发现缺氧 (2% O2)8 h后常氧 (21% O2)16 h的缺氧复氧模型可以使HTR-8/SVneo细胞的侵袭能力降低。另外,Graham等[20]发现在人工基底胶 (即Transwell) 检测下缺氧 (1%O2) 促进滋养细胞的侵袭。Lash等[21]发现,用Transwell检测缺氧 (3% O2) 下作用24 h可以增加HTR-8/SVneo细胞的侵袭能力,72 h后却产生抑制作用。因为处理因素不同,缺氧条件下HTR-8/SVneo细胞侵袭能力的改变需进一步探讨。本研究缺氧 (2% O2)48 h后HTR-8/SVneo细胞的侵袭能力降低,这与Kilburn等[19]和Darashchonak等[12]的研究一致。另外,本研究证实与21% O2的常氧环境相比,2% O2的缺氧环境可以使胎盘滋养细胞中PKA的表达降低。Darashchonak等[12]报道相对于常氧环境,低氧 (2%和8% O2) 可以减少滋养细胞cAMP的浓度,而cAMP的降低可以使PKA表达降低,本研究结果也与其一致。
本研究证明A1R拮抗剂DPCPX在缺氧环境下使PKA表达上升,并使滋养细胞的侵袭性增加。据报道缺氧情况下,激动A2BR可以使cAMP浓度和PKA表达水平升高并使环磷腺苷酸反应元件结合蛋白 (CREB) 磷酸化增加,而且激动A2BR可以使滋养细胞的增殖以及侵袭能力增加[12]。药理学研究证明A1R与A2R分别通过Gi蛋白和Gs蛋白对cAMP-PKA信号通路有着相反的调节作用[17]。Wang等[22]的实验证实,在大鼠酒精性肝纤维化肝星状细胞中A1R通过Gi-cAMP-PKA信号通路进行相关生物活动调节,A2AR则通过Gs-cAMP-PKA信号通路进行调节,且A1R和A2AR对该信号通路中的cAMP和PKA起到相反的调节作用[22-23]。提示在胎盘滋养细胞中A1R相关功能的进行可能与Gi-cAMP-PKA信号通路有关,拮抗A1R可以使cAMP浓度下降,进而使PKA表达降低,同时增强滋养细胞的侵袭能力。
综上所述,A1R参与缺氧对子痫前期的调节,且随着缺氧时间的延长以及病程进展A1R的表达上升。缺氧 (2% O2) 可以使胎盘滋养细胞的侵袭和PKA的表达降低,拮抗A1R可以逆转以上情况。A1R在胎盘滋养细胞的作用机制与调控PKA的信号通路相关,并且其表达升高可能与子痫前期胎盘侵袭不良有关。本研究为进一步探讨A1R在妊娠期高血压以及子痫前期中的病理机制以及抑制A1R对其影响提供了良好的研究基础。
志谢
由衷感谢重庆医科大学附属第二医院妇产科于廷和教授对实验的指导。感谢加拿大Queen’s University生物分子科学部Charles H. Graham博士以及重庆医科大学附属第一医院妇产科漆洪波教授惠赠HTR-8/SVneo细胞。
| [1] | 谢幸, 苟文丽. 妇产科学[M]. 8版. 北京: 人民卫生出版社, 2014: 64-67. |
| [2] | CHAIWORAPONGSA T, CHAEMSAITHONG P, YEO L, ROMERO R. Pre-eclampsia part 1: current understanding of its pathophysiology[J]. Nat Rev Nephrol, 2014, 10: 466–480. DOI: 10.1038/nrneph.2014.102 |
| [3] | STAFF A C, BENTON S J, VON DADELSZEN P, ROBERTS J M, TAYLOR R N, POWERS R W, et al. Redefining preeclampsia using placenta-derived biomarkers[J]. Hypertension, 2013, 61: 932–942. DOI: 10.1161/HYPERTENSIONAHA.111.00250 |
| [4] | 丰有吉, 沈铿. 妇产科学[M]. 2版. 北京: 人民卫生出版社, 2013: 77-78. |
| [5] | SZENTMIKLOSI A J, GALAJDA Z, CSEPPENTO Á, GESZTELYI R, SUSÁN Z, HEGYI B, et al. The Janus face of adenosine: antiarrhythmic and proarrhythmic actions[J]. Curr Pharm Des, 2015, 21: 965–976. |
| [6] | ALAM M S, COSTALES M G, CAVANAUGH C, WILLIAMS K. Extracellular adenosine generation in the regulation of pro-inflammatory responses and pathogen colonization[J]. Biomolecules, 2015, 5: 775–792. DOI: 10.3390/biom5020775 |
| [7] | OHTA A. A metabolic immune checkpoint: adenosine in tumor microenvironment[J]. Front Immunol, 2016, 7: 109. |
| [8] | YONEYAMA Y, SUZUKI S, SAWA R, YONEYAMA K, POWER G G, ARAKI T. Increased plasma denosine concentrations and the severity of preeclampsia[J]. Obstet Gynecol, 2002, 100: 1266–1270. |
| [9] | MOUSAVI S, PANJEHPOUR M, IZADPANAHI M H, AGHAEI M. Expression of adenosine receptor subclasses in malignant and adjacent normal human prostate tissues[J]. Prostate, 2015, 75: 735–747. DOI: 10.1002/pros.v75.7 |
| [10] | LIU H, XIA Y. Beneficial and detrimental role of adenosine signaling in diseases and therapy[J]. J Appl Physiol (1985), 2015, 119: 1173–1182. DOI: 10.1152/japplphysiol.00350.2015 |
| [11] | VON VERSEN-HÖYNCK F, RAJAKUMAR A, BAINBRIDGE S A, GALLAHER M J, ROBERTS J M, POWERS R W. Human placental adenosine receptor expression is elevated in preeclampsia and hypoxia increases expression of the A2A receptor[J]. Placenta, 2009, 30: 434–442. DOI: 10.1016/j.placenta.2009.02.004 |
| [12] | DARASHCHONAK N, KOEPSELL B, BOGDANOVA N, VON VERSEN-HÖYNCK F. Adenosine A2B receptors induce proliferation, invasion and activation of cAMP response element binding protein (CREB) in trophoblast cells[J]. BMC Pregnancy Childbirth, 2014, 14: 2. DOI: 10.1186/1471-2393-14-2 |
| [13] | HASKÓ G, LINDEN J, CRONSTEIN B, PACHER P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases[J]. Nat Rev Drug Discov, 2008, 7: 759–770. DOI: 10.1038/nrd2638 |
| [14] | GEORGE E M, COCKRELL K, ADAIR T H, GRANGER J P. Regulation of sFlt-1 and VEGF secretion by adenosine under hypoxicconditions in rat placental villous explants[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299: 1629–1633. DOI: 10.1152/ajpregu.00330.2010 |
| [15] | FREDHOLM B B, CHERN Y, FRANCO R, SITKOVSKY M. Aspects of the general biology of adenosine A2A signaling[J]. Pro Neurobiol, 2007, 83: 263–276. DOI: 10.1016/j.pneurobio.2007.07.005 |
| [16] | FEOKTISTOV I, RYZHOV S, ZHONG H, GOLDSTEIN A E, MATAFONOV A, ZENG D, et al. Hypoxia modulates adenosine receptors in human endothelial and smooth muscle cells toward an A2B angiogenic phenotype[J]. Hypertension, 44: 649–654. DOI: 10.1161/01.HYP.0000144800.21037.a5 |
| [17] | YUNG H W, ATKINSON D, CAMPION-SMITH T, OLOVSSON M, CHARNOCK-JONES D S, BURTON G J. Differential activation of placental unfolded protein response pathways implies heterogeneity in causation of early-and late-onset pre-eclampsia[J]. Pathol, 2014, 234: 262–276. |
| [18] | YANG Z, BAI B, LUO X, XIAO X, LIU X, DING Y, et al. Downregulated krüppel-like factor 8 is involved in decreased trophoblast invasion under hypoxia-reoxygenation conditions[J]. Reprod Sci, 2014, 21: 72–81. DOI: 10.1177/1933719113488448 |
| [19] | KILBURN B A, WANG J, DUNIEC-DMUCHOWSKI Z M, LEACH R E, ROMERO R, ARMANT D R. Extracellular matrix composition and hypoxia regulate the expression of HLA-G and integrins in a human trophoblast cell line[J]. Biol Reprod, 2000, 62: 739–747. DOI: 10.1095/biolreprod62.3.739 |
| [20] | GRAHAM C H, FITZPATRICK T E, MCCRAE K R. Hypoxia stimulates urokinase receptor expression through a heme protein-dependent pathway[J]. Blood, 1998, 91: 3300–3307. |
| [21] | LASH G E, HORNBUCKLE J, BRUNT A, KIRKLEY M, SEARLE R F, ROBSON S C, et al. Effect of low oxygen concentrations on trophoblast-like cell line invasion[J]. Placenta, 2007, 28: 390–398. DOI: 10.1016/j.placenta.2006.06.001 |
| [22] | WANG H, GUAN W, YANG W, WANG Q, ZHAO H, YANG F, et al. Caffeine inhibits the activation of hepatic stellate cells induced by acetaldehyde via adenosine A2A receptor mediated cAMP/PKA/SRC/ERK1/2/p38MAPK signal pathway[J]. PLoS One, 2014, 9: e92482. DOI: 10.1371/journal.pone.0092482.eCollection2014 |
| [23] | 杨万枝, 吕雄文, 余世春, 管文婕, 翟丹丹, 王和, 等. cAMP-PKA-CREB信号通路在大鼠酒精性肝纤维化星状细胞模型中的作用[J]. 安徽医药, 2012, 16: 729–731. DOI: 10.3969/j.issn.1009-6469.2012.06.005 |
 2017, Vol. 38
2017, Vol. 38


