2. 攀枝花市中心医院药学部, 攀枝花 617067
2. Department of Pharmacy, Panzhihua Central Hospital, Panzhihua 617067, Sichuan, China
天冬酰胺酶 (asparaginase, AN) 是一种具有抗肿瘤作用的化疗药物,能将天冬酰胺水解为天冬氨酸和氨[1]。AN广泛用于治疗淋巴系统恶性肿瘤,如儿童急性淋巴细胞白血病、霍奇金淋巴瘤、淋巴肉瘤和黑肉瘤[2]。AN可以降解淋巴肿瘤细胞的必需氨基酸外源天冬酰胺,从而导致肿瘤细胞死亡[3-5]。尽管AN对肿瘤细胞的抑制作用明显,但其具有的半衰期短、稳定性差、高免疫原性等缺点限制了AN在临床上的应用[5-6]。
针对AN的缺陷现已进行了下列研究[7-8]:(1) 化学修饰,如聚乙二醇 (PEG) 修饰;(2) 固定化,将AN制成用各种载体固定的固定酶;(3) 脂质体包封,定向给药,减少毒副作用;(4) 利用蛋白质工程技术对AN进行分子改造等。但改造后的AN仍存在酶活性损失、易脱落和生物相容性等问题[8]。自组装纳米囊作为一种新型的可封装酶、小分子药物、基因等物质的药物载体,具有生物膜相似性,能提高封装药物的稳定性,延长被封装药物的生物半衰期、提高封装药物的生物利用度以及降低毒副作用等优点[9-11]。
本实验主要考察自组装法制备的天冬酰胺酶透明质酸 (HA)-聚乙二醇[hyaluronic acid-graft-poly (ethylene glycol), HA-g-PEG]/α-环糊精 (α-cyclodextrin, α-CD) 纳米囊 (HA-g-PEG/α-CD hollow nanocapsules loaded with asparaginase,AHAPs) 的活性和体外稳定性。实验首先对AHAPs的生物学特性进行了考察,然后通过AHAPs和游离AN的热稳定性、酸碱稳定性、抗部分金属离子及化合物能力、抗胰蛋白水解能力、血浆稳定性和贮存稳定性实验,对AHAPs的体外稳定性进行了评价,最后通过荧光光谱实验对AN与脂质膜的相互作用进行了研究。
1 材料和方法 1.1 仪器与试剂AB 204S电子天平 (瑞士Mettler Toledo仪器公司);KQ 2200B型超声波清洗器 (江苏昆山市超声仪器有限公司);Milli-Q超纯水系统 (美国Millipore公司);pH计 (上海精密科学仪器有限公司);RE-52AA型旋转蒸发器 (上海亚荣生化仪器厂);UV-7504PC紫外分光光度计 (上海欣茂仪器有限公司);F-2500型荧光分光光度计 (日本Hitachi公司);85-2型恒温磁力搅拌器 (上海司乐仪器有限公司)。AN (以色列Prospec公司,批号:312PLASP1,纯度:96%);HA (山东曲阜市广龙生物制品厂,批号:20131027,纯度:95.6%);PEG (Sigma-Aldrich公司,批号:EY-(BR)-2669,纯度:99%);AHAPs (实验室自制,批号:20151022);其他试剂均为分析纯。
1.2 AHAPs的特性考察将AN溶于HA-g-PEG溶液中后,缓慢滴加至α-CD饱和溶液中,一定温度下磁力搅拌2 h,即得AHAPs [11-12]。取AHAPs溶液,加入Tris-HCl缓冲液稀释后,使用马尔文粒度仪测定其粒径和zeta电位。按葡聚糖凝胶法[13]测定AHAPs的包封率。取空白HA-g-PEG/α-CD纳米囊溶液 (空白HA-g-PEG/α-CD纳米囊的制备方法与AHAPs的基本一致,唯一区别在于不加入AN),加入乙醇摇匀至溶液澄清,得溶液1。再取等体积过柱后的AHAPs溶液,同样加入乙醇摇匀至溶液澄清,得溶液2。最后取AHAPs溶液,加入破乳剂摇匀至溶液澄清,得溶液3。分别取溶液1、2、3,加入考马斯亮蓝G-250,混合,放置2 min后,以溶液1作为空白对照,测定溶液2和溶液3的光密度 (D) 值D1、D2,并计算包封率。包封率 (%)=(D1/D2)×100%。
1.3 AN活性的测定参照奈斯勒试剂法[14]测定。取适量天冬酰胺底物溶液,加入0.10 mL AN溶液后预热2 min,于37 ℃下反应10 min。加入0.10 mL三氯醋酸溶液,离心,取上清液,加入适量蒸馏水和奈斯勒指示剂。10 min后,于480 nm处测定其D值。酶活力单位定义为:在规定条件下,催化一个单位的底物释放1 μmol氨所需的酶量。
1.4 最适温度将样品溶液分别放置于加热到20、30、37、40、50、60、70、80 ℃的水浴锅中,在各温度下预热2 min,于相应温度下反应10 min后,分别按照1.3项下的方法测定游离AN及AHAPs中AN的活性,并以AN最适温度下活性为100%计算相对活性。
1.5 最适pH用pH分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5的Tris-HCl缓冲液配制底物AN溶液,放置37 ℃下预热2 min后,按照1.3项下的方法测定游离AN及AHAPs中AN的活性。以AN最适pH下活性为100%计算相对活性。
1.6 热稳定性的测定取AHAPs和游离AN溶液分别置于55 ℃的水浴中,于0、1、2、3、4、5 h时分别取出,按照1.3项下的方法测定游离AN及AHAPs中AN的活性。
1.7 酸碱稳定性的测定取适量AHAPs溶液,分别用pH 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5的Tris-HCl缓冲液稀释,37 ℃水浴放置40 min后,按照1.3项下方法分别测定游离AN及AHAPs中AN的活性。
1.8 抗胰蛋白酶水解能力的测定取游离AN和AHAPs溶液,分别加入胰蛋白酶溶液,混匀后置于37 ℃水浴中,分别于0、10、20、30、40、50、60、70、80 min时取出,按照1.3项下的方法测定游离AN及AHAPs中AN的活性。
1.9 抗金属离子和有机化合物能力的测定取游离AN和AHAPs溶液,分别加入配制好的山梨醇、吐温-80、氯化钾 (KCl)、氟化钠 (NaF)、PEG2000和氯化铵 (NH4Cl) 溶液,混匀,于25 ℃水浴中放置1 h后,按照1.3项下的方法测定游离AN及AHAPs中AN的活性。
1.10 血浆稳定性的测定参照文献[15]方法配制体外模拟空白血浆样品后,取AHAPs和游离AN溶液,分别加入5倍体积的体外模拟空白血浆,混匀,于37 ℃下孵育0、1、2、4、8、12、24、48、72、96 h后,按照1.3项下的方法分别测定游离AN及AHAPs中AN的活性。
1.11 贮存稳定性的测定取AHAPs和游离AN溶液,贮存于4 ℃,分别在0、1、2、5、10、15、20、25、28 d时取出,并按1.3项下的方法分别测定游离AN及AHAPs中AN的活性。
1.12 AN与纳米制剂膜的相互作用取AN溶液、空白HA-g-PEG/α-CD纳米囊溶液、AN与空白HA-g-PEG/α-CD纳米囊的混合溶液 (混合后需室温孵育1 h) 各980 μL,分别与20 μL含异硫氰基荧光素 (FITC) 的Tris-HCl溶液混合,得样品溶液1、2和3,将3种样品溶液置于黑暗处孵育5 min。在发射波长为500~600 nm、激发波长为480 nm的条件下,于1 mL比色皿中检测荧光强度[14-15]。
1.13 统计学处理采用SPSS 20.0软件对游离AN和AHAPs中AN的活性及稳定性数据进行双向单侧t检验。检验水准 (α) 为0.05。
2 结果 2.1 AHAPs的特性测得AHAPs的平均粒径为 (424.53±7.25) nm,zeta电位为 (-48.77±0.99) mV。经计算,AHAPs的平均包封率为 (64.40±1.82)%。
2.2 最适温度如图 1所示,游离AN的最适温度为60 ℃,AHAPs的最适温度为50 ℃。当温度在20~70 ℃范围内变化时,AHAPs中AN的活性均高于游离AN (60 ℃时除外)。

|
图 1 游离AN与AHAPs的最适温度 Fig 1 Optimum temperature of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
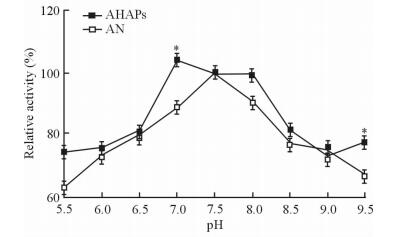
2.3 最适pH
如图 2所示,AHAPs的最适pH为7.0。实验条件下 (pH 7.5和9.0除外) AHAPs中AN的活性均高于游离AN,且当pH为7.0和9.5时AHAPs中AN的活性优于游离AN (P < 0.05)。
|
图 2 游离AN与AHAPs的最适pH Fig 2 Optimum pH of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
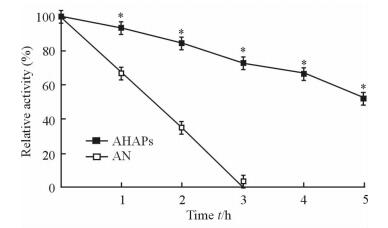
2.4 热稳定性
从图 3中可知,实验条件下游离AN失活较快,3 h已完全失活;而此时AHAPs中AN的活性仍在80%左右,5 h时AHAPs中AN的活性仍>50%。实验结果说明AHAPs大大提高了AN的热稳定性。
|
图 3 游离AN与AHAPs在55 ℃下的热稳定性 Fig 3 Thermal stabilities of free AN and AHAPs at 55 ℃ AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
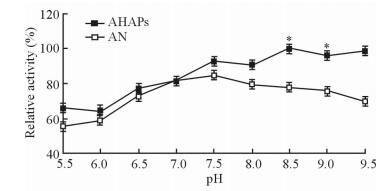
2.5 酸碱稳定性
以pH 8.5时AN的活性为100%而计算的相对活性见图 4。不同酸碱环境下AHAPs中AN的活性都高于游离AN (除pH 7.0时AHAPs中AN与游离AN的活性接近外),且当pH为8.5和9.0时,两者的活性差异有统计学意义 (P < 0.05)。当pH值在7.5~9.5范围内变化时,AHAPs中的AN都能保持80%以上的高活性。结果可知,AHAPs较游离AN具有更好的耐溶液酸碱变化的能力。
|
图 4 游离AN与AHAPs的酸碱稳定性 Fig 4 pH stabilities of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
2.6 抗胰蛋白酶水解能力
如图 5所示,在胰蛋白酶的作用下,游离AN被迅速酶解,其活性呈快速下降的趋势,30 min时,游离AN的活性仅存约30%,而此时AHAPs中AN的活性仍>60%;50 min时,游离AN已完全失活,而AHAPs中AN的活性仍>30%,并到80 min时才完全失活。结果显示AHAPs中的AN相比游离AN具有更好的抗酶解能力。

|
图 5 游离AN与AHAPs的抗胰蛋白酶水解能力 Fig 5 Trypsinase stabilities of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
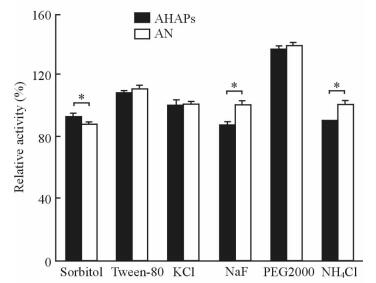
2.7 抗部分金属离子及有机化合物能力
如图 6所示,加入PEG2000后,AHAPs中AN及游离AN的活性与不加PEG2000的初始活性 (100%) 相比,均提高了近40%;其次是吐温-80,使游离AN与AHAPs中AN的活性均提高了10%左右。其中,山梨醇组、NaF组和NH4Cl组中游离AN及AHAPs中AN的活性差异均有统计学意义 (P < 0.05)。而KCl对游离AN及AHAPs中AN的活性无明显影响。结果表明,PEG2000、吐温-80、山梨醇、KCl、NaF和NH4Cl对游离AN及AHAPs的活性均有不同程度的影响。
|
图 6 部分金属离子及有机化合物对游离AN与AHAPs活性的影响 Fig 6 Effects of several metal ions and organic compounds on activities of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05. n=3, x±s |
2.8 血浆稳定性
如图 7所示,当时间为4、12、24、48、72、96 h时,游离AN和AHAPs中AN的活性差异具有统计学意义 (P < 0.05)。其中,游离AN活性降低速度较快,4 h已损失了近一半的活性,而此时AHAPs中AN的活性仍高达90%;48 h时,游离AN已完全失活,而96 h时AHAPs中AN仍保持有20%以上的活性。实验结果说明AHAPs中的AN较游离AN具有更好的血浆稳定性。

|
图 7 游离AN与AHAPs的血浆稳定性 Fig 7 Plasma stabilities of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
2.9 贮存稳定性
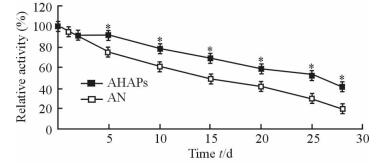
如图 8所示,5、10、15、20、25和28 d时两组的活性差异均有统计学意义 (P < 0.05)。其中,15 d时游离AN的活性已降至50%以下,而此时AHAPs中AN仍保持有近70%的活性;28 d时,游离AN的活性仅存约20%,而此时AHAPs中AN的活性约为游离AN的2倍。结果表明,AHAPs中的AN具有更好的贮存稳定性。
|
图 8 游离AN与AHAPs的贮存稳定性 Fig 8 Storage stabilities of free AN and AHAPs AN: Asparaginase; AHAPs: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules loaded with asparaginase. *P < 0.05 vs AN group. n=3, x±s |
2.10 AN与纳米制剂膜相互作用结果
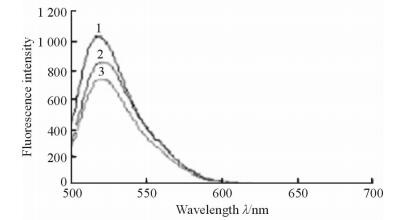
AN与纳米制剂膜的相互作用实验结果见图 9。如图 9所示,3种样品 (从上到下依次为:AN、空白HA-g-PEG/α-CD纳米囊、AN+空白HA-g-PEG/α-CD纳米囊) 的荧光强度呈规律性降低,其中AN+空白HA-g-PEG/α-CD纳米囊混合溶液 (曲线3) 的荧光强度最小;空白HA-g-PEG/α-CD纳米囊溶液 (曲线2) 的荧光强度稍大;AN溶液 (曲线1) 的荧光强度最大。与AN相比,AN+空白HA-g-PEG/α-CD纳米囊混合溶液的荧光强度明显减弱,说明AN和FITC竞争性地与纳米制剂膜结合,也证明AN与纳米制剂膜之间产生了相互作用。比较AN+空白HA-g-PEG/α-CD纳米囊混合溶液和空白HA-g-PEG/α-CD纳米囊也能得出同样的结论。
|
图 9 荧光图谱 Fig 9 FITC fluorescence spectra Excitation wavelength: 480 nm; emission wavelength: 500-600 nm. 1: AN; 2: Blank HA-g-PEG/α-CD; 3: AN+Blank HA-g-PEG/α-CD. AN: Asparaginase; HA-g-PEG/α-CD: Hyaluronic acid-graft-poly (ethylene glycol)/α-cyclodextrin hollow nanocapsules |
3 讨论
不同种类的CD衍生物,如α-CD和磺丁基-β-CD,在理化性质如相对分子质量、葡萄糖单元数、分子结构、增溶作用、毒性作用、水溶性等方面存在着明显差异,且以α-CD和磺丁基-β-CD为主要辅料加上其他辅料后制得的新型药物纳米递送系统的稳定性、溶解性、生物学特性、药代动力学、毒性作用等都可能存在不同。实验发现,本研究中以α-CD为主要辅料制得的新型药物纳米递送系统与谢江川等[16]以磺丁基-β-CD为主要辅料制得的新型药物纳米递送系统在平均zeta电位、平均包封率、最适pH等方面存在较大差异。两种递送系统在药代动力学、毒性作用等方面是否存在差异还需进一步研究。
药物制剂的稳定性是其质量控制的关键因素,良好的稳定性也是其临床应用的必要条件[17]。本实验测定了AHAPs的最适温度、最适pH、粒径、zeta电位和包封率,并分别对AHAPs和游离AN的热稳定性、酸碱稳定性、抗胰蛋白酶水解能力、抗部分金属离子及有机化合物能力、血浆稳定性、贮存稳定性及AN与纳米制剂膜的相互作用进行了考察。实验结果显示,AHAPs中的AN较游离AN具有更优的活性和体外稳定性。
荧光实验结果发现AN与纳米制剂膜之间产生了相互作用,该相互作用可能会导致酶的构象发生变化,而这些改变可能正是AHAPs中AN生物学特性明显提高的原因[18-19]。若要进一步验证AN的构象是否发生了变化以及深入探讨该变化对AN酶学性质的影响,还需更深入的研究。
理论上AHAPs不仅具有纳米囊所具有的提高封装药物稳定性、延长被封装药物的生物半衰期、提高封装药物的生物利用度以及降低毒副作用等优势,而且通过HA的修饰还具有缓释和肿瘤靶向性的特点,本实验结果已证明相比游离AN,AHAPs中的AN具有更好的酶学活性和更优的体外稳定性,为剂量的减少及临床上的广泛应用奠定了一定的基础,同时本研究也为AHAPs在体内的进一步研究奠定了良好的基础。
| [1] | WANG R, XIA B, LI B J, PENG S L, DING L S, ZHANG S. Semi-permeable nanocapsules of konjac glucomannan-chitosan for enzyme immobilization[J]. Int J Pharm, 2008, 364: 102–107. DOI: 10.1016/j.ijpharm.2008.07.026 |
| [2] | ZUO S, ZHANG T, JIANG B, MU W. Recent research progress on microbial L-asparaginases[J]. Appl Microbiol Biotechnol, 2015, 99: 1069–1079. DOI: 10.1007/s00253-014-6271-9 |
| [3] | NARTA U K, KANWAR S S, AZMI W. Pharmacological and clinical evaluation of L-asparaginase in the treatment of leukemia[J]. Crit Rev Oncol Hematol, 2007, 61: 208–221. DOI: 10.1016/j.critrevonc.2006.07.009 |
| [4] | MOHAN-KUMARI H P, DHALE M A, AKHILENDER NAIDU K, VIJAYALAKSHMI G. Antioxidant effect of red mould rice in hypercholesterolemic Wistar male rats[J]. Cell Biochem Funct, 2011, 29: 597–602. DOI: 10.1002/cbf.v29.7 |
| [5] | 吴南海, 吕善根, 赵新民. 左旋门冬酰胺酶在治疗急性淋巴细胞白血病中的副作用及防治[J]. 白血病, 2000, 9: 120. DOI: 10.3760/cma.j.issn.1009-9921.2000.02.005 |
| [6] | 张小华, 王绍华. 左旋天门冬酰胺酶的不良反应[J]. 中国医院药学杂志, 2000, 20: 767. DOI: 10.3321/j.issn:1001-5213.2000.12.041 |
| [7] | HA W, MENG X W, LI Q, FAN M M, PENG S L, DING L S, et al. Self-assembly hollow nanosphere for enzyme encapsulation[J]. Soft Matter, 2010, 6: 1405–1408. DOI: 10.1039/b925747k |
| [8] | 杜少平, 杨冠东, 彭中健, 梁淑娃. 降低L-天门冬酰胺酶毒副作用的研究进展[J]. 广州医药, 2003, 34: 3–5. DOI: 10.3969/j.issn.1000-8535.2003.01.002 |
| [9] | CAI B, WEN D, LIU W, HERRMANN A K, BENAD A, EYCHM LLER A. Function-led design of aerogels: self-assembly of alloyed PdNi hollow nanospheres for efficient electrocatalysis[J]. Angew Chem Int Ed Engl, 2015, 54: 13101–13105. DOI: 10.1002/anie.v54.44 |
| [10] | ARAVIND A, JEYAMOHAN P, NAIR R, VEERANARAYANAN S, NAGAOKA Y, YOSHIDA Y, et al. AS1411 aptamer tagged PLGA-lecithin-PEG nanoparticles for tumor cell targeting and drug delivery[J]. Biotechnol Bioeng, 2012, 109: 2920–2931. DOI: 10.1002/bit.v109.11 |
| [11] | HA W, FAN M M, ZHANG S, VEERANARAYANAN S, NAGAOKA Y, YOSHIDA Y, et al. Self-assembly of chitosan-g-PEG and α-cyclodextrin into hollow spheres in aqueous solution[J]. J Control Release, 2011, 152(Suppl 1): e204–e205. DOI: 10.1016/j.jconrel.2011.09.010 |
| [12] | MENG X W, HA W, CHENG C, DONG Z Q, DING L S, LI B J, et al. Hollow nanospheres based on the self-assembly of alginate-graft-poly (ethylene glycol) and α-cyclodextrin[J]. Langmuir, 2011, 27: 14401–14407. DOI: 10.1021/la2028803 |
| [13] | LI Q, XIA B, BRANHAM M, HA W, WU H, PENG S L, et al. Self-assembly of carboxymethyl konjac glucomannan-g-poly (ethylene glycol) and (α-cyclodextrin) to biocompatible hollow nanospheres for glucose oxidase encapsulation[J]. Carbohy Polym, 2011, 86: 120–126. DOI: 10.1016/j.carbpol.2011.04.017 |
| [14] | 施特尔马赫B. 酶的测定方法[M]. 钱嘉渊, 译. 北京: 中国轻工业出版社, 1992: 85-88. |
| [15] | SARACINO M A, MARCHESELLI C, SOMAINI L, GERRA G, DE STEFANO F, PIERI M C, et al. Simultaneous determination of disulfiram and bupropion in human plasma of alcohol and nicotine abusers[J]. Anal Bioanal Chem, 2010, 398: 2155–2161. DOI: 10.1007/s00216-010-4172-z |
| [16] | 谢江川, 何丹, 晏子俊, 周云莉, 张景勍. 天门冬酰胺酶聚乙二醇-透明质酸/磺丁基-β-环糊精纳米粒体外稳定性的初步研究[J]. 华西药学杂志, 2016, 31: 124–127. |
| [17] | 张敉, 杨林, 周云莉, 邓雪, 张景勍. 脂质纳米粒提高尿酸氧化酶体外稳定性的初步研究[J]. 重庆医科大学学报, 2014, 39: 1452–1455. |
| [18] | ZHOU Y, ZHANG M, HE D, HU X, XIONG H, WU J, et al. Uricase alkaline enzymosomes with enhanced stabilities and anti-hyperuricemia effects induced by favorable microenvironmental changes[J]. Sci Rep, 2016, 7: 20136. DOI: 10.1038/srep20136 |
| [19] | XIONG H, ZHOU Y, ZHOU Q, HE D, WAN S, TAN Q, et al. Nanosomal microassemblies for highly efficient and safe delivery of therapeutic enzymes[J]. ACS Appl Mater Interfaces, 2015, 7: 20255–20263. DOI: 10.1021/acsami.5b05758 |
 2017, Vol. 38
2017, Vol. 38


