2. 第二军医大学长征医院神经内科, 上海 200003
2. Department of Neurology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
近年来,内源性大麻素系统 (endocannabinoid system,ECS) 在多发性硬化 (multiple sclerosis,MS) 中的作用正逐渐得到广泛关注并成为新的研究热点。已有研究证实在MS中存在ECS功能失调[1],但多个有关植物源性大麻素治疗MS的大型临床双盲实验的结论并不一致[2-3]。内源性大麻素具有按需合成、快速降解的特点,因此大麻素受体 (cannabinoid receptor,CBR) 在MS发生和发展中的调节作用已成为新的研究热点和难点。研究提示大麻素1型受体 (cannabinoid 1 receptor,CB1R) 参与了MS的发生和发展,可能具有神经保护作用[4-6],但对于CB1R在正常小鼠和实验性自身免疫性脑脊髓炎 (experimental autoimmune encephalomyelitis,EAE) 小鼠病程的不同时期以及中枢神经系统不同类型细胞上的表达特点却知之甚少,阻碍了有关CB1R在MS发生、发展中的作用机制的研究。本研究通过质粒转染技术诱导CB1R过表达,探讨CB1R在EAE发生、发展中的可能机制。
1 材料和方法 1.1 实验动物及试剂健康雌性C57B/L6小鼠24只,8~10周龄,体质量22~25 g,购自上海斯莱克实验动物有限公司[动物许可证号:SCXK (沪)-2007-0005]。MOG35-55肽段购自杭州联科生物公司。白介素 (IL)-10、IL-17、IL-6、肿瘤坏死因子α (TNF-α) 购自美国Peprotech公司。
1.2 MOG35-55抗原混悬液制备取MOG35-55肽段3 mg,溶于1 mL PBS (3 mg/mL) 中;另取3 mg结核菌素溶于1 mL完全弗氏佐剂 (4 mg/mL) 中。采用针管混合器将两种溶液等体积充分混合,制成油包水样乳白色混悬液,以静置后无分层为合格。
1.3 MOG35-55诱导的EAE小鼠模型构建及症状评估C57B/L6小鼠背部脊柱两侧四点皮下注射MOG35-55抗原混悬液 (200 μL/只),同时尾静脉注射百日咳毒素 (PTX) 200 ng/只,48 h后再次尾静脉注射PTX 200 ng加强免疫。所有小鼠置于相同的饲养环境中,自由饮食,自然作息。每周记录小鼠体质量,评估临床症状。从免疫当天开始进行小鼠的临床症状评分,直至免疫后第28天。症状评估采用国际评分标准:0分,无症状;1分,垂尾;2分,行路不稳/后肢力弱/翻正反射迟钝;3分,后肢麻痹和 (或) 前肢力弱;4分,前肢麻痹;5分,四肢瘫;6分,濒临死亡或死亡。
1.4 MOG35-55诱导的EAE小鼠分组及处理取EAE小鼠24只,随机分为EAE对照组和EAE CB1R过表达组,每组12只,两组小鼠的神经功能评分差异无统计学意义。免疫当天,EAE对照组小鼠于L4/5间隙注射对照溶剂15 μL,过表达组于L4/5间隙注射经预实验筛靶选取的实验用载体,过表达CB1R (NM_007726.3) 的载体pLOV.CMV.eGFP.2A.EF1a.PuroR (pLOV)。引物序列:正义链 (同源重组序列目的基因5′端配对序列)5′-AAC CCC GGT CCG ATG GCT AGC ATG AAG TCG ATC TTA GAC GGC C-3′;反义链 (同源重组序列目的基因3′端配对序列) 5′-CGT CAT CCT TGT AGT CGC TAG CCA GAG CCT CGG CAG ACG TGT C-3′。
1.5 蛋白质印迹法检测CB1R蛋白表达水平免疫后第28天处死小鼠取脊髓组织,采用成分蛋白抽提试剂盒 (Millipore) 抽提细胞膜蛋白,BCA法定量。蛋白质提取物 (30 μg) 用SDS-PAGE分离,并转移到PVDF膜。常规方法进行封闭、洗膜,一抗、二抗作用后在膜抗CB1R中过夜 (4 ℃)。用化学发光 (ECL) 系统 (GE Healthcare) 辣根过氧化物酶 (horserasish peroxidase,HRP) 标记的二抗和ECL试剂盒检测条带。
1.6 酶联免疫吸附试验 (ELISA) 检测细胞因子的表达免疫后第28天分别取对照组和CB1R过表达组EAE小鼠脊髓,称取80 mg脊髓组织,冰浴条件下提取组织胞质蛋白。在37 ℃细胞培养箱中孵育48 h后取上清液,ELISA法检测IL-10、IL-17、IL-6、TNF-α的浓度。
1.7 统计学处理使用GraphPad Prism 5.0软件进行分析。计量资料用F检验进行样本方差齐性检验;样本符合正态分布且方差齐性时,两组均数比较采用t检验。检验水准 (α) 为0.05。
2 结果 2.1 各组EAE小鼠神经功能缺损评分的动态变化免疫后第7、14、21、28天评估小鼠的神经功能缺损情况。第14天时对照组与CB1R过表达组EAE小鼠的神经功能缺损评分差异有统计学意义 (P < 0.05),第28天时CB1R过表达组小鼠的神经功能缺损评分也低于对照组 (P < 0.05,图 1)。
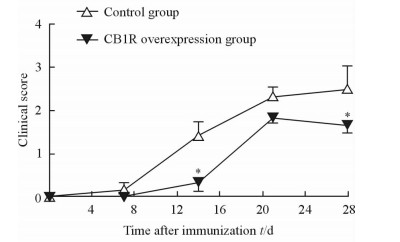
|
图 1 不同时间点对照组和CB1R过表达组EAE小鼠神经功能缺损的变化 Fig 1 Clinical scores of neurological deficit in EAE mice at different time points in control and CB1R overexpression groups CB1R: Cannabinoid 1 receptor; EAE: Experimental autoimmune encephalomyelitis. *P < 0.05 vs control group. n=12, x±s |
2.2 各组EAE小鼠脊髓组织中CB1R的蛋白水平
蛋白质印迹法结果 (图 2) 显示,相较于对照组,CB1R过表达组EAE小鼠脊髓组织中CB1R蛋白的表达水平升高 (P < 0.01)。
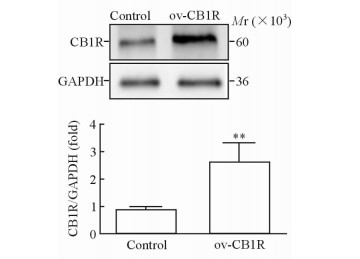
|
图 2 对照组和CB1R过表达组EAE小鼠脊髓组织中CB1R的表达水平 Fig 2 Expression of CB1R in spinal cord in EAE mice in control and CB1R overexpression groups CB1R: Cannabinoid 1 receptor; EAE: Experimental autoimmune encephalomyelitis; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; ov-CB1R: CB1R overexpression. **P < 0.01 vs control group. n=12, x±s |
2.3 各组EAE小鼠脊髓组织中细胞因子的浓度
ELISA实验结果 (图 3) 显示,相较于对照组,CB1R过表达组EAE小鼠脊髓组织中IL-10的浓度升高 (P < 0.05),而IL-17、IL-6、TNF-α的浓度降低 (P < 0.05,P < 0.01)。
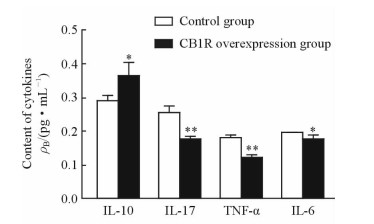
|
图 3 对照组和CB1R过表达组EAE小鼠脊髓组织中细胞因子的表达 Fig 3 Expression of cytokines in spinal cord in EAE mice in control and CB1R overexpression groups CB1R: Cannabinoid 1 receptor; EAE: Experimental autoimmune encephalomyelitis; IL: Interleukin; TNF: Tumor necrosis factor. *P < 0.05, **P < 0.01 vs control group. n=12, x±s |
3 讨 论
CB1R又名中枢型大麻素受体,主要位于脑、脊髓与周围神经系统中。脑内CB1R主要分布于基底神经节 (黑质、苍白球、外侧纹状体)、海马CA锥体细胞层、小脑和大脑皮质。CB1R的分布特征可能与大麻类物质对记忆、认知、运动控制的调节作用有关。
随着研究的深入,目前发现CBR系统在众多神经系统疾病中起着重要的神经保护和免疫调节作用[7-8]。既往研究表明正常小鼠脑内CB1R主要在神经元中表达,少量在小胶质细胞中表达,而在星形胶质细胞中不表达[9]。与正常小鼠比较,EAE小鼠神经元上CB1R的阳性细胞百分数显著降低,而小胶质细胞中CB1R的阳性细胞百分数显著增加[9]。Berrendero等[10]也发现EAE病程中CB1R的表达减少与小鼠的神经功能缺损程度密切相关。由此表明CB1R在EAE中可能具有神经保护的作用,其对EAE发生、发展的影响可能通过小胶质细胞介导的免疫反应实现。
实验表明,CB1R活化后对EAE神经功能缺损的影响结果并不一致[11-12]。上调CB1R或脑损伤后给予内源性大麻素 (2-AG) 可产生脑保护作用[13-14]。本课题组前期研究发现特异性CB1R拮抗剂SR141716A (SR1) 干预的EAE小鼠的起病时间 (免疫后第5天) 提前,早期神经功能缺损显著高于对照组[9]。为明确CB1R是否参与了EAE发生、发展中的神经保护,本研究通过质粒转染技术使EAE小鼠脊髓CB1R过表达,结果发现CB1R过表达组EAE小鼠的神经功能较同时点对照组显著减轻。此外,我们发现CB1R过表达组脊髓中EAE小鼠IL-10的浓度明显升高,而IL-17、IL-6、TNF-α的浓度降低。IL-10是由Th2细胞产生的强效抗炎因子,可下调促炎因子的表达,从而发挥免疫调节作用。也有研究证实IL-10水平升高在MS的免疫病理过程中具有重要的保护作用[15]。IL-17由Th17细胞分泌、IL-6由Th2细胞分泌、TNF-α由Th1细胞分泌,这些T细胞因子均有促炎作用,参与诱导麻痹和炎症反应[16];其中IL-17A不仅与中枢神经系统脱髓鞘疾病发病密切相关,还与疾病的严重程度有关[17]。CB1R可调控炎性因子的水平,同时也受炎性因子的影响。研究发现不同细胞群与促炎因子特别是TNF-α的刺激也可诱导CB1R mRNA的合成[18]。本研究中CB1R过表达EAE小鼠脊髓组织中IL-10的浓度升高,而IL-17、IL-6、TNF-α的浓度降低,表明CB1R可能参与了EAE的发生与发展,并具有一定的免疫保护作用。
综上所述,中枢神经系统CB1R过表达能够减轻EAE的发生和发展,这种作用可能是通过调节细胞因子的表达来实现的。今后我们将进一步深入研究EAE小鼠中CB1R的表达变化及相关机制,为寻求MS新的治疗策略提供新思路。
| [1] | CENTONZE D, BARI M, ROSSI S, PROSPERETTI C, FURLAN R, FEZZA F, et al. The endocannabinoid system is dysregulated in multiple sclerosis and in experimental autoimmune encephalomyelitis[J]. Brain, 2007 (Pt 10), 130: 2543-2553. |
| [2] | THAERA G M, WELLIK K E, CARTER J L, DEMAERSCHALK B M, WINGERCHUK D M. Do cannabinoids reduce multiple sclerosis-related spasticity?[J]. Neurologist, 2009, 15: 369–371. DOI: 10.1097/NRL.0b013e3181bf5572 |
| [3] | SMITH P F. New approaches in the management of spasticity in multiple sclerosis patients: role of cannabinoids[J]. Ther Clin Risk Manag, 2010, 6: 59–63. |
| [4] | CHEN C C, ZECHARIAH A, HSU Y H, CHEN H W, YANG L C, CHANG C. Neuroaxonal ion dyshomeostasis of the normal-appearing corpus callosum in experimental autoimmune encephalomyelitis[J]. Exp Neurol, 2008, 210: 322–330. DOI: 10.1016/j.expneurol.2007.11.008 |
| [5] | CENTONZE D, FINAZZI-AGRO A, BERNARDI G, MACCARRONE M. The endocannabinoid system in targeting inflammatory neurodegenerative diseases[J]. Trends Pharmacol Sci, 2007, 28: 180–187. DOI: 10.1016/j.tips.2007.02.004 |
| [6] | VAN DER WALT A, BUTZKUEVEN H, KOLBE S, MARRIOTT M, ALEXANDROU E, GRESLE M, et al. Neuroprotection in multiple sclerosis: a therapeutic challenge for the next decade[J]. Pharmacol Ther, 2010, 126: 82–93. DOI: 10.1016/j.pharmthera.2010.01.006 |
| [7] | FQWLER C J, ROIO M L, RODRIGUEZ-GAZTELUMENDI A. Modulation of the endocannabinoid system: neuroprotection or neurotoxicity?[J]. Exp Neurol, 2010, 224: 37–47. DOI: 10.1016/j.expneurol.2010.03.021 |
| [8] | ROSSI S, BERNARDI G, CENTONZE D. The endocannabinoid system in the inflammatory and neurodegenerative processes of multiple sclerosis and of amyotrophic lateral sclerosis[J]. Exp Neurol, 2010, 224: 92–102. DOI: 10.1016/j.expneurol.2010.03.030 |
| [9] | 楼之茵, 程洁, 李琳, 陈伟, 王晓蓉, 浦政, 等. 大麻素1型受体在实验性自身免疫性脑脊髓炎小鼠中的动态表达及其作用[J]. 中山大学学报 (医学科学版), 2014, 35: 814–822. |
| [10] | BERRENDERO F, SANCHEZ A, CABRANES A, PUERTA C, RAMOS J A, GARCIA-MERINO A, et al. Changes in cannabinoid CB1 receptors in striatal and cortical regions of rats with experimental allergic encephalomyelitis, an animal model of multiple sclerosis[J]. Synapse, 2001, 41: 195–202. DOI: 10.1002/syn.v41:3 |
| [11] | NI X, GELLER E B, EPPIHIMER M J, EISENSTEIN T K, ADLER M W, TUMA R F. Win 52212-2, a cannabinoid receptor agonist, attenuates leukocyte/endothelial interactions in an experimental autoimmune encephalomyelitis model[J]. Mult Scler, 2004, 10: 158–164. DOI: 10.1191/1352458504ms1009oa |
| [12] | JACKSON S J, PRYCE G, DIEMEL L T, CUZNER M L, BAKER D. Cannabinoid-receptor 1 null mice are susceptible to neurofilament damage and caspase 3 activation[J]. Neuroscience, 2005, 134: 261–268. DOI: 10.1016/j.neuroscience.2005.02.045 |
| [13] | PANIKASHYILI D, SIMEONIDOU C, BEN-SHABAT S, HANUS L, BREUER A, MECHOULAM R, et al. An endogenous cannabinoid (2-AG) is neuroprotective after brain injury[J]. Nature, 2001, 413: 527–531. DOI: 10.1038/35097089 |
| [14] | MARSICANO G, GOODENOUGH S, MONORY K, HERMANN H, EDER M, CANNICH A, et al. CB1 cannabinoid receptors and on-demand denfense against excitotoxicity[J]. Science, 2003, 302: 84–88. DOI: 10.1126/science.1088208 |
| [15] | 周建光, 杨梅. IL-10与自身免疫性疾病关系的研究进展[J]. 医学综述, 2012, 18: 2743–2745. DOI: 10.3969/j.issn.1006-2084.2012.17.005 |
| [16] | 侯娟. 多发性硬化免疫机制研究新进展[J]. 国际免疫学杂志, 2009, 32: 468–471. DOI: 10.3760/cma.j.issn.1673-4394.2009.06.015 |
| [17] | 梁军利, 钱琪, 马晓丽, 吕海东, 许明予. 白细胞介素-17A在复发缓解型多发性硬化发病机制中的作用研究[J]. 实用医学杂志, 2014, 30: 409–411. DOI: 10.3969/j.issn.1006-5725.2014.03.022 |
| [18] | JEAN-GILLES L, GRAN B, CONSTANTINESCU C S. Interaction between cytokines, cannabinoids and the nervous system[J]. Immunobiology, 2010, 215: 606–610. DOI: 10.1016/j.imbio.2009.12.006 |
 2017, Vol. 38
2017, Vol. 38


