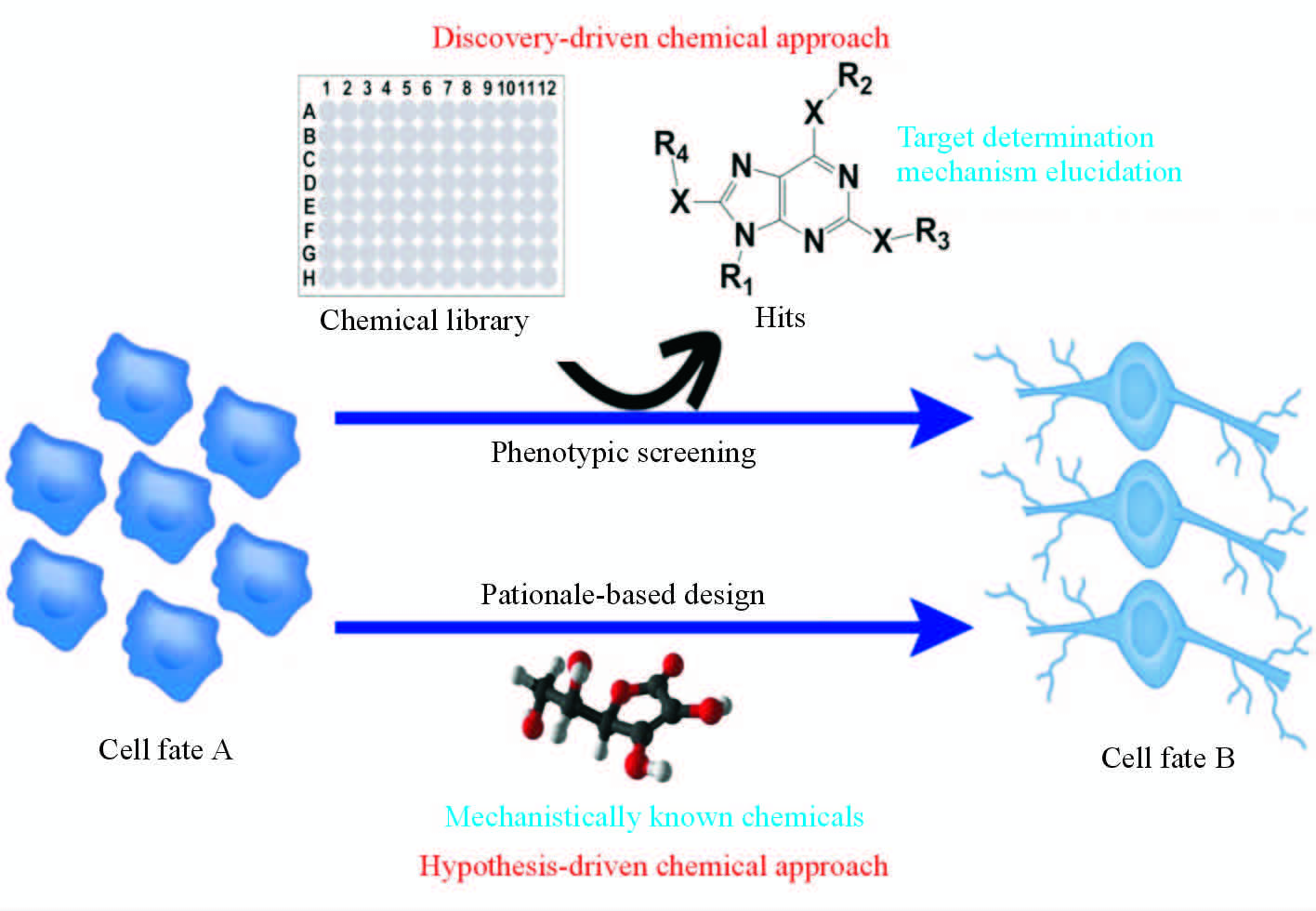
化学生物学(chemical biology)是利用化学小分子化合物干预和解析生物系统,认识生物系统的本质和内在规律的交叉学科。传统遗传学手段依赖于基因突变干预和解析生物系统,化学生物学则利用活性的小分子化合物干预蛋白质功能从而影响生物学系统。与遗传学手段相比,化学小分子具有使用便捷、活性可以通过化合物浓度和不同组合进行精确调控以及作用具有可逆性等显著优点,已经成为研究生物体系的重要工具。近年来,干细胞研究取得了引人瞩目的进步,对细胞命运转换分子基础的认识以及精确操控一直是干细胞研究的核心问题。由于干细胞的自我更新和分化等基本生物学行为是一个高度时空依赖的调控过程,化学生物学手段的灵活性和高度可控性尤其适合干细胞研究。传统的遗传学手段大致可以分为“正向遗传学(forward genetics)”和“反向遗传学(reverse genetics)”两类。化学生物学与之类似,“正向化学生物学”手段是一种发现驱动(discovery-driven)的研究手段。例如,对干细胞研究领域而言,如果拟解析细胞命运A到细胞命运B转换的分子基础,首先通过化学筛选发现可以诱导细胞命运A向细胞命运B转换的化合物,然后分析该化合物的作用靶点和机制,从而认识细胞命运A到细胞命运B转换的分子基础。而“反向化学生物学”手段是一种假设驱动(hypothesis-driven)的研究手段,需要建立在对细胞命运A向细胞命运B转换的分子机制有一定认识的基础上,通过推理和设计用已知功能化合物对细胞命运转换的关键调控机制进行干预,从而实现由细胞命运A获得细胞命运B(图 1)。
|
图 1 干细胞研究中的化学生物学手段 Fig 1 Chemical biology approaches in stem cell research |
本文将评述近年来利用化学生物学手段干预和调控干细胞命运的重要进展,立足于利用典型的研究工作归纳化学生物学在干细胞研究中的应用策略,以及其对干细胞生物学的基础研究和转化应用所产生的重要而深远的影响。
1 发现驱动的化学生物学手段在干细胞研究中,发现驱动的化学生物学手段通常利用小分子化合物库进行细胞表型筛选(phenotypic screening),发现并验证能够诱导细胞获得特定表型的化合物,并进一步研究化合物的作用靶点和机制。通过该策略,一方面可以为干细胞命运调控提供有用的化学工具分子,另一方面可以通过对化合物作用靶点的研究探究未知的生物学机制。该方法通常是一种无偏的(unbiased)化学筛选策略,即对小分子的可能作用机制没有预先的设定;此外,在实验设计上不会受限于对拟干预的生物学过程认识的不足,因此非常适合用于解析干细胞生物学中的未知问题。本部分将从干细胞自我更新、体细胞重编程等不同角度对发现驱动的化学生物学进行评述。
胚胎干细胞(embryonic stem cells)的自我更新(self-renewal)是干细胞研究的热点问题。对小鼠胚胎干细胞而言,LIF/STAT3、BMP4/Smad 和Wnt/β-Catenin介导的信号通路在细胞的自我更新中发挥核心作用[1-2]。但是否还存在其他决定性的分子机制在其中发挥作用呢?Chen等[3]设计了一个高通量化学筛选的策略,他们将小鼠胚胎干细胞培养于无血清、无饲养层细胞、无任何细胞因子添加的培养基中,该条件本身无法维持胚胎干细胞的自我更新,但是通过高通量化学筛选他们从超过5万个化合物中发现其中一个杂环小分子化合物SC1可以在此条件下维持小鼠胚胎干细胞的自我更新。进一步的机制研究证实SC1并不激活LIF/STAT3、BMP4/Smad或Wnt/β-Catenin信号通路,而是通过结合并抑制可促进胚胎干细胞分化的分子ERK和RasGAP来促进小鼠胚胎干细胞的自我更新。该研究表明在抑制了促进分化的因素后,小鼠胚胎干细胞可能本身具有内在的自我更新能力,这一研究深化了人们对鼠胚胎干细胞自我更新机制的认识。
实现干细胞在体外的自我更新具有重要的生物学意义和应用价值。但是,相对于胚胎干细胞而言,目前人们对绝大多数成体干细胞自我更新分子基础的认识都非常有限。例如,造血干细胞移植已经在临床中应用超过半个世纪,但是仍然无法有效地实现体外造血干细胞的自我更新,从而解决造血干细胞移植时细胞来源匮乏的问题。Boitano等[4]以CD34和CD133阳性的造血干细胞扩增为指标,从10万个化合物中发现阳性化合物StemRegenin 1 (SR1)可在IL-6、FLT3配体和SCF等细胞因子存在的条件下,将CD34阳性细胞的扩增效率提高50倍、将能重构NOD/SCID小鼠造血系统的细胞数提高17倍,机制研究证明SR1是芳香烃受体(aryl hydrocarbon receptor,AHR)拮抗剂,该研究首次揭示了AHR 在造血干细胞自我更新中的作用。此后,Sauvageau研究团队[5]筛选了可以扩增脐带血中CD34+CD45RA-表型长周期造血干细胞的化合物,获得的阳性化合物中除了包含AHR拮抗剂外,还发现了一类嘧啶吲哚(pyrimidoindole)衍生物,其可以在体外有效扩增人长周期造血干细胞。该类化合物并不抑制AHR,其作用靶点尚不清楚。与AHR拮抗剂SR1相比,嘧啶吲哚衍生物更倾向于扩增长周期造血干细胞,其代表化合物UM171已在进行脐血扩增的临床研究(NCT02668315)。有趣的是,无论是SR1还是UM171都不能扩增小鼠的造血干细胞。
体细胞重编程是近年来干细胞研究领域的重大突破,日本科学家Yamanaka S因此获得了2012年诺贝尔生理学或医学奖。通过高表达外源的转录因子,如Oct4、Sox2、Klf4和c-Myc,可以将分化的体细胞重编程为类似胚胎干细胞的诱导多能干细胞(induced pluripotent stem cells,iPSCs)[6-8]。利用此技术,可将患者自身细胞重编程为多能干细胞,然后将多能干细胞分化为患者需要的细胞,从而用于疾病治疗,这一方面避免了胚胎干细胞应用所涉及的伦理学争议,另一方面也可以显著缓解异体细胞移植所涉及的免疫排斥问题。但是,过表达外源转录因子诱导的重编程效率低,或者存在外源DNA片段在细胞内稳定整合等问题。体细胞重编程的过程涉及细胞表型的剧烈变化,因此适合用于通过表型筛选发现可促进重编程的化合物。利用Oct4启动子调控绿色荧光蛋白表达作为化学筛选指标,Shi等[9-10]发现,H3K9 组蛋白甲基化酶G9a抑制剂BIX-01294可以诱导仅表达Oct4和Klf4的小鼠神经干细胞发生重编程;BIX-01294联合DNA甲基化酶抑制剂RG108和L-钙通道激动剂Bayk-8644,可以诱导仅表达Oct4和Klf4的小鼠成纤维细胞发生重编程。因G9a在多能干细胞分化过程中介导了Oct4和 Rex1等多能性基因的沉默[11],在重编程过程中抑制G9a可能有助于Oct4等基因的重新启动。我们的研究还发现,GSK3抑制剂CHIR99021和H3K4/9 组蛋白去甲基化酶LSD1抑制剂parnate(也被称为tranylcypromine)的组合可诱导仅表达Oct4和Klf4的人角朊细胞(keratinocytes)发生重编程[12]。其他化学筛选还发现组蛋白乙酰化酶抑制剂丙戊酸(valproic acid,VPA)和丁酸钠、组蛋白H3甲基化酶DOT1抑制剂等对重编程有促进作用,且VPA可诱导仅表达Oct4和Sox2的人成纤维细胞发生重编程[13-16]。这些研究都表明表观遗传学的重构是体细胞重编程的关键障碍之一。Zhu等[17]通过筛选发现3-磷酸肌醇依赖性蛋白激酶-1(3-phosphoinositide-dependent kinase-1)激动剂PS48可促进仅表达Oct4的人角朊细胞等体细胞重编程为多能干细胞,其作用机制是PS48通过促进细胞的糖酵解而发挥作用。该研究揭示了细胞能量代谢从氧化磷酸化到糖酵解的转化是体细胞重编程过程的重要机制。Hou等[18]和Zhao等[19]利用表达Sox2、Klf4和c-Myc的小鼠成纤维细胞进行化学筛选,发现forskolin等化合物可以在无外源Oct4基因的条件下诱导小鼠细胞重编程为iPSCs。在此基础上,他们利用forskolin联合其他可以提高重编程效率以及取代Sox2、Klf4和c-Myc的小分子化合物,发现一个包括forskolin、VPA、CHIR99021、616452(TGFβ受体抑制剂)和parnate的小分子组合可以在无任何外源转录因子存在的条件下诱导小鼠成纤维细胞表达多能干细胞核心转录因子Oct4,建立和优化了仅用化学小分子诱导小鼠体细胞重编程的技术体系。通过分析化学诱导的重编程过程,他们发现该重编程过程经历了一个胚外内胚层的中间阶段,最终获得多能性,这与Oct4、Sox2、Klf4和c-Myc转录因子诱导的重编程要经过类似原条(primitive streak)的中间阶段不同[19]。
化学生物学手段在干细胞研究中已经得到了越来越多的关注,发现驱动的化学生物学手段已经成为探索干细胞生物学未知领域的有力工具,同时该策略也将为更精准和高效地调控干细胞命运提供更多的化学工具分子。
2 假设驱动的化学生物学手段与发现驱动的化学生物学手段不同,假设驱动的化学生物学手段是一种基于推理和设计的策略,要求对拟干预的生物学过程的内在机制有一定认识(为“推理”提供基础),通过已知功能的化学工具分子干预和调控这些机制从而诱导细胞获得需要的表型。
例如,ERK/MAPK已被证实负调控小鼠多能干细胞的自我更新[3, 20]。基于此,Ying等[21]发现MEK抑制剂可抑制小鼠胚胎干细胞在无LIF条件下的自发分化,而MEK抑制剂和另外一个可促进胚胎干细胞自我更新的小分子GSK3抑制剂CHIR99021组合可维持小鼠胚胎干细胞处于一种不依赖LIF/STAT3和BMP4/SMAD等经典信号通路的基态自我更新(ground state self-renewal)的状态。在该状态下,小鼠胚胎干细胞表现了更低的DNA甲基化水平、高度均一的多能干细胞标记分子表达和高效的嵌合体形成能力。
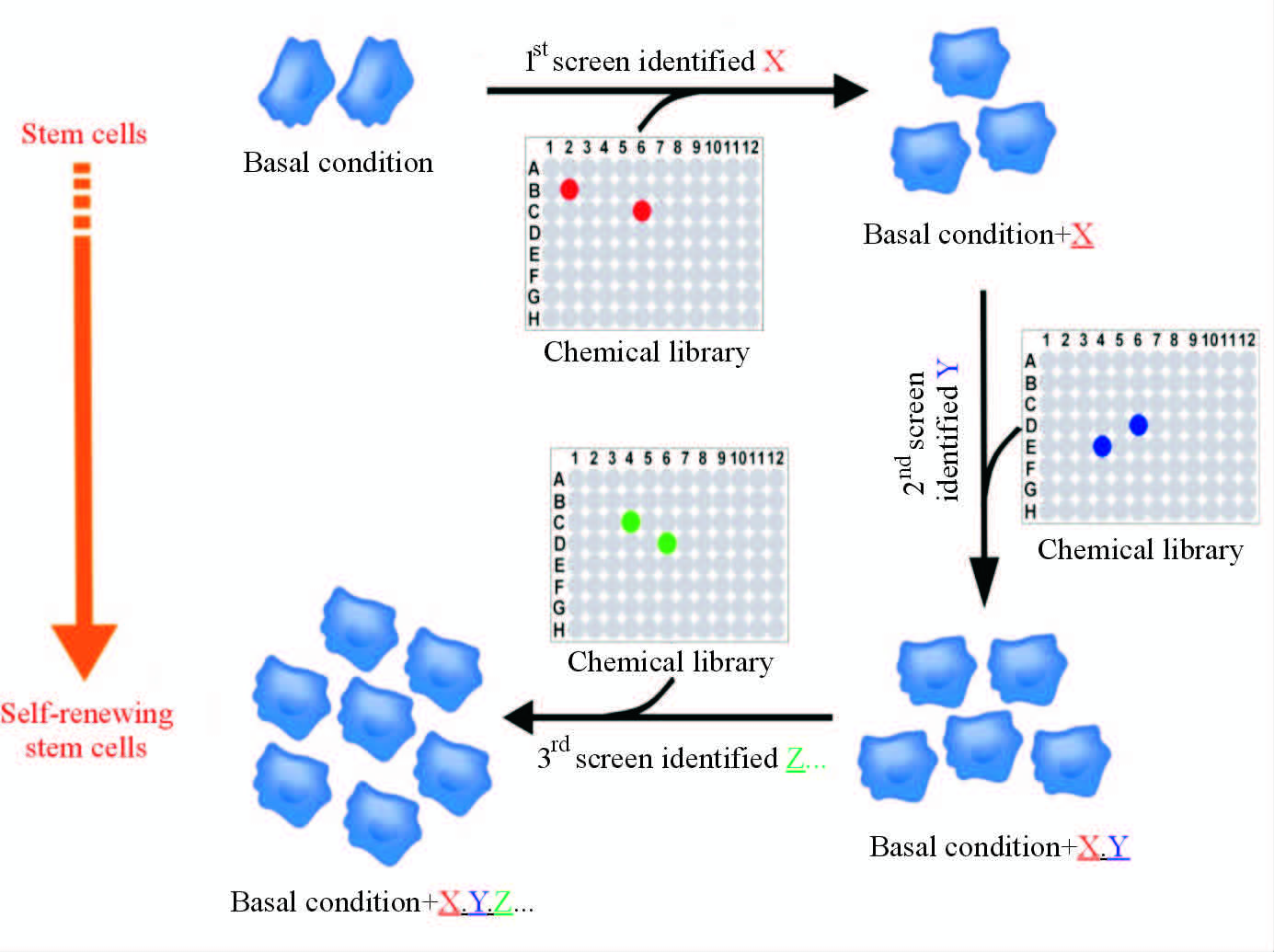
对细胞谱系发育机制的认识是指导干细胞体外分化核心线索。在多能干细胞分化研究中,能否有效模拟特定细胞谱系的体内发育过程是分化成败的关键[22-23]。活性工具小分子在调控信号通路等生物机制方面具有独特优势,因此其也非常适合应用于诱导干细胞分化。例如,已知TGFβ信号通路在促进人多能干细胞自我更新和中胚层、内胚层诱导中发挥重要作用,而阻断TGFβ信号通路可以促进人多能干细胞的神经诱导[24]。基于此,Chambers等[25]建立了一个包含Noggin (BMP拮抗蛋白)和小分子TGFβ受体抑制剂SB431542的组合,实现了人多能干细胞在单层培养的条件下高度均一的神经诱导。协同抑制BMP和TGFβ信号通路一方面抑制了多能干细胞的自我更新,另一方面阻断了干细胞向滋养外胚层、中胚层和内胚层的分化。我们通过在人多能干细胞神经诱导过程中整合促进神经诱导和神经干细胞自我更新的信号,发现SB431542、CHIR99021和LIF的组合可以长期稳定地维持人多能干细胞来源的原始神经干细胞(primitive neural stem cells,pNSCs)的稳定自我更新[26]。其机制在于SB431542通过抑制TGFβ信号通路促进神经诱导,而CHIR99021可通过抑制GSK3促进神经干细胞的自我更新[27-28]。pNSCs类似于神经发育过程中的神经板细胞,可以响应神经发育信号的区域化作用分化为中脑多巴胺神经元和后脑胆碱能神经元。我们进一步的研究证实,pNSCs来源的多巴胺神经元移植后可显著缓解帕金森病大鼠模型的运动障碍,并首次利用碳纤维电极和微透析HPLC等手段在原位证实移植的细胞可以分泌多巴胺[29]。 最近,我们还成功建立了一种叠加化学筛选(reiterative chemical screening)方法来实现肝祖细胞的自我更新。该方法的基本原理是利用一种仅添加胰岛素-转铁蛋白-硒酸钠的基础培养基筛选一组已知可调控干细胞增殖和分化的化合物,如果在第1轮筛选中发现X分子可以促进干细胞自我更新,则将X加入基础培养条件进行第2轮筛选;如果在第2轮筛选中发现Y可以和X协同促进干细胞自我更新,则将Y再加入基础条件进行第3轮筛选发现新的协同分子Z,直至成功建立干细胞自我更新的充分条件(图 2)。通过该方法,我们发现了一个包含EGF、CHIR99021和616452 以及2种天然磷脂的组合可实现小鼠和人肝祖细胞在化学成分明确条件下的体外稳定自我更新[30~31]。
|
图 2 通过叠加化学筛选实现干细胞自我更新 Fig 2 Self-renewal of stem cells by reiterative chemical screening |
虽然目前对重编程的分子基础认识非常有限,但是重编程过程涉及细胞形态、代谢和功能的显著改变,这些改变可以为干预并促进重编程提供思路。例如,在成纤维细胞重编程为多能干细胞过程中会发生间质-上皮转化(mesenchymal-to-epithelial-transition,MET),而用小分子阻断TGFβ等MET相关的信号通路可以显著促进重编程[32]。重编程过程还会因细胞发生应激反应而导致细胞衰老,维生素C可以通过抑制p53和INK4/ARF基因的表达促进重编程[33-34]。除了将体细胞重编程为多能干细胞外,最近谱系重编程(即将一种体细胞不经过多能干细胞状态直接转分化为另一种体细胞)成为了新的研究热点。活性小分子化合物在促进谱系重编程过程中同样发挥重要的作用。Wang等[35]通过组合和优化已发现的可以促进体细胞重编程为诱导多能干细胞小分子化合物,发现4个小分子(SB431542、Bix01294、Bay K 8644和RG108)的组合可将人胃上皮细胞重编程为内胚层祖细胞。最近其他研究者也成功通过类似手段利用小分子将小鼠或人的成纤维细胞重编程为神经祖细胞或者神经元[36-39]。其中,Zhang等[36]通过谱系追踪技术充分证明是成纤维细胞而非起始细胞群体中可能混杂的其他细胞发生了重编程。他们设想使用表观遗传学调控分子和神经发育信号分子的组合,促进成纤维细胞向神经细胞的重编程,最终发现了一个包括CHIR99021、LDN193189(BMP受体抑制剂)、A83-01(TGFβ受体抑制剂)、维甲酸、HhAg1.5(Smo激动剂)、RG108、parnate、SMER28(细胞自噬的活化剂)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)在内的组合,该组合可以将小鼠成纤维细胞重编程为自我更新的神经干细胞,机制研究表明bFGF和HhAg1.5在重编程过程中发挥核心作用,它们通过其下游的转录因子Elk1和Gli2直接激活神经干细胞的核心转录因子Sox2。
最近,Ding课题组[40]建立了一种被称为“细胞激活和信号引导(cell-activation and signaling-directed)”的重编程策略,该策略的基本原理是通过可介导重编程的转录因子或者小分子化合物诱导细胞进入一种重编程的激活状态(cell-activation),但尚不足以使细胞获得多能性,然后利用特定细胞谱系的发育线索引导细胞重编程为目的细胞(signaling-directed)。例如,他们通过诱导表达Yamanaka重编程因子6 d(尚不足以诱导多能干细胞的产生)实现细胞激活,然后经SB431542、CHIR99021、parnate和forskolin的处理可将激活的细胞重编程为心肌细胞。此外,他们还根据心脏发育线索优化了一个包括BMP4、activin A、CHIR99021和SU5402(FGF、VEGF和PDGF信号通路抑制剂)的组合,可以将激活的细胞重编程为心肌祖细胞,并实现了其长时间稳定扩增。该细胞可以在体外分化为心肌细胞、内皮细胞和平滑肌细胞,体内移植可以改善心肌梗死模型中的心脏功能[41]。最近,他们还利用一组可促进细胞重编程的小分子化合物SB431542、CHIR99021、parnate和forskolin为基础条件进行化学筛选,诱导人成纤维细胞实现细胞激活,然后利用心脏发育相关的信号分子,包括activin A、BMP4、VEGF和CHIR99021进行引导,促进人成纤维细胞重编程为心肌细胞。最终他们优化获得了包括9个小分子化合物的组合,成功将人成纤维细胞仅用化学分子重编程为可以跳动的心肌细胞。ChIP-Seq分析证实,化合物的处理可诱导人成纤维细胞基因组中心脏发育相关基因的活化(H3K4me3和H3K27ac的富集,以及H3K27me3的下调)。将这些化合物处理后的人成纤维细胞移植到心肌梗死模型的心脏中后,也可以在体内环境中重编程为心肌细胞[42]。他们用类似的策略还实现了成纤维细胞向肝细胞和β细胞的重编程[43-44]。
假设驱动的化学生物学手段依赖发育生物学、细胞生物学等基础研究建立的理论知识体系,同时也依赖药学和化学生物学研究提供可利用的化学工具分子。该策略尤其适合于操控干细胞自我更新、分化等细胞命运转化过程,以获取需要的细胞类型。因此,该策略对于通过干细胞技术获得具有临床应用前景的细胞,促进干细胞的转化应用具有重要意义。
3 通过化学手段促进体内再生和修复干细胞技术的进步使人们可以获得那些具有重要临床应用前景、但通常难以获得的细胞(如心肌细胞和神经元等),从而为疾病的细胞治疗提供了细胞来源,细胞治疗的成功实施必将为许多目前仍难以治愈的重大疾病的治疗提供新机遇。但是,除了通过移植外源细胞以替代病变细胞达到治疗目的外,通过化学小分子调控内源细胞的增殖与分化、诱导体内再生和修复同样是未来再生医学的发展方向之一。
化学生物学的筛选手段同样也可以应用于整体动物。Pieper等[45]对包含20万个分子的化合物库首先根据结构和功能的多样性通过计算机虚拟筛选出1 000个化合物,然后将这些化合物分为100组,每10个化合物为一组,混合后注入左侧侧脑室,评价其对海马神经再生的影响,发现有活性的化合物组后,再对组中的化合物分别进行评价。他们发现化合物P7C3可以促进海马新生神经元的存活,但是并不影响神经前体细胞的增殖。在体内,P7C3可以修复海马再生缺陷模型小鼠海马齿状回的形态和电生理缺陷、促进老年大鼠的神经再生并提高其认知能力。 P7C3通过结合并活化烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase,NAMPT)、提升细胞内烟酰胺腺嘌呤二核苷酸的水平而发挥作用[46]。P7C3有望作为先导化合物用于开发促进神经再生的药物。通过类似发现驱动的体内化学筛选将是发现新的再生医学治疗靶标和药物的有效手段。利用哺乳动物进行体内筛选代价高且颇有技术挑战,而斑马鱼因可以饲养于多孔板中,而可作为理想的体内化学筛选模型动物。North等[47]和Goessling等[48]使用斑马鱼模型发现促进前列腺素E2(prostaglandin E2,PGE2)合成的分子,包括PGE2本身可以增加斑马鱼胚胎造血干细胞的数量。目前一种更稳定的PGE2类似物FT1050(16,16-dimethyl-PGE2)已经完成Ⅰ期临床研究,该药物体外处理脐带血干细胞后可提高干细胞移植后骨髓重建的效率[49]。
除了靶向体内干细胞可促进组织再生外,调控体内成熟细胞的转分化同样可促进组织修复。最近,Li等[50]建立了诱导性过表达Arx基因的Min6细胞,Arx是胰腺α细胞的核心转录因子,Arx的过表达可以诱导β细胞来源的胰岛瘤细胞系Min6获得α细胞的特性。然后他们以该细胞为模型筛选了280个临床批准的小分子药物,发现青蒿素可诱导过表达Arx的Min6细胞重新获得β细胞表型,并能够诱导α细胞系αTC1以及人的原代α细胞分泌胰岛素。分子机制研究表明,青蒿素可以通过结合并稳定Gephyrin蛋白、促进GABAA 受体信号通路激活、抑制转录因子Arx功能使其由细胞核转位至细胞质,从而诱导α细胞向β细胞的转分化。在体内,青蒿素同样可以诱导斑马鱼和小鼠α细胞向β细胞的转分化并增加β细胞的数量,缓解链脲霉素大鼠模型的高血糖症状。这项研究发现了青蒿素全新的应用价值。
除了上述发现驱动的体内筛选手段外,对疾病发生机制的深入认识也可以为设计体内干预再生和修复提供线索。范可尼贫血(Fanconi anemia)是一类严重的以进行性骨髓衰竭为主要特征的遗传病,FANC基因的纯合突变是致病原因,FANC基因突变会导致细胞的DNA损伤修复缺陷,使细胞对DNA损伤高度敏感。Zhang等[51]利用FANCA-/-成纤维细胞为模型,以该细胞对DNA交联剂丝裂霉素的敏感性为指标,进行全基因组shRNA筛选,发现敲除TGFβ信号通路核心分子可以提高FANCA-/-成纤维细胞对丝裂霉素的耐受性,表明TGFβ信号通路的过度活化与范可尼贫血患者体细胞对DNA损伤的超敏性有关。在体外,利用TGFβ的中和性抗体或者小分子抑制剂SD208可以有效促进范可尼贫血模型小鼠和患者造血干细胞的克隆形成能力和对乙醛遗传毒性的耐受力。在体内,抑制TGFβ信号通路可挽救范可尼贫血模型小鼠的骨髓衰竭,提示该策略有可能具有临床应用前景。
4 小 结化学生物学为干细胞研究提供了独特而强有力的手段,对解析干细胞生物学领域悬而未决的问题、推动干细胞技术的转化应用都发挥着越来越重要的作用。随着化学生物学和干细胞生物学研究领域的进一步发展,学科之间的交叉和互利必将进一步强化。我们有理由相信,这种学科间的交叉将深远地影响未来人类重大疾病的治疗手段,推动再生医学的蓬勃发展。
| [1] | NIWA H, BURDON T, CHAMBERS I, SMITH A. Self-renewal of pluripotent embryonic stem cells is mediated via activation of STAT3[J]. Genes Dev, 1998, 12: 2048–2060. DOI: 10.1101/gad.12.13.2048 |
| [2] | YING Q L, NICHOLS J, CHAMBERS I, SMITH A. BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3[J]. Cell, 2003, 115: 281–292. DOI: 10.1016/S0092-8674(03)00847-X |
| [3] | CHEN S, DO J T, ZHANG Q, YAO S, YAN F, PETERS E C, et al. Self-renewal of embryonic stem cells by a small molecule[J]. Proc Natl Acad Sci USA, 2006, 103: 17266–17271. DOI: 10.1073/pnas.0608156103 |
| [4] | BOITANO A E, WANG J, ROMEO R, BOUCHEZ L C, PARKER A E, SUTTON S E, et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells[J]. Science, 2010, 329: 1345–1348. DOI: 10.1126/science.1191536 |
| [5] | FARES I, CHAGRAOUI J, GAREAU Y, GINGRAS S, RUEL R, MAYOTTE N, et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal[J]. Science, 2014, 345: 1509–1512. DOI: 10.1126/science.1256337 |
| [6] | TAKAHASHI K, TANABE K, OHNUKI M, NARITA M, ICHISAKA T, TOMODA K, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007, 131: 861–872. DOI: 10.1016/j.cell.2007.11.019 |
| [7] | TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126: 663–676. DOI: 10.1016/j.cell.2006.07.024 |
| [8] | YU J, VODYANIK M A, SMUGA-OTTO K, ANTOSIEWICZ-BOURGET J, FRANE J L, TIAN S, et al. Induced pluripotent stem cell lines derived from human somatic cells[J]. Science, 2007, 318: 1917–1920. DOI: 10.1126/science.1151526 |
| [9] | SHI Y, DESPONTS C, DO J T, HAHM H S, SCHÖLER H R, DING S. Induction of pluripotent stem cells from mouse embryonic fibroblasts by Oct4 and Klf4 with small-molecule compounds[J]. Cell Stem Cell, 2008, 3: 568–574. DOI: 10.1016/j.stem.2008.10.004 |
| [10] | SHI Y, DO J T, DESPONTS C, HAHM H S, SCHÖLER H R, DING S. A combined chemical and genetic approach for the generation of induced pluripotent stem cells[J]. Cell Stem Cell, 2008, 2: 525–528. DOI: 10.1016/j.stem.2008.05.011 |
| [11] | FELDMAN N, GERSON A, FANG J, LI E, ZHANG Y, SHINKAI Y, et al. G9a-mediated irreversible epigenetic inactivation of Oct-3/4 during early embryogenesis[J]. Nat Cell Biol, 2006, 8: 188–194. DOI: 10.1038/ncb1353 |
| [12] | LI W, ZHOU H, ABUJAROUR R, ZHU S, YOUNG JOO J, LIN T, et al. Generation of human-induced pluripotent stem cells in the absence of exogenous Sox2[J]. Stem Cells, 2009, 27: 2992–3000. |
| [13] | ONDER T T, KARA N, CHERRY A, SINHA A U, ZHU N, BERNT K M, et al. Chromatin-modifying enzymes as modulators of reprogramming[J]. Nature, 2012, 483: 598–602. DOI: 10.1038/nature10953 |
| [14] | HUANGFU D, OSAFUNE K, MAEHR R, GUO W, EIJKELENBOOM A, CHEN S, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J]. Nat Biotechnol, 2008, 26: 1269–1275. DOI: 10.1038/nbt.1502 |
| [15] | HUANGFU D, MAEHR R, GUO W, EIJKELENBOOM A, SNITOW M, CHEN A E, et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds[J]. Nat Biotechnol, 2008, 26: 795–797. DOI: 10.1038/nbt1418 |
| [16] | MALI P, CHOU B K, YEN J, YE Z, ZOU J, DOWEY S, et al. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes[J]. Stem Cells, 2010, 28: 713–720. DOI: 10.1002/stem.402 |
| [17] | ZHU S, LI W, ZHOU H, WEI W, AMBASUDHAN R, LIN T, et al. Reprogramming of human primary somatic cells by OCT4 and chemical compounds[J]. Cell Stem Cell, 2010, 7: 651–655. DOI: 10.1016/j.stem.2010.11.015 |
| [18] | HOU P, LI Y, ZHANG X, LIU C, GUAN J, LI H, et al. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J]. Science, 2013, 341: 651–654. DOI: 10.1126/science.1239278 |
| [19] | ZHAO Y, ZHAO T, GUAN J, ZHANG X, FU Y, YE J, et al. A XEN-like state bridges somatic cells to pluripotency during chemical reprogramming[J]. Cell, 2015, 163: 1678–1691. DOI: 10.1016/j.cell.2015.11.017 |
| [20] | BURDON T, STRACEY C, CHAMBERS I, NICHOLS J, SMITH A. Suppression of SHP-2 and ERK signalling promotes self-renewal of mouse embryonic stem cells[J]. Dev Biol, 1999, 210: 30–43. DOI: 10.1006/dbio.1999.9265 |
| [21] | YING Q L, WRAY J, NICHOLS J, BATLLE-MORERA L, DOBLE B, WOODGETT J, et al. The ground state of embryonic stem cell self-renewal[J]. Nature, 2008, 453: 519–523. DOI: 10.1038/nature06968 |
| [22] | WICHTERLE H, LIEBERAM I, PORTER J A, JESSELL T M. Directed differentiation of embryonic stem cells into motor neurons[J]. Cell, 2002, 110: 385–397. DOI: 10.1016/S0092-8674(02)00835-8 |
| [23] | KIM J H, AUERBACH J M, RODRÍGUEZ-GÓMEZ J A, VELASCO I, GAVIN D, LUMELSKY N, et al. Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson's disease[J]. Nature, 2002, 418: 50–56. DOI: 10.1038/nature00900 |
| [24] | SMITH J R, VALLIER L, LUPO G, ALEXANDER M, HARRIS W A, PEDERSEN R A. Inhibition of Activin/Nodal signaling promotes specification of human embryonic stem cells into neuroectoderm[J]. Dev Biol, 2008, 313: 107–117. DOI: 10.1016/j.ydbio.2007.10.003 |
| [25] | CHAMBERS S M, FASANO C A, PAPAPETROU E P, TOMISHIMA M, SADELAIN M, STUDER L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling[J]. Nat Biotechnol, 2009, 27: 275–280. DOI: 10.1038/nbt.1529 |
| [26] | LI W, SUN W, ZHANG Y, WEI W, AMBASUDHAN R, XIA P, et al. Rapid induction and long-term self-renewal of primitive neural precursors from human embryonic stem cells by small molecule inhibitors[J]. Proc Natl Acad Sci USA, 2011, 108: 8299–8304. DOI: 10.1073/pnas.1014041108 |
| [27] | MAO Y, GE X, FRANK C L, MADISON J M, KOEHLER A N, DOUD M K, et al. Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling[J]. Cell, 2009, 136: 1017–1031. DOI: 10.1016/j.cell.2008.12.044 |
| [28] | KIM W Y, WANG X, WU Y, DOBLE B W, PATEL S, WOODGETT J R, et al. GSK-3 is a master regulator of neural progenitor homeostasis[J]. Nat Neurosci, 2009, 12: 1390–1397. DOI: 10.1038/nn.2408 |
| [29] | KANG X, XU H, TENG S, ZHANG X, DENG Z, ZHOU L, et al. Dopamine release from transplanted neural stem cells in Parkinsonian rat striatum in vivo[J]. Proc Natl Acad Sci USA, 2014, 111: 15804–15809. DOI: 10.1073/pnas.1408484111 |
| [30] | LÜ L, HAN Q, CHU Y, ZHANG M, SUN L, WEI W, et al. Self-renewal of hepatoblasts under chemically defined conditions by iterative growth factor and chemical screening[J]. Hepatology, 2015, 61: 337–347. DOI: 10.1002/hep.27421 |
| [31] | ZHANG M, SUN P, WANG Y, CHEN J, LÜ L, WEI W, et al. Generation of self-renewing hepatoblasts from human embryonic stem cells by chemical approaches[J]. Stem Cells Transl Med, 2015, 4: 1275–1282. DOI: 10.5966/sctm.2015-0051 |
| [32] | LIN T, AMBASUDHAN R, YUAN X, LI W, HILCOVE S, ABUJAROUR R, et al. A chemical platform for improved induction of human iPSCs[J]. Nat Methods, 2009, 6: 805–808. DOI: 10.1038/nmeth.1393 |
| [33] | ESTEBAN M A, WANG T, QIN B, YANG J, QIN D, CAI J, et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells[J]. Cell Stem Cell, 2010, 6: 71–79. DOI: 10.1016/j.stem.2009.12.001 |
| [34] | WANG T, CHEN K, ZENG X, YANG J, WU Y, SHI X, et al. The histone demethylases Jhdm1a/1b enhance somatic cell reprogramming in a vitamin-C-dependent manner[J]. Cell Stem Cell, 2011, 9: 575–587. DOI: 10.1016/j.stem.2011.10.005 |
| [35] | WANG Y, QIN J, WANG S, ZHANG W, DUAN J, ZHANG J, et al. Conversion of human gastric epithelial cells to multipotent endodermal progenitors using defined small molecules[J]. Cell Stem Cell, 2016, 19: 449–461. DOI: 10.1016/j.stem.2016.06.006 |
| [36] | ZHANG M, LIN Y H, SUN Y J, ZHU S, ZHENG J, LIU K, et al. Pharmacological reprogramming of fibroblasts into neural stem cells by signaling-directed transcriptional activation[J]. Cell Stem Cell, 2016, 18: 653–667. DOI: 10.1016/j.stem.2016.03.020 |
| [37] | HU W, QIU B, GUAN W, WANG Q, WANG M, LI W, et al. Direct conversion of normal and Alzheimer's disease human fibroblasts into neuronal cells by small molecules[J]. Cell Stem Cell, 2015, 17: 204–212. DOI: 10.1016/j.stem.2015.07.006 |
| [38] | CHENG L, HU W, QIU B, ZHAO J, YU Y, GUAN W, et al. Generation of neural progenitor cells by chemical cocktails and hypoxia[J]. Cell Res, 2014, 24: 665–679. DOI: 10.1038/cr.2014.32 |
| [39] | LI X, ZUO X, JING J, MA Y, WANG J, LIU D, et al. Small-molecule-driven direct reprogramming of mouse fibroblasts into functional neurons[J]. Cell Stem Cell, 2015, 17: 195–203. DOI: 10.1016/j.stem.2015.06.003 |
| [40] | WANG H, CAO N, SPENCER C I, NIE B, MA T, XU T, et al. Small molecules enable cardiac reprogramming of mouse fibroblasts with a single factor, Oct4[J]. Cell Rep, 2014, 6: 951–960. DOI: 10.1016/j.celrep.2014.01.038 |
| [41] | ZHANG Y, CAO N, HUANG Y, SPENCER C I, FU J D, YU C, et al. Expandable cardiovascular progenitor cells reprogrammed from fibroblasts[J]. Cell Stem Cell, 2016, 18: 368–381. DOI: 10.1016/j.stem.2016.02.001 |
| [42] | CAO N, HUANG Y, ZHENG J, SPENCER C I, ZHANG Y, FU J D, et al. Conversion of human fibroblasts into functional cardiomyocytes by small molecules[J]. Science, 2016, 352: 1216–1220. DOI: 10.1126/science.aaf1502 |
| [43] | ZHU S, REZVANI M, HARBELL J, MATTIS A N, WOLFE A R, BENET L Z, et al. Mouse liver repopulation with hepatocytes generated from human fibroblasts[J]. Nature, 2014, 508: 93–97. DOI: 10.1038/nature13020 |
| [44] | LI K, ZHU S, RUSS H A, XU S, XU T, ZHANG Y, et al. Small molecules facilitate the reprogramming of mouse fibroblasts into pancreatic lineages[J]. Cell Stem Cell, 2014, 14: 228–236. DOI: 10.1016/j.stem.2014.01.006 |
| [45] | PIEPER A A, XIE S, CAPOTA E, ESTILL S J, ZHONG J, LONG J M, et al. Discovery of a proneurogenic, neuroprotective chemical[J]. Cell, 2010, 142: 39–51. DOI: 10.1016/j.cell.2010.06.018 |
| [46] | WANG G, HAN T, NIJHAWAN D, THEODOROPOULOS P, NAIDOO J, YADAVALLI S, et al. P7C3 neuroprotective chemicals function by activating the rate-limiting enzyme in NAD salvage[J]. Cell, 2014, 158: 1324–1334. |
| [47] | NORTH T E, GOESSLING W, WALKLEY C R, LENGERKE C, KOPANI K R, LORD A M, et al. Prostaglandin E2 regulates vertebrate haematopoietic stem cell homeostasis[J]. Nature, 2007, 447: 1007–1011. DOI: 10.1038/nature05883 |
| [48] | GOESSLING W, NORTH T E, LOEWER S, LORD A M, LEE S, STOICK-COOPER C L, et al. Genetic interaction of PGE2 and Wnt signaling regulates developmental specification of stem cells and regeneration[J]. Cell, 2009, 136: 1136–1147. DOI: 10.1016/j.cell.2009.01.015 |
| [49] | CUTLER C S, SHOEMAKER D, BALLEN K K, ROBBINS D, DESPONTS C, KAO G S, et al. FT1050 (16,16-dimethyl prostaglandin E2)-enhanced umbilical cord blood accelerates hematopoietic engraftment after reduced intensity conditioning and double umbilical cord blood transplantation[J]. Blood, 2011, 118: 653. |
| [50] | LI J, CASTEELS T, FROGNE T, INGVORSEN C, HONORÉ C, COURTNEY M, et al. Artemisinins target GABAA receptor signaling and impair α cell identity[J]. Cell, 2017, 168: 86–100. DOI: 10.1016/j.cell.2016.11.010 |
| [51] | ZHANG H, KOZONO D E, O'CONNOR K W, VIDAL-CARDENAS S, ROUSSEAU A, HAMILTON A, et al. TGF-β inhibition rescues hematopoietic stem cell defects and bone marrow failure in Fanconi anemia[J]. Cell Stem Cell, 2016, 18: 668–681. DOI: 10.1016/j.stem.2016.03.002 |
 2017, Vol. 38
2017, Vol. 38


