2. 军事医学科学院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China
紫杉醇(paclitaxel,PTX)是从红豆杉植物树皮中提取的四环二萜类,具有抗癌活性,作为微管稳定剂与β-微管蛋白结合可促进微管蛋白聚集,使细胞停止在有丝分裂的G2/M期,从而引起细胞凋亡以达到抗肿瘤目的[1]。临床上主要用于治疗转移性乳腺癌、晚期卵巢癌和非小细胞肺癌等恶性肿瘤[2]。PTX现有制剂主要为Taxol(泰素)、Abraxane(凯素)和注射用紫杉醇脂质体(力扑素)。Taxol中PTX含量仅为1%,其余99%均为辅料,而其主要辅料聚氧乙烯蓖麻油会导致严重的过敏反应、低血压和神经毒性;Abraxane的载药量有所增加,但也低于10%,且主要辅料为白蛋白,给药同期不可进行放射治疗[3-4]。注射用紫杉醇脂质体为南京绿叶思科药业有限公司研制,目前临床应用较少[5]。基于现状,我们需要寻找安全的载体,构建适宜的递药系统,增加PTX的溶解度,提高载药量,减小药物毒副作用。
聚合物胶束基于两亲性嵌段聚合物,通过自组装形成具有壳核结构的纳米粒子,实现对疏水性药物的荷载,显著提高抗肿瘤药物的溶解度[6]。胶束利用其纳米尺度和实体瘤高通透性和滞留 (enhanced permeability and retention effect,EPR)效应经血管渗透到肿瘤细胞;表面的亲水性基团可避免网状内皮系统的识别和吞噬,延长药物的体内循环时间,使得药物成功递送至肿瘤部位[7-8]。值得注意的是,聚合物胶束的形态对胶束的体内分布和药动学行为等具有重要影响[9]。Geng等[10]证实蠕虫状胶束的体内循环时间长达1周,是相同材料球形胶束的10倍。Christian等[11]报道圆柱体胶束相对球形胶束可以延长药物血液循环时间,提高药物抗肿瘤效果同时降低药物毒性。
聚2-口恶唑啉[poly(2-oxazoline),POx]具备相对分子质量分布范围窄、性质可调范围广以及优越的生物相容性等优点。本研究采用(聚2-甲基-2-口恶唑啉)29-b-(聚2-丁基-2-口恶唑啉)17-b-(聚2-甲基-2-口恶唑啉)21三嵌段共聚物作为载体,构建了载PTX的高荷载聚合物胶束递药系统,探索了PTX的投药量与胶束形态变化之间的关系,并对所得胶束的理化性质及体外抗肿瘤活性等进行了表征测定和考察。
1 材料和方法 1.1 仪器BP211D电子天平(瑞士Mettler Toledo公司);DL-360A超声波清洗器(上海之信仪器有限公司);LS-D202恒温金属浴(美国Fisher Scientific公司);UltiMate® 3000高效液相色谱仪(美国Thermo Fisher公司);Centrifuge 5418高速离心机(德国Eppendorf公司);Nano-ZEN3600激光粒度分析仪(英国Malvern公司);透射电子显微镜(日本JEOL公司);Multiskan MK3酶标仪(美国Thermo公司)。
1.2 药品和试剂PTX(纯度>98.0%,江苏红豆杉药业有限公司,批号:20131002);聚2-口恶唑啉(Advanced Polymer Materials Inc,批号:1601014);色谱纯乙腈、分析纯乙醇(国药集团化学试剂有限公司);人肺腺癌细胞系A549细胞(中国科学院上海细胞库);DMEM培养基、胎牛血清(英国Gibco公司);CCK-8试剂盒(日本同仁化学研究所)。
1.3 聚合物胶束的制备PTX胶束的制备工艺采用薄膜水化法[12]。精密称取适量的PTX和POx,分别加入乙醇溶解制得10 mg/mL的储备液,将二者按一定质量比(PTX∶POx=40∶100,80∶100或110∶100)混匀,空气流下挥干溶剂形成均匀薄膜,用去离子水/盐水水化即得胶束溶液粗品。将该粗品8 609×g高速离心5 min除去不溶物,取上清即得PTX胶束。
1.3.1 投药量对聚合物胶束形态和载药量的影响考察PTX理论投药量(0.4、0.8和1.1 mg)对聚合物胶束形态和载药量的影响。固定载体量为1 mg,观察投药量从0.4 mg增加至1.1 mg时胶束形态的变化。
1.3.2 盐浓度对聚合物胶束形态的影响固定水化溶液的量,分别以0%、0.9%和2.0%的NaCl溶液水化薄膜,制备胶束,考察NaCl浓度对聚合物胶束形态的影响。
1.4 聚合物胶束表征的测定 1.4.1 粒径及分布采用激光粒度分析仪考察胶束的粒径及分布,将新制备的PTX-POx胶束溶液加入适量生理盐水稀释。由于胶束溶液的浓度对粒径测定结果有影响,稀释倍数以POx质量浓度1 mg/mL为准计算,稀释后取80 μL置于微量样品池中进行粒径及分布测定。
1.4.2 胶束形态采用透射电子显微镜观察胶束的形态。取不同制备条件下PTX聚合物样品滴至铺有碳膜的铜网上,2.0%磷钨酸染色,自然干燥,待粒子在铜网上沉积后观察并拍照。
1.4.3 包封率和载药量采用高效液相色谱法(HPLC)测定包封率和载药量。色谱条件为[13]:色谱柱Agilent C18反相色谱柱(4.6 mm×150 mm,5 μm),流动相:乙腈-水(体积比55∶45),流速:1.0 mL/min,柱温:30℃,进样量:20 μL,检测波长:227 nm。精密移取上述制备胶束溶液100 μL,加流动相定容至1 mL,微孔滤膜过滤后进样测定。按公式计算包封率(entrapment efficiency,EE): EE (%)=胶束包载药物量/投药量×100%。按公式计算载药量(drug loading capacity,LC): LC (%)=胶束包载药物量/载药胶束总质量×100%,其中载药胶束总质量指投入的药物质量与辅料质量之和。
1.4.4 体外释放度采用膜透析法考察载药胶束的体外释放行为,释放介质分别为pH=7.4的PBS和含2%小牛血清白蛋白(BSA)的PBS。利用释放介质将胶束溶液稀释成0.1 mg/mL,取1 mL置于截留相对分子质量为3 500的透析袋中,两端封好,将含药透析袋置于含100 mL释放介质的烧杯中,在37℃、100 r/min摇床条件下进行释放,分别于1、2、3、4、6、8、10、12、24 h时吸取适量透析液,并及时补充等量同温释放介质。PBS释放介质中取出的样品微孔滤膜过滤后HPLC进样检测,含BSA的释放介质中取出的样品用甲醇沉淀蛋白后HPLC进样检测。计算不同时间点时药物的累积释放百分率,绘制时间-累积释放率曲线。
1.5 细胞毒性实验选取对数生长期的人肺腺癌细胞系A549细胞,胰酶消化制备单细胞悬液,显微镜计数,调整细胞密度为5×104/mL,以每孔100 μL的单细胞悬液量接种于96孔板中,细胞悬液周围外孔需加入100 μL PBS防止边缘效应,在37℃、5% CO2条件下孵育12 h。细胞贴壁后,弃除旧培养基,加入不同浓度的含药培养基,每孔100 μL,每个处理组每个药物浓度设3个复孔,继续在37℃、5% CO2条件下孵育48 h。PTX注射剂Taxol和PTX胶束组药物浓度均为0.001、0.004、0.013、0.04、0.12、0.37、1.11、3.33和10 μg/mL。加药处理48 h后弃去含药培养基,每孔加入100 μL含10% CCK-8的细胞培养基,孵育2~3 h,采用酶标仪于450 nm处测定各孔光密度(D)值。计算细胞存活率:细胞存活率(%)=(实验组D值-空白组D值)/(未处理组D值-空白组D值)×100%。采用GraphPad 5.0软件绘制药物浓度-细胞存活率图。
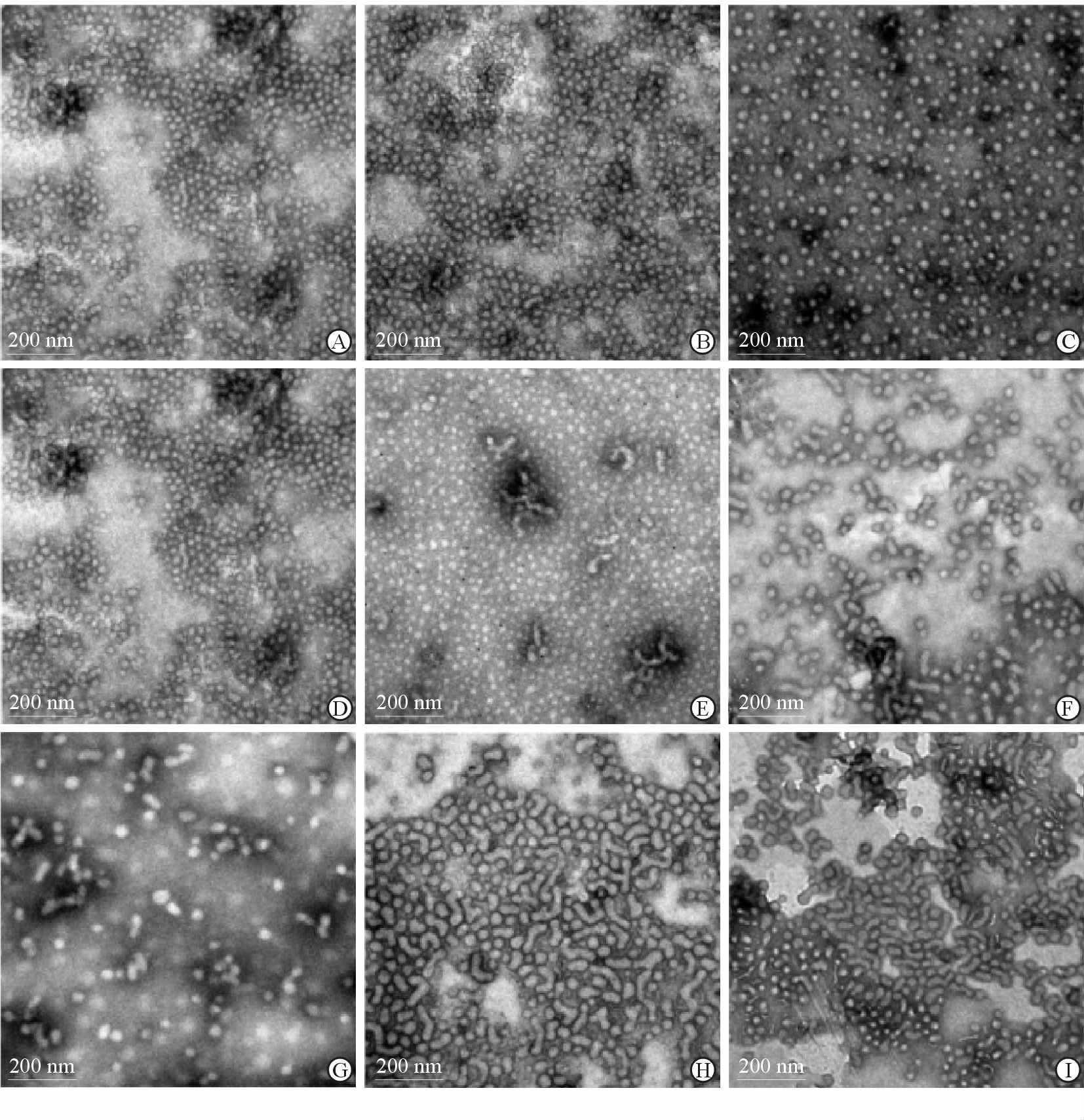
2 结 果 2.1 胶束制备条件的考察 2.1.1 投药量对聚合物胶束形态和载药量的影响结果见图 1。固定载体量为1 mg,透射电镜观察可知,投药量为0.4和0.8 mg (即投药比为40∶100和80∶100)时,胶束呈现球形(图 1A~1F);投药量增加至1.1 mg(投药比为110∶100)时,胶束由球形逐渐延长,转变成蠕虫状(图 1G~1I)。当投药量为0.4 mg时,胶束载药量为(25.62±0.02)%;增大投药量至0.8或1.1 mg时,载药量大幅提升至(40.49±2.03)%、(40.34±0.51)%。综合考虑,我们确定制备球形胶束的投药量为0.8 mg,制备蠕虫状胶束的投药量为1.1 mg。
|
图 1 不同制备工艺条件下胶束的透射电镜下形态 Fig 1 Morphologies of micelles with different preparation processes under transmission electron microscope A-C: 0.4 mg PTX; D-F: 0.8 mg PTX; G-I: 1.1 mg PTX; A,D,G: DI water; B,E,H: 0.9% NaCl; C,F,I: 2.0% NaCl. PTX: Paclitaxel; DI water: Deionized water |
2.1.2 盐浓度对聚合物胶束形态的影响
结果见图 1。当投药比为40∶100时,加入0.9%或者2.0% NaCl溶液水化对胶束的形态没有明显影响(图 1B、1C);当投药比为80∶100时,2.0%的NaCl溶液水化后部分胶束逐渐由球形延长成为短棒状(图 1F);当投药比为110∶100时,加入0.9% NaCl溶液水化,大量胶束呈现蠕虫状(图 1H),而NaCl浓度继续升至2.0%未引起胶束形态的剧烈变化(图 1I)。这显示了在胶束形成的过程中,决定胶束形态的主因是投药量的增加,辅因是NaCl溶液浓度的提高。考虑到后期的动物实验,在给药时维持药液生理渗透压可减少对动物的刺激性,确定后续制备时均采用生理盐水(0.9% NaCl溶液)水化。
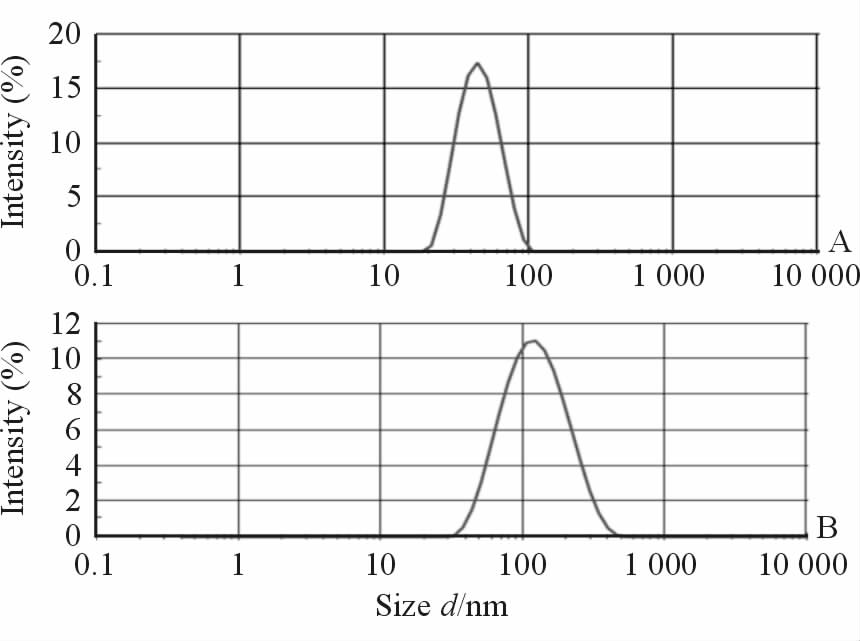
2.2 胶束的表征 2.2.1 粒径及分布由图 2可见投药比为80∶100时,所得球形胶束的粒径为(43.17±0.95) nm,多分散性指数(PDI)约为0.09;投药比为110∶100时,制得的蠕虫状胶束的粒径为 (107.83±1.51) nm,PDI约为 0.226。结果表明薄膜水化法制备的载药胶束粒度分布均匀,有助于充分利用EPR效应向肿瘤内部渗透。
|
图 2 球形胶束粒径分布(A)和蠕虫状胶束粒径分布(B) Fig 2 Particle size distributions of spherical micelles (A) and worm-like micelles (B) A: PTX∶POx=80∶100; B: PTX∶POx=110∶100. PTX: Paclitaxel; POx: Poly(2-oxazoline) |
2.2.2 包封率
固定载体量为1 mg,当投药量为0.4 mg时胶束包封率为(89.85±0.06)%;增加投药量至0.8 mg时,包封率为(77.08±2.93)%;继续增加投药量至1.1 mg时,包封率为(77.08±0.97)%,说明随着投药量的增加包封率降低。
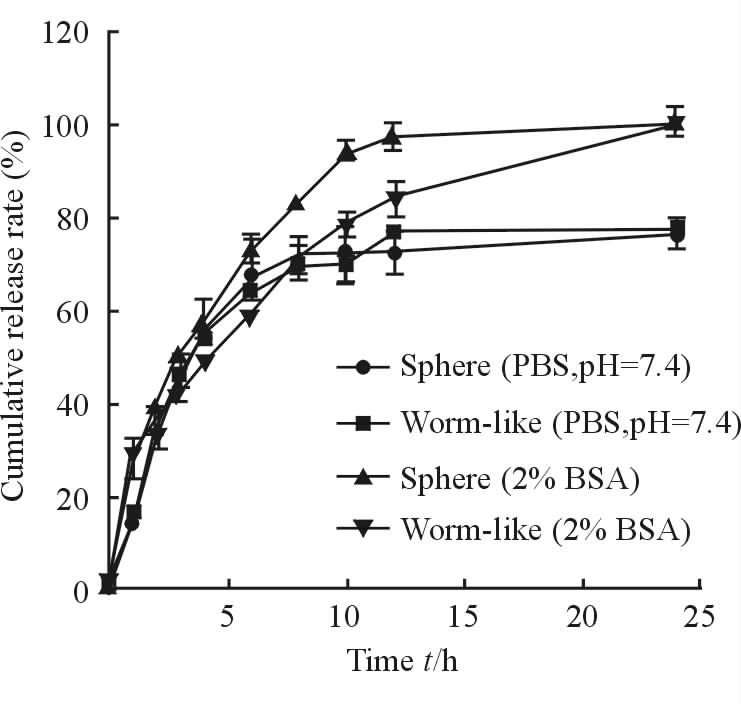
2.2.3 体外释放度图 3为球形和蠕虫状胶束在PBS (pH=7.4)和含2% BSA溶液中的释放曲线。结果显示,在PBS介质中,两种形态的胶束12 h累积释放量达75%;在含2% BSA的介质中,蠕虫状胶束较球形胶束释放速率减缓,24 h药物均可完全释放。胶束在4 h释药50%左右,表明在释放初始阶段均存在突释现象;但随后释放缓慢,有利于维持体内药物浓度。
|
图 3 球形胶束和蠕虫状胶束在不同介质中体外释放的时间-累积释放率曲线 Fig 3 In vitro time-cumulative release curve of spherical micelles and worm-like micelles in different media PBS: Phosphate buffer saline; BSA: Bovine serum albumin. n=3,x±s |
2.3 细胞毒性实验
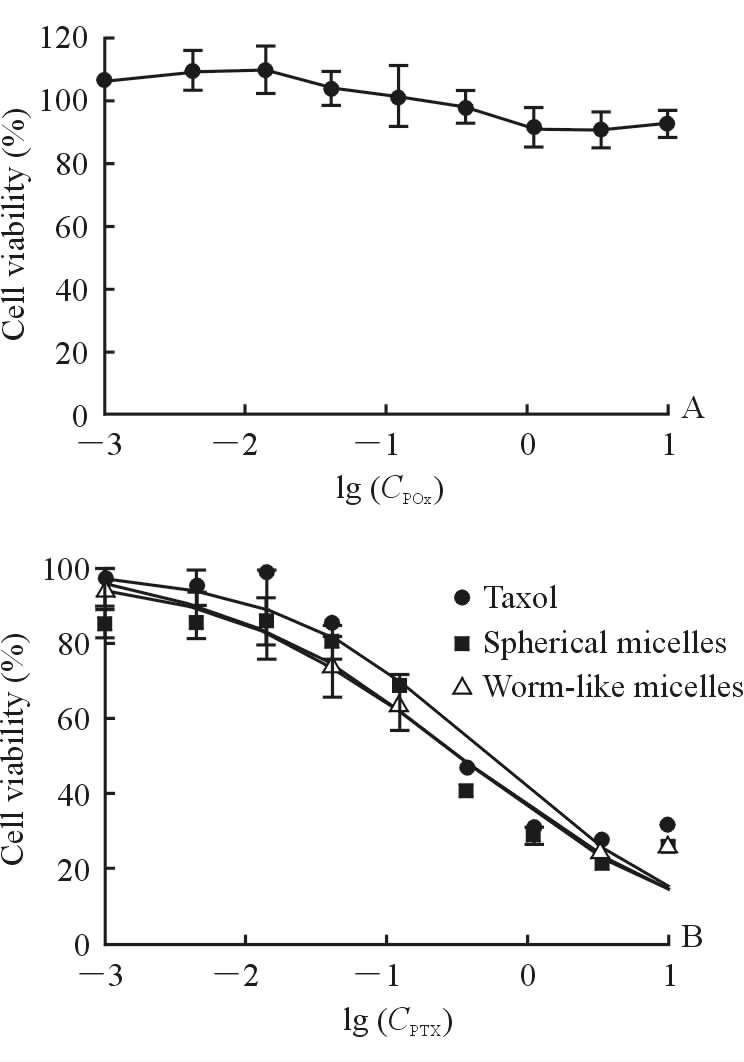
如图 4A所示,POx载体对细胞几乎无毒性。如图 4B所示,PTX注射剂Taxol和载PTX胶束对A549细胞均存在浓度依赖性杀伤作用。Taxol、球形胶束和蠕虫状胶束对A549细胞的IC50值分别为0.568、0.336和0.342 μg/mL,均能杀伤A549肺癌细胞株。
|
图 4 空白载体(A)和不同PTX制剂(B)对A549细胞的活性影响 Fig 4 In vitro cytotoxicity of blank micelles (A) and different PTX formulations (B) in A549 cells CPOx: Concentration of POx; CPTX: Concentration of PTX. POx: Poly(2-oxazoline); PTX: Paclitaxel. n=3,x±s |
3 讨 论
聚2-口恶唑啉类聚合物在20世纪60年代被首次报道[14],直至近年来始发现该聚合物亲疏水性质可调,通过活性开环反应可合成系列嵌段共聚物,从而构建纳米聚合物胶束递药系统[12, 15]。本实验选择聚2-口恶唑啉类三嵌段聚合物作为递药载体,其对紫杉烷类药物亲和力高、增溶能力强,通过自组装实现了对PTX的高荷载,其载药量高达40%,可有效减小辅料使用量。其中,载药量的测定鉴于PTX的水溶性差(溶解度仅约1 μg/mL)[16],高速离心后胶束外游离PTX浓度极低,故可忽略不计。
与粒径、电荷性质相似,嵌段聚合物胶束的形态对胶束的载药、体内分布和药动学行为具有重要影响。本研究结果显示随着投药量的增加,胶束由球形转变成了蠕虫状。我们猜测这种形态的转变是由于PTX与聚2-口恶唑啉载体间存在氢键作用,随着药物量的增大,氢键作用增强,疏水内核体积增大,亲水性外壳变薄,使得部分裸露的内核相互连接,导致球形胶束向蠕虫状转变,后期我们将通过具体实验验证。实验表明投药量是形态变化的主因,水化溶剂中的盐浓度对胶束形态也有重要影响。NaCl的加入使得体系中电解质浓度增强,嵌段聚合物临界聚集浓度减小,聚合物更易生长成蠕虫状。
综上,本实验通过薄膜水化法构建了2种形态的载PTX聚2-口恶唑啉胶束,其粒径分布均一,包封率和载药量较高,细胞毒性实验验证其具备抗肿瘤活性。在后续实验中,我们将对不同形态胶束的成形机制和体内抗肿瘤活性作进一步探究。
| [1] | MAGALHAES L G, MARQUES F B, DA FONSECA M B, ROGÉRIO K R, GRAEBIN C S, ANDRICOPULO A D. Discovery of a series of acridinones as mechanism-based tubulin assembly inhibitors with anticancer activity[J/OL]. PLoS One, 2016, 11:e0160842. doi:10.1371/journal. pone.0160842. eCollection 2016. |
| [2] | ZHANG Z, MEI L, FENG S S. Paclitaxel drug delivery systems[J]. Expert Opin Drug Deliv, 2013, 10: 325–340. DOI: 10.1517/17425247.2013.752354 |
| [3] | Hennenfent K L, Govindan R. Novel formulations of taxanes:a review. Old wine in a new bottle?[J]. Ann Oncol, 2006, 17: 735–749. DOI: 10.1093/annonc/mdj100 |
| [4] | DESAI N P, TRIEU V, HWANG L Y, WU R, SOON-SHIONG P, GRADISHAR W J. Improved effectiveness of nanoparticle albumin-bound (nab) paclitaxel versus polysorbate-based docetaxel in multiple xenografts as a function of HER2 and SPARC status[J]. Anti-cancer Drug, 2008, 19: 899–909. DOI: 10.1097/CAD.0b013e32830f9046 |
| [5] | MARUPUDI N I, HAN J E, LI K W, RENARD V M, TYLER B M, BREM H. Paclitaxel:a review of adverse toxicities and novel delivery strategies[J]. Expert Opin Drug Saf, 2007, 6: 609–621. DOI: 10.1517/14740338.6.5.609 |
| [6] | SAVIĆ R, EISENBERG A, MAYSINGER D. Block copolymer micelles as delivery vehicles of hydrophobic drugs:micelle-cell interactions[J]. J Drug Target, 2006, 14: 343–355. DOI: 10.1080/10611860600874538 |
| [7] | RÖSLER A, VANDERMEULEN G W M, KLOK H A. Advanced drug delivery devices via self-assembly of amphiphilic block copolymers[J]. Adv Drug Deliver Rev, 2001, 53: 95–108. DOI: 10.1016/S0169-409X(01)00222-8 |
| [8] | GAUCHER G, DUFRESNE M H, SANT V P, KANG N, MAYSINGER D, LEROUX J C. Block copolymer micelles:preparation, characterization and application in drug delivery[J]. J Control Release, 2005, 109: 169–188. DOI: 10.1016/j.jconrel.2005.09.034 |
| [9] | CAI S, VIJAYAN K, CHENG D, LIMA E M, DISCHER D E. Micelles of different morphologies-advantages of worm-like filomicelles of PEO-PCL in paclitaxel delivery[J]. Pharm Res, 2007, 24: 2099–2109. DOI: 10.1007/s11095-007-9335-z |
| [10] | GENG Y A N, DALHAIMER P, CAI S, TSAI R, TEWARI M, MINKO T, et al. Shape effects of filaments versus spherical particles in flow and drug delivery[J]. Nat Nanotechnol, 2007, 2: 249–255. DOI: 10.1038/nnano.2007.70 |
| [11] | CHRISTIAN D A, CAI S, GARBUZENKO O B, HARADA T, ZAJAC A L, MINKO T, et al. Flexible filaments for in vivo imaging and delivery:persistent circulation of filomicelles opens the dosage window for sustained tumor shrinkage[J]. Mol pharm, 2009, 6: 1343–1352. DOI: 10.1021/mp900022m |
| [12] | LUXENHOFER R, SCHULZ A, ROQUES C, LI S, BRONICH T K, BATRAKOVA E V, et al. Doubly amphiphilic poly(2-oxazoline)s as high-capacity delivery systems for hydrophobic drugs[J]. Biomaterials, 2010, 31: 4972–4979. DOI: 10.1016/j.biomaterials.2010.02.057 |
| [13] | BERNABEU E, GONZALEZ L, LEGASPI M J, MORETTON M A, CHIAPPETTA D A. Paclitaxel-loaded TPGS-b-PCL nanoparticles:in vitro cytotoxicity and cellular uptake in MCF-7 and MDA-MB-231 cells versus mPEG-b-PCL nanoparticles and abraxane®[J]. J Nanosci Nanotechnol, 2016, 16: 160–170. DOI: 10.1166/jnn.2016.10739 |
| [14] | KAGIYA T, NARISAWA S, MAEDA T, FUKUI K. Ring-opening polymerization of 2-substituted 2-oxazolines[J]. J Polym Sci B Pol Lett, 1966, 4: 441–445. DOI: 10.1002/pol.1966.110040701 |
| [15] | LUXENHOFER R, HAN Y, SCHULZ A, TONG J, HE Z, KABANOV A V, et al. Poly(2-oxazoline)s as polymer therapeutics[J]. Macromol Rapid Comm, 2012, 33: 1613–1631. DOI: 10.1002/marc.201200354 |
| [16] | LIGGINS R T, HUNTER W L, BURT H M. Solid-state characterization of paclitaxel[J]. J Pharm Sci, 1997, 86: 1458–1463. DOI: 10.1021/js9605226 |
 2017, Vol. 38
2017, Vol. 38


