流产指妊娠不足28周、胎儿体质量不足1 000 g而终止妊娠。流产分为自然流产(spontaneous abortion,SA)和人工流产(induced abortion,IA)。胚胎着床后有31%发生自然流产,其中80%为早期自然流产(early spontaneous abortion)。早期自然流产即在妊娠12周以前出现阴道出血和(或)腹痛,主要的病因包括胚胎染色体异常、母体内分泌疾病、生殖器畸形、环境及免疫因素等;但其具体影响机制尚不清楚。滋养层细胞向子宫的增殖、迁移及侵袭是人类胚胎植入和胎盘形成的重要环节。滋养层细胞的侵袭过程与肿瘤的侵袭相似,受许多因素调控,它们之间的平衡保证早孕期滋养层细胞的正常侵袭和胚胎的正常发育,任何一个环节发生异常将可能导致流产的发生[1]。
人类基因组的研究结果显示仅有2%的基因编码蛋白,其他序列尽管不编码蛋白质,但绝大部分可以被转录为RNA,这些不能编码蛋白的RNA被统称为非编码RNA[2]。近年来,长链非编码RNA(lncRNA)越来越受人们关注,起初lncRNA被认为是基因组转录的“噪音”,是RNA聚合酶Ⅱ转录的副产物,没有生物学功能;而经过对lncRNA深入研究,发现lncRNA参与了多种基因组调控过程,如基因组印记、X染色体沉默、转录激活及转录干扰等[3-4]。
研究发现,lncRNA母系印记基因3(MEG3)是一种抑癌基因,在调节细胞增殖及侵袭等功能中发挥重要作用[5],已有报道称MEG3是一种垂体肿瘤的相关基因,在无功能性垂体腺瘤中高表达[6],近年还发现MEG3在胃癌、肺癌及胚胎性横纹肌瘤中也表达异常[5, 7-8]。我们前期研究(未发表资料)发现,C57小鼠胎肝芯片筛选结果显示MEG3是上调倍数较高的RNA之一,在小鼠胎肝中高表达;但MEG3对胚胎的生长发育是否具有调节作用并不清楚。早期绒毛的发育是胚胎发育的前提和基础,滋养层细胞的侵袭及增殖能力对早期绒毛发育至关重要。本实验旨在探讨lncRNA MEG3在早期绒毛发育中的作用。研究证实,凋亡因子Bax及凋亡抑制因子Bcl-2与肿瘤细胞的凋亡密切相关[9],滋养层细胞的增殖及凋亡在早期胚胎发育及胚胎植入过程中发挥重要作用,那么Bax与Bcl-2的表达是否影响了滋养层细胞的功能并导致早期绒毛发育异常,本文也将进行初步探讨。
1 材料和方法 1.1 研究材料人滋养层细胞系HTR-8/SVneo细胞(复旦大学妇产科医院李大金教授惠赠);DMEM/F12培养液(美国HyClone公司);胎牛血清、Opti-MEN培养液(美国Gibco公司 );RNAiso、qPCR相关试剂(日本TaKaRa公司);LipofectamineTM 3000转染试剂盒(美国Invitrogen公司);PI染液(美国Sigma公司);凋亡检测试剂盒、Matrigel胶(美国BD Bioscience公司);miRNA反转录引物、U6内参(中国西安沃尔森公司);Transwell小室(美国Millipore公司);Bax兔抗人抗体、Bcl-2兔抗人抗体(美国Bioworld公司);二抗羊抗兔抗体 (中国博士德公司)。
1.2 患者与临床样本收集收集上海市长宁区中心医院30例早期流产患者(妊娠7~9周)的绒毛组织,其中自然流产和人工流产患者各15例,已通过第二军医大学长征医院伦理委员会审核;标本采集前告知患者用途,签订知情同意书;绒毛组织样本收集即刻,用PBS冲洗后放入液氮以便运输,后保存于-80℃冰箱。
1.3 细胞培养及处理从-80℃冰箱中取出HTR-8/SVneo细胞,复苏、培养,培养液为含12%胎牛血清、100 IU/mL青霉素和100 mg/mL链霉素的DMEM/F12培养液,置于37℃、5%CO2的孵箱中培养。在转染前1 d取生长状态好的细胞,用0.25%胰酶消化,以3×105/mL细胞密度、每孔2 mL接种于6孔板中。待细胞生长融合度达到70%~80%时,按照LipofectamineTM 3000转染试剂盒操作说明用MEG3-PCDN 3.0转染细胞;转染48 h时收集细胞,并用qPCR检测转染效率。MEG3引物由美国Invitrogen公司合成,上游序列 5′-CTG CCC ATC TAC ACC TCA CG-3′,下游序列5′-CTC TCC GCC GTC TGC GCT AGG GGC T-3′。
1.4 细胞侵袭实验HTR-8/SVneo细胞在转染48 h后,在24孔板中放置膜孔直径为8 μm的迁移小室,将细胞按1.0×104/mL的密度接种于小室中;实验分3组:MEG3-PCDN 3.0组、PCDN 3.0组(空载)和空白对照组。将细胞放置于5% CO2、37℃孵箱中培养48 h,用0.1%结晶紫染色,使用光学显微镜观察各组细胞的迁移能力,并采集图像。
1.5 qPCR法检测lncRNAMEG3的表达 用TRIzol试剂分别提取15例自然流产绒毛和15例人工流产绒毛标本的总RNA,取2 μg总RNA,利用TaKaRa反转录试剂盒反转录获得cDNA。qPCR扩增体系:95℃预变性5 min;循环扩增40次(95℃变性15 s、60℃退火15 s、72℃延伸20 s);随后检测熔解曲线及扩增曲线情况。以GAPDH作为内参基因,引物序列为:上游 5′-ACC ACA GTC CAT GCC ATC AC-3′,下游5′-TCC ACC ACC CTG TTG CTG TA-3′。用2-ΔΔCt方法计算MEG3的实时定量数据,分析自然流产和人工流产绒毛中MEG3的表达情况。
1.6 免疫组织化学检测Bax和Bcl-2的表达绒毛经4%多聚甲醛固定、常规脱水,4 μm连续冰冻切片,胰酶消化处理,然后水化,用0.01 mol/L pH 7.2~7.4的PBS洗5 min,冷风吹干,放入湿盒中;滴加稀释后的荧光抗体,4℃过夜;用PBS洗2次、蒸馏水洗1次后,采用抗荧光衰减封片剂封片。在光学显微镜下观察。
1.7 统计学处理所有实验均重复3次,除非特殊指明。采用Excel软件进行数据处理。计量资料采用x±s表示,两组间比较采用非配对t检验,多组间比较采用方差分析,检验水准(α)为0.05。
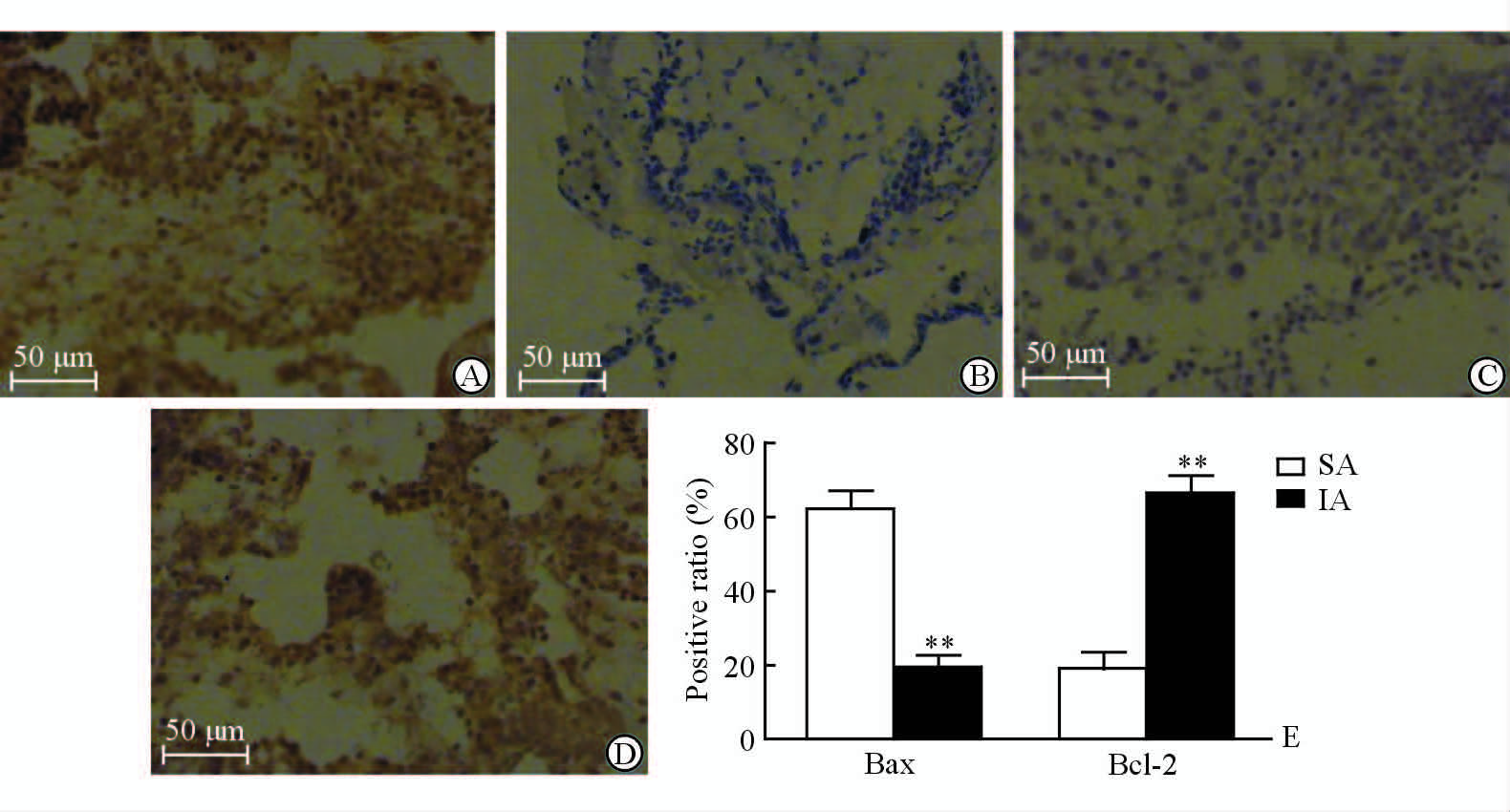
2 结 果 2.1 Bax和Bcl-2在早期流产绒毛的表达利用免疫组织化学法检测自然流产及人工流产绒毛中Bax及Bcl-2的表达情况。结果显示人工流产组绒毛中Bax的表达低于自然流产组,而Bcl-2的表达高于自然流产组(P<0.01,图 1)。
|
图 1 免疫组织化学法检测自然流产和人工流产绒毛中Bax和Bcl-2的表达 Fig 1 The expression of Bax and in SA and Bcl-2 IA by immunohistochemistry A,B: Bax; C,D: Bcl-2; A,C: SA group; B,D: IA group. E: The positive ratio of Bax and Bcl-2 in SA and IA groups. SA: Spontaneous abortion; IA: Induced abortion. **P<0.01 vs SA group. n=3,x±s |
2.2 lncRNA MEG3
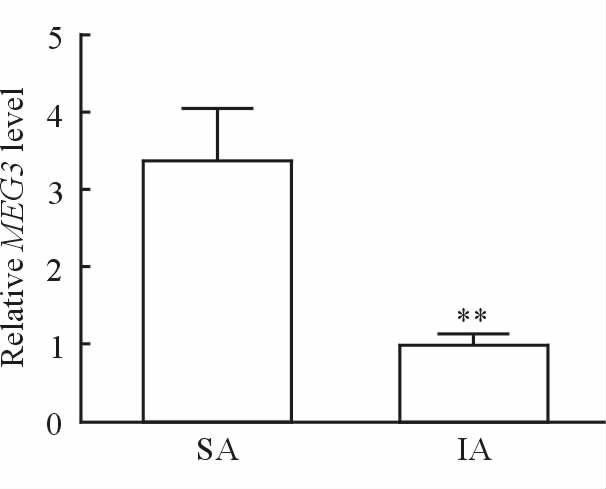
在早期流产绒毛的表达 采用qPCR检测自然流产组和人工流产组绒毛中lncRNAMEG3的表达情况,结果显示人工流产组绒毛中MEG3水平低于自然流产组,差异有统计学意义(P<0.01,图 2)。
|
图 2 qPCR检测自然流产和人工流产绒毛中 lncRNA MEG3的表达 Fig 2 The expression of lncRNA MEG3 in SA and IA by qPCR SA: Spontaneous abortion; IA: Induced abortion. **P<0.01 vs SA groups. n=3,x±s |
2.3 人滋养层细胞系HTR-8/SVneo细胞过表达lncRNA
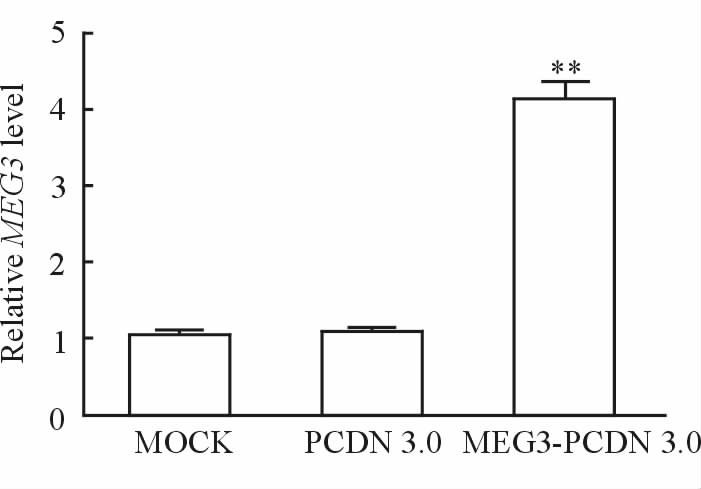
MEG3 在HTR-8/SVneo细胞转染48 h时,采用qPCR检测MEG3-PCDN 3.0的转染情况。转染MEG3-PCDN 3.0后,MEG3的表达较空载PCDN 3.0组增加,差异有统计学意义(P<0.01,图 3)。
|
图 3 qPCR检测转染后人滋养层细胞系HTR-8/SVneo 细胞中lncRNA MEG3的表达 Fig 3 The expression level of lncRNA MEG3in HTR-8/SVneo cells by qPCR MOCK: Blank group; PCDN 3.0: Empty vector group; MEG3-PCDN 3.0: MEG3 overexpression group. **P<0.01 vs PCDN 3.0 groups. n=3,x±s |
2.4 过表达MEG3抑制HTR-8/SVneo细胞的侵袭能力
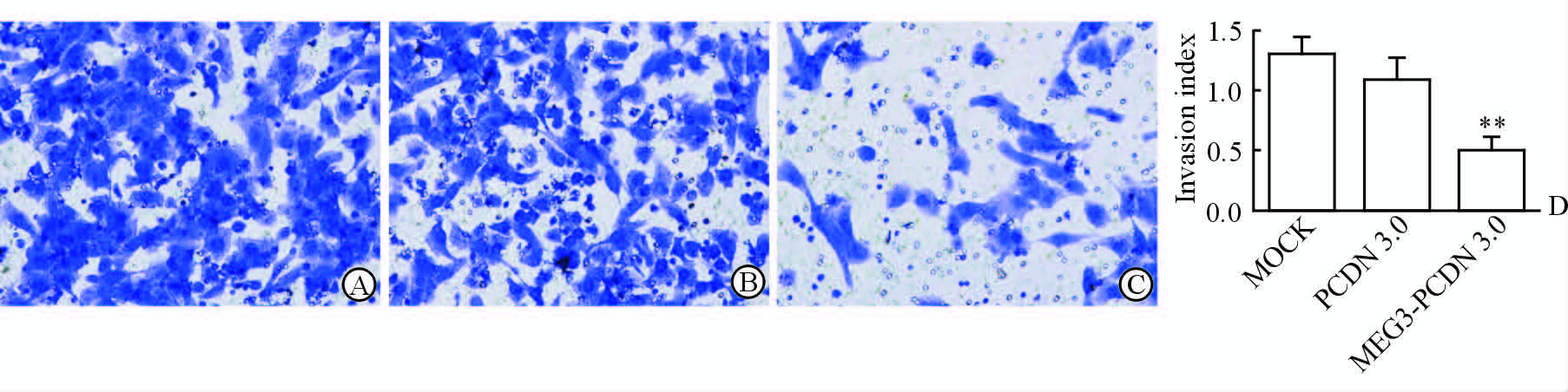
转染HTR-8/SVneo细胞48 h后,检测MEG3-PCDN 3.0组、PCDN 3.0组和空白对照组细胞的侵袭能力。结果显示,与空白对照组和PCDN 3.0组相比,MEG3-PCDN 3.0组HTR-8/SVneo细胞的侵袭能力受到抑制,差异有统计学意义(P<0.01,图 4)。
|
图 4 lncRNA MEG3过表达对HTR-8/SVneo侵袭能力影响 Fig 4 The effect of lncRNA MEG3 on HTR-8/SVneo cell invasion ability A: The invasion ability of HTR-8/SVneo cells in MOCK group; B: The invasion ability in PCDN 3.0 group; C: The invasion ability in MEG3-PCDN 3.0 group; D: The invasion index of three groups showing that the HTR-8/SVneo cells in MEG3-PCDN 3.0 group have an obvious inhibition effect on the invasion ability. MOCK: Blank group; PCDN 3.0: Empty vector group; MEG3-PCDN 3.0: MEG3 overexpression group. Original magnification: ×20 (A-C). **P<0.01 vs MOCK or PCDN 3.0 group. n=3,x±s |
3 讨 论
研究发现,早期妊娠阶段滋养层细胞向子宫蜕膜增殖、侵袭,对其过程的调控是妊娠成功的关键[10-11]。滋养层细胞来自滋养外胚层,是人类胚胎中分化、发育最早的细胞类型之一,是母-胎界面唯一与母体免疫系统直接接触的胎儿细胞,在胚胎植入、母-胎免疫耐受过程中发挥重要作用[12-13]。滋养层细胞的增殖、分化、凋亡及侵袭性行为是胎盘形成、胚胎发育及妊娠顺利完成的基本要素,而对滋养层细胞的增殖、分化、凋亡及侵袭性行为调控的分子机制一直是近年来的研究热点。
滋养层细胞的增殖及凋亡在早期胚胎发育及植入过程中发挥重要作用,而Bax与Bcl-2的表达参与了细胞凋亡过程。本研究比较了自然流产和人工流产绒毛中Bax与Bcl-2的表达水平,结果显示人工流产组绒毛中Bax的表达低于自然流产组,Bcl-2的表达高于自然流产组,提示自然流产的绒毛组织发育不良、细胞凋亡增加可能是导致自然流产的重要原因之一。
表观遗传学调控机制参与了滋养层细胞增殖、分化、凋亡及侵袭性行为的调控,研究表明lncRNA在胎盘及胚胎发育过程中也发挥重要的调控作用[11, 14],如miR-155、miR-210、miR-195等。lncRNA MEG3位于染色体14q32上,已经报道MEG3是一种垂体相关的抑癌基因[15]。进一步的研究发现,MEG3在许多正常组织中也有表达,如在脑组织及脑垂体呈高表达[16],而在胃癌、结肠癌等肿瘤组织中表达降低甚至缺失[17-18];此外有研究发现过表达MEG3可抑制肿瘤生长,可能是一种抑癌基因[19-20]。虽然MEG3与肿瘤生长密切相关,但 MEG3对胎盘及胚胎发育的影响并不清楚。本研究结果显示人工流产绒毛中MEG3的表达水平低于自然流产,提示MEG3可能参与调节绒毛发育过程。而在人滋养层细胞系HTR-8/SVneo细胞中过表达MEG3的HTR-8/SVneo细胞侵袭能力下降,提示MEG3可能参与调节滋养层细胞的侵袭能力,进而调节早期绒毛的发育过程。但MEG3对早期绒毛发育的调节机制尚不清楚,有待进一步研究。
胚胎植入和胎盘形成是人类孕育过程中的重要环节,影响此过程的任何因素都可能导致流产,绒毛的发育及功能异常则是其中重要的因素之一。本研究发现Bax、Bcl-2在自然流产和人工流产绒毛中的表达存在差异,Bax、Bcl-2参与了绒毛的发育过程,其表达异常导致的细胞凋亡增加可能是导致自然流产的重要原因之一;lncRNA MEG3也可能通过抑制滋养层细胞的侵袭能力调节早期绒毛的发育过程。进一步阐明其作用机制将对不明原因流产的诊治和预后具有重要的临床意义。
| [1] | VITIELLO D, PATRIZIO P. Implantation and early embryonic development:implications for pregnancy[J]. Semin Perinatol, 2007, 31: 204–207. DOI: 10.1053/j.semperi.2007.05.006 |
| [2] | LEE J T. Epigenetic regulation by long noncoding RNAs[J]. Science, 2013, 338: 1435–1439. |
| [3] | ANDREW T, SHARPLESS N E. Genetic "lnc"-age of noncoding RNAs to human disease[J]. J Clin Invest, 2012, 122: 3837–3839. DOI: 10.1172/JCI66645 |
| [4] | CABILI M N, TRAPNELL C, GOFF L, KOZIOL M, TAZON-VEGA B, REGEV A, et al. Integrative annotation of human large intergenic noncoding RNAs reveals global properties and specific subclasses[J]. Genes Dev, 2011, 25: 1915–1927. DOI: 10.1101/gad.17446611 |
| [5] | ZHOU Y, ZHANG X, KLIBANSKI A. MEG3 noncoding RNA:a tumor suppressor[J]. J Mol Endocrinol, 2012, 48: R45–R53. DOI: 10.1530/JME-12-0008 |
| [6] | BALIK V, SROVNAL J, SULLA I, KALITA O, FOLTANOVA T, VAVERKA M, et al. MEG3:a novel long noncoding potentially tumour-suppressing RNA in meningiomas[J]. J Neurooncol, 2013, 112: 1–8. DOI: 10.1007/s11060-012-1038-6 |
| [7] | BENETATOS L, VARTHOLOMATOS G, HATZIMICHAEL E. MEG3 imprinted gene contribution in tumorigenesis[J]. Int J Cancer, 2011, 129: 773–779. DOI: 10.1002/ijc.v129.4 |
| [8] | 曹娟, 文飞球, 徐金永, 陈小文, 崔东, 李红, 等. 长链非编码RNA MEG3在胚胎性横纹肌肉瘤凋亡中的研究[J]. 中国小儿血液与肿瘤杂志, 2013, 18: 120–123. |
| [9] | REED J C. Proapoptotic multidomain Bcl-2/Bax-family proteins:mechanisms, physiological roles, and therapeutic opportunities[J]. Cell Death Differ, 2006, 13: 1378–1386. DOI: 10.1038/sj.cdd.4401975 |
| [10] | LALA P K, CHAKRABORTY C. Factors regulating trophoblast migration and invasiveness:possible derangements contributing to preeclampsia and fetal injury[J]. Placenta, 2003, 24: 575–587. DOI: 10.1016/S0143-4004(03)00063-8 |
| [11] | NORWITZ E R, SCHUST D J, FISHER S J. Implantation and the survival of early pregnancy[J]. N Engl J Med, 2001, 345: 1400–1408. DOI: 10.1056/NEJMra000763 |
| [12] | CROSS J C. How to make a placenta:mechanisms of trophoblast celldifferentiation in mice:a review[J]. Placenta, 2005, 26: S3–S9. DOI: 10.1016/j.placenta.2005.01.015 |
| [13] | PIJNENBORG R. Implantation and immunology:maternal inflammatory and immune cellular responses to implantation and trophoblast invasion[J]. Reprod Biomed Online, 4(Suppl 3): 14–17. |
| [14] | YIN L J, ZHANG Y, LÜ P P, HE W H, WU Y T, LIU A X, et al. Insufficient maintenance DNA methylation is associated with abnormal embryonic development[J]. BMC Med, 2012, 10: 26. DOI: 10.1186/1741-7015-10-26 |
| [15] | MENON A G, RUTTER J L, VON SATTEL J P, SYNDER H, MURDOCH C, BLUMENFELD A, et al. Frequent loss of chromosome 14 in atypical and malignant meningioma:identification of a putative ‘tumor progression’ locus[J]. Oncogene, 1997, 14: 611–616. DOI: 10.1038/sj.onc.1200853 |
| [16] | MEZZOMO L C, GONZALES P H, PESCE F G, KRETZMANN FILHO N, FERREIRA N P, OLIVEIRA M C, et al. Expression of cell growth negative regulators MEG3 and GADDγ is lost in most sporadic human pituitary adenomas[J]. Pituitary, 2012, 15: 420–427. DOI: 10.1007/s11102-011-0340-1 |
| [17] | 孙倩, 刘博巽, 林梦洁, 尹凌帝, 陈志强, 孙明, 等. 长链非编码RNA MEG3对胃癌细胞增殖的影响[J]. 南京医科大学学报(自然科学版), 2014, 34: 1–6. |
| [18] | 李苹, 杨凯云, 曾龙剑, 徐俪炬, 姚树祥, 吴锡南, 等. 长链非编码RNA MEG3等在肺癌组织中的表达[J]. 环境与健康杂志, 2013, 30: 988–990. |
| [19] | YING L, HUANG Y, CHEN H, WANG Y, XIA L, CHEN Y, et al. Downregulated MEG3 activate sautophagy and increases cell proliferation in bladder cancer[J]. Mol Biosyst, 2013, 9: 407–411. DOI: 10.1039/c2mb25386k |
| [20] | ZHOU Y, ZHANG X, KLIBANSKI A. MEG3 noncoding RNA:a tumor suppressor[J]. J Mol Endocrinol, 2012, 48: R45–R53. DOI: 10.1530/JME-12-0008 |
 2017, Vol. 38
2017, Vol. 38


