2. 北方战区陆军65571部队卫生队, 四平 136000
2. Medical Team, No. 65571 Troop of PLA Northern Theater Command, Siping 136000, Jilin, China
作为自体骨及同种异体骨的替代品,人工骨也许是治疗骨缺损最有前途的方法之一[1-2]。因此,与自然骨结构类似、具备骨诱导活性功能的复合生物材料是“仿生”人工骨研究热点之一。研究发现大量的生长因子参与了人体骨折后的自然愈合过程,如骨形态发生蛋白(bone morphogenetic protein,BMP)[3-4]、血管内皮生长因子[5]、表皮生长因子[6]和成纤维因子[7]等,其中以BMP家族最为重要,其代表因子为BMP-2和BMP-7,两者均已被美国国家食品和药物监督管理局(FDA)批准用于骨缺损的临床治疗。关于BMP-2和BMP-7在骨组织工程支架材料的负载和释放的研究越来越受到研究者的关注。
在诱导成骨效应时BMP-2和BMP-7均表现出明显的剂量依赖性,小剂量成骨诱导效应欠佳;高剂量的成骨诱导效应虽好,但是成骨速度过快会引起成骨质量低以及骨吸收[8]。同时,BMP-2和BMP-7的半衰期短,如果直接应用于体内,因酶的作用[9-10]或者稀释使其活性降低[11]。因此,许多学者试图通过将BMP包裹或添加到其他材料基质中以增强局部浓度,延长BMP的活性作用时间。目前将BMP-2和BMP-7同时负载并能实现缓慢释放的研究并不多见。本研究致力于研制一种能够同时释放BMP-2和BMP-7的复合支架,同时研究该支架上的人成骨细胞系hFOB1.19的增殖分化能力和成骨能力,为其在骨组织工程的临床应用奠定实验基础。
1 材料和方法 1.1 试剂与仪器聚己内酯(PCL,相对分子质量25 000)和聚乳酸-羟基乙酸-聚乙二醇(PGLA-PEG,相对分子质量25 000)购于山东岱岗生物科技有限公司;扫描电子显微镜(SEM)由日本电子株式会社(JEOL)生产;匀浆机购自德国IKA公司;qPCR仪、ELISA试剂盒购于美国Life公司;所有细胞培养试剂、耗材和生长因子均购于美国赛默飞公司;其他试剂购于上海国药试剂有限公司。
1.2 BMP-PCL复合支架的制备 1.2.1 PGLA-PEG微球的制备采用复乳溶剂挥发法(W1/O/W2)制备负载BMP-2和BMP-7的PGLA-PEG微球。内水相(W1):0.1%的BMP-2/PEG(质量比1∶10)水溶液;油相(O):PGLA-PEG/二氯甲烷(体积比1∶20)溶液;外水相(W2):0.5%的聚乙烯醇(PVA)/吐温20(质量体积比5∶1)水溶液。分别配制W1、O、W2。将W1与O按照体积比30∶1的比例混合,1 200 r/min (r=14 cm)匀浆1 min,形成初乳液(E)。再将E均匀地滴加到外水相W2中,磁力搅拌器200 r/min搅拌12 h。得到固化的负载BMP-2的PGLA-PEG微球。用相同的方法制备负载BMP-7的PGLA-PEG微球。
1.2.2 PCL支架的制备将1 g PCL回流溶解在25 mL 1,4-二氧六环中,形成的均匀溶液倒入用泡沫固定的50 mL玻璃杯中,置于专用的液氮罐中迅速冷冻2 min,然后于冷冻干燥机中冷冻干燥2 d以除去残余的有机溶剂所制备的支架为传统支架。在传统支架上加BMP微球制备成PCL支架。
1.2.3 BMP-PCL复合支架的制备及观察首先用锋利刀片将制备成功的PCL支架切成约50 mg的小块,置于4℃冷冻干燥6 h,然后加入2种BMP微球悬浮液体各40 μL (约10 mg)。待悬浮液完全吸附在支架内部后,冷藏风干即可得到同时负载BMP-2和BMP-7复合支架。上述操作均在4℃进行。制备完成后将BMP-PCL复合支架放置在倒置的1 L烧杯中,使用二氯甲烷熏蒸10 min,以加固微球在PCL支架上的黏附能力。取出后冻干6 h以除去残余的二氯甲烷。为了检测BMP-2、BMP-7微球是否黏附在PCL支架内部,将制备成功的BMP-PCL复合支架(以下简称复合支架)切割一小块,放入50 mL 离心管中,加入20 mL PBS,100 r/min摇晃10 min以确保微球黏附在PCL支架中。利用SEM观察样品的微观形貌,观察时电压为 2~10 kV。
1.3 复合支架BMP-2及BMP-7的释放曲线测试将复合支架放入含有50 mL PBS的离心管,置于37℃培养箱中,待检测时摇晃离心管,采用酶联免疫吸附实验(ELISA)检测PBS中的BMP-2和BMP-7含量。补取样时间点计算支架的BMP释放率(R):R(%) = BMP放/BMP总×100%,其中BMP放为复合支架释放的BMP含量,BMP总为复合支架样品负载的BMP含量。
1.4 复合支架上细胞的增殖情况检测将乙醇浸泡处理的复合支架置入48孔板,每孔种植2×105个细胞,37℃ 5% CO2的条件下培养。分别于细胞培养第5、第10天时,向每孔加入1 mL 10%的CCK-8 溶液 [避免产生气泡以影响光密度(D)值] ,将培养板在培养箱内孵育 2 h,用酶标仪测定在450 nm波长处的D值。将接种细胞的复合支架依次用5%戊二醛固定2 h、PBS清洗、梯度乙醇脱水、冷冻干燥除去残余乙醇后,采用SEM观察。
1.5 复合支架上细胞的成骨分化情况检测复合支架上细胞中碱性磷酸酶(ALP)的活性以初步评估成骨细胞分化情况。检测方法如下:弃去细胞培养板中原培养液,PBS洗2次后每孔加入500 μL的0.2% Triton X-100,确保所有支架完全浸泡在Triton X-100中,于4℃裂解;取50 μL裂解液于96孔板中,加入50p-NPP工作液于37℃反应30 min后,加入50 μL的1% NaOH溶液终止反应,使用分光光度计检测405 nm波长处的D值,然后测定同一样品中蛋白质的含量,绘制标准曲线计算ALP的活性。
为了更好地分析复合支架对细胞的成骨分化程度,我们采用qPCR (Quanti Tect SYBR Green PCR Kit)检测了3种与成骨分化相关的标记基因[Ⅰ型胶原蛋白 (type Ⅰ collagen,COL-Ⅰ)、骨钙素(osteocalcin,OC)和骨桥蛋白(osteopontin,OPN)]的mRNA水平。以GAPDH为内参基因,每个样品设3个复孔。引物序列见表 1。
|
|
表 1 qPCR的引物序列 Tab 1 Primer sequences of qPCR |
1.6 统计学处理
数据均采用SPSS 22.0软件进行分析,计量资料用x±s表示,两组间比较采用t检验。检验水准(α)为0.05。
2 结 果 2.1 复合支架的微观形态观察BMP-2微球(图 1A)和BMP-7微球(图 1B)均呈规则的球状结构,表面略微粗糙,平均直径分别为(42.6±4.1) μm 和(47.5±7.2) μm。PCL支架(图 1C)内部孔径约100~300 μm。如图 1D所示,微球均能够成功地黏附或镶嵌在PCL支架中。

|
图 1 扫描电子显微镜下制备成功的复合支架微观形貌 Fig 1 The micromorphology of composite scaffolds by scanning electron microscope A: BMP-2 microspheres; B: BMP-7 microspheres; C: PCL scaffolds; D: The composite scaffolds.BMP: Bone morphogenetic protein; PCL: Polycaprolactone. The bars are 50 μm in A and B,and 100 μm in C and D |
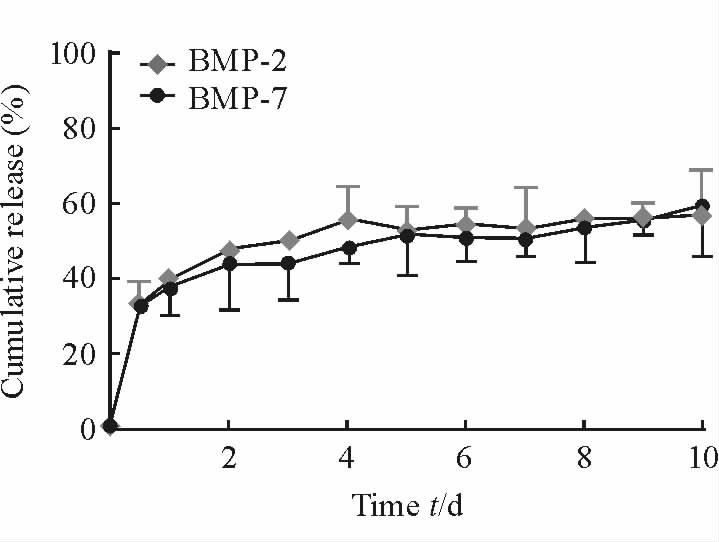
2.2 复合支架同时缓释BMP-2和BMP-7的检测
复合支架具备同时缓释BMP-2和BMP-7的能力,且缓释效果相似(图 2)。在最初的24 h内,2种BMP均有约30%的突释;24 h后,两者均趋于缓释,且释放率基本相同;至第10天时,2种BMP的释放量均在55%~60%。
|
图 2 复合支架同时缓释BMP-2和BMP-7 Fig 2 Simultaneous release of BMP-2 and BMP-7 by composite scaffolds BMP: Bone morphogenetic protein. n=3,x±s |
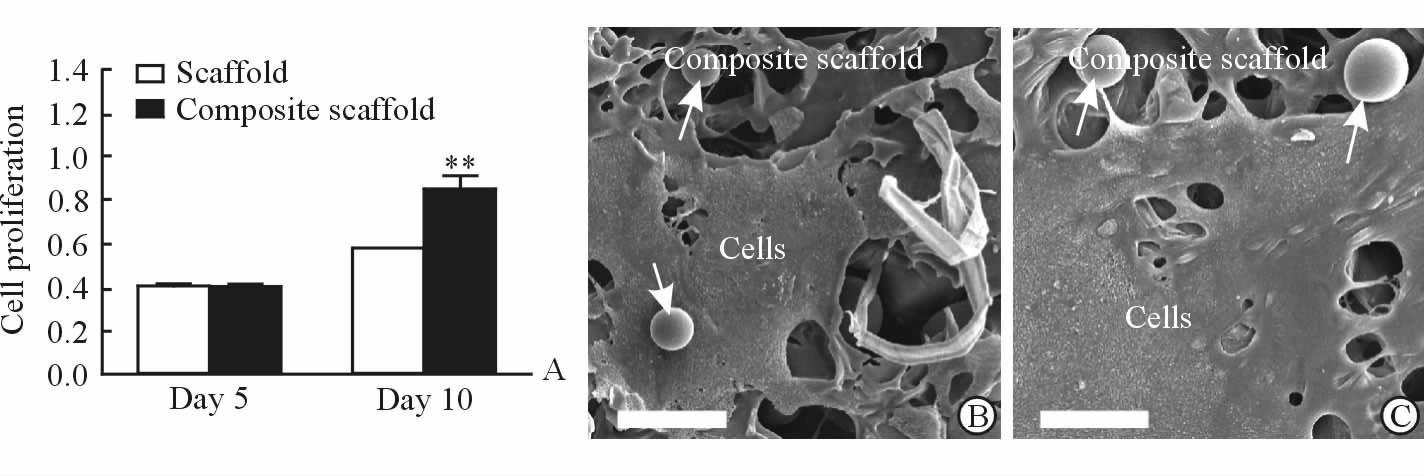
2.3 复合支架上hFOB1.19细胞活性的检测
采用CCK-8法检测复合支架上人成骨细胞系hFOB1.19细胞的增殖能力。如图 3A所示,在细胞培养第5天时复合支架和传统支架上的细胞活性相近;但在第10天时复合支架上细胞的活性高于传统支架(P<0.01)。通过SEM观察微观形态,细胞培养至第5天时hFOB1.19细胞黏附在复合支架的三维多孔中,且可见明显的细胞伪足结构(图 3B),表明其生长活跃;培养至第10天时,所有支架上hFOB1.19细胞均生长良好(图 3C)。
|
图 3 复合支架上hFOB1.19细胞的生长 Fig 3 hFOB1.19 cells grew well on the composite scaffolds A: The hFOB1.19 cells proliferation; B: The SEM graph at day 5; C: The SEM graph at day 10. SEM: Scanning electron microscope. White arrows indicate microspheres. **P<0.01 vs scaffold group of day 10. n=3,x±s. The bar in Fig 3B and 3C is 100 μm |
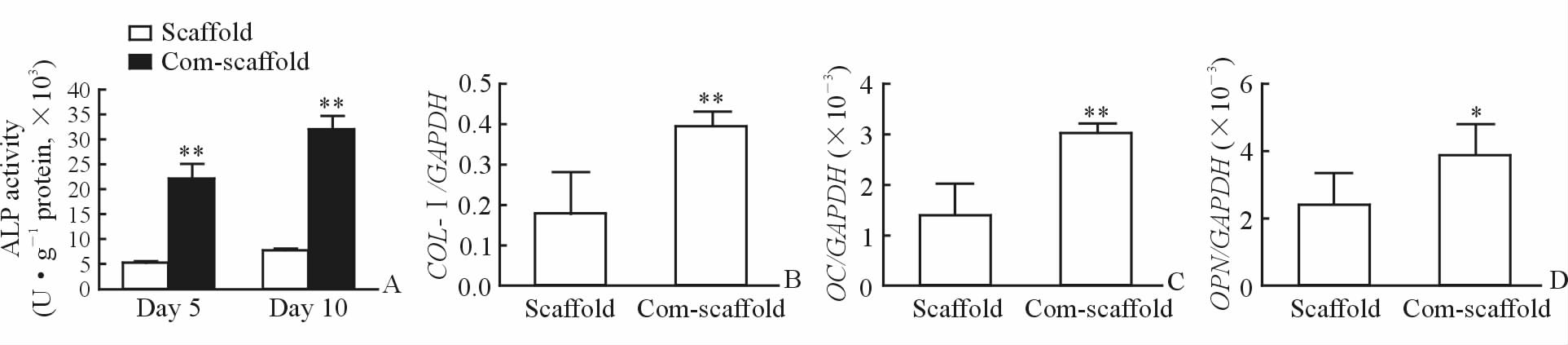
2.4 复合支架对成骨分化的影响
分别于细胞培养第5天与第10天时,检测复合支架和传统支架上细胞的ALP活性和COL-Ⅰ、OC、OPN的 mRNA水平。结果显示在细胞培养的第5天和第10天时,复合支架上细胞的ALP活性均高于传统支架(P<0.01,图 4A);第10天时COL-Ⅰ、OC、OPN的mRNA水平均高于传统支架(P<0.05,P<0.01,图 4B~4D),提示同时缓释BMP-2和BMP-7的复合支架更有利于人成骨细胞的诱导分化。
|
图 4 复合支架对成骨分化的影响 Fig 4 Effect of composite scaffold (com-scaffold) on osteogenesis differentiation A: The ALP activity; B: The relative mRNA level of COL-Ⅰ; C: The relative mRNA level of OC; D: The relative mRNA level of OPN. ALP: Alkaline phosphatase; COL-Ⅰ: Type-Ⅰcollagen; OC: Osteocalcin; OPN: Osteopontin; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. *P<0.05,**P<0.01 vs scaffold group. n=3,x±s |
3 讨 论
骨细胞(含干细胞分化后的骨细胞)、骨支架材料和骨相关活性因子是构成骨组织工程的3个基本要素。基于骨相关活性因子促进成骨分化,越来越多的研究者尝试通过将不同的生物材料和细胞结合拟实现人工骨组织的制备。负载及缓释骨相关活性因子的人工骨支架是目前研究的热点[1]。
已有大量研究将骨相关活性因子BMP单独包覆在不同的生物材料载体中,其中部分已应用于临床治疗[10-11]。但是极少有研究将2种BMP共同使用,主要原因是很难同时有效地控制2种BMP蛋白的释放和作用。针对控制支架中BMP-2及BMP-7 同步释放这一目标,我们改良已有的高分子合成工艺与结构控制技术,采用高分子材料分别进行BMP-2和BMP-7微球包裹,制备出大小和包封率接近的BMP-2微球和BMP-7微球。再通过二氯甲烷熏蒸法将制备的BMP微球固定在三维的多孔的PCL支架内部,成功制备出同时释放BMP-2和BMP-7、可用于骨修复的生物活性复合支架,其可成功诱导人成骨细胞系hFOB1.19细胞进行成骨分化。
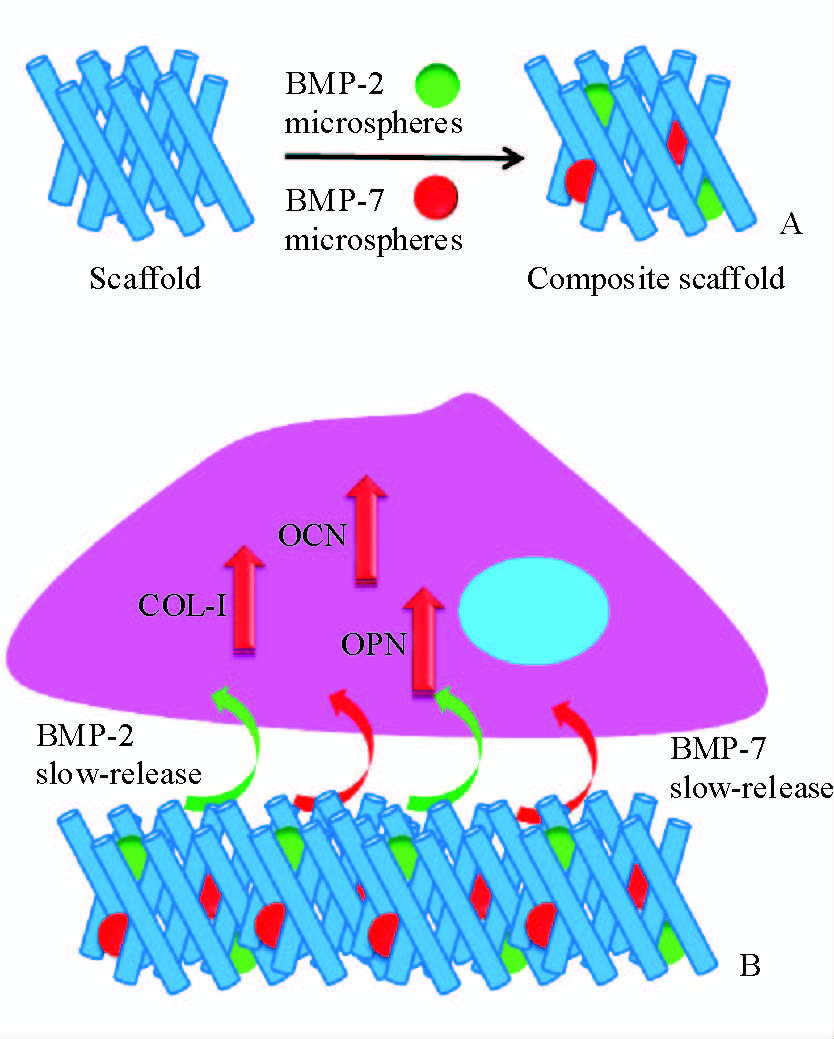
如图 5所示,本研究中所制备的复合支架同时黏附了BMP-2微球和BMP-7微球,2种微球镶嵌在海绵状支架中,能同时缓慢释放BMP-2和BMP-7。检测细胞活性发现相对于传统支架,可同时释放BMP-2和BMP-7的复合支架上hFOB1.19细胞具有更好的增殖能力,提示复合支架更有利于细胞的生长,这将为进一步动物实验提供必要依据。
|
图 5 可同时缓释BMP-2和BMP-7的复合支架的示意图 Fig 5 Diagram of a composite scaffold releasing BMP-2 and BMP-7 simultaneously A: The diagram of composite scaffold inlaid with BMP-2 and BMP-7; B: The diagram of simultaneous release of BMP-2 and BMP-7. BMP: Bone morphogenetic protein |
有研究者采用PLGA进行BMP-2和BMP-7的缓释载体的制备,如采用复乳溶剂挥发法制备了负载BMP-2蛋白的PLGA微球,将其应用于大鼠颅盖骨临界骨缺损模型时,发现PLGA微球能够通过释放BMP-2蛋白促进骨缺损愈合[3-4, 8]。但未见相关的临床研究,而且采用PLGA-PEG进行的BMP包裹也未见报道。同时,PCL广泛应用于制备各种微球和医学三维支架,我们采用复乳溶剂挥发法制备出同时负载BMP-2和BMP-7 PGLA-PEG微球的BMP-PCL复合支架,将复合支架和hFOB1.19细胞共培养,检测发现复合支架上细胞的ALP活性和成骨分化能力均优于传统支架。
除了ALP活性,成骨分化有关基因COL-Ⅰ、OC和OPN的mRNA水平也是成骨研究和判定的重要指标,特别在骨组织工程领域[12-13]。COL-Ⅰ是成骨细胞最明显的标记物,大部分成骨细胞中均存在大量COL-Ⅰ[14]。增殖期成骨细胞数量不断增加,以形成多层细胞,并合成、分泌COL-Ⅰ参与细胞矿化,导致骨结节的形成。OPN是一种细胞外基质蛋白,富含谷氨酸、丝氨酸及天冬氨酸,也是一种典型的细胞分泌型的糖基化含磷蛋白,调节着成骨细胞或组织的矿化[15-16]。OC由成骨细胞合成和分泌,含量较稳定,不受骨吸收因素的影响,是一种典型的成骨分化标记物。复合支架上细胞中3种基因mRNA水平均高于传统支架,进一步说明同步释放2种BMP的微环境更有利于hFOB1.19细胞的成骨分化,也是重要的临床依据。
综上所述,本研究采用2种不同的生物材料PGLA-PEG和PCL,成功制备一种同时释放BMP-2和BMP-7、可用于骨修复的复合支架。将可负载和缓释2种BMP的微球黏附于PCL支架中,成功实现了2种BMP的缓慢释放并能支持成骨细胞系hFOB1.19的生长和成骨分化,其细胞增殖能力和成骨分化能力均优于传统的三维PCL支架。
| [1] | BIGHAM-SADEGH A, ORYAN A. Selection of animal models for pre-clinical strategies in evaluating the fracture healing, bone graft substitutes and bone tissue regeneration and engineering[J]. Connect Tissue Res, 2015, 6: 175–194. |
| [2] | AI J, EBRAHIMI S, KHOSHZABAN A, JAFARZADEH KASHI T S, MEHRABANI D. Tissue engineering using human mineralized bone xenograft and bone marrow mesenchymal stem cells allograft in healing of tibial fracture of experimental rabbit model[J]. Iran Red Crescent Med J, 2012, 14: 96–103. |
| [3] | BESSA P C, CASAL M, REIS R L. Bone morphogenetic proteins in tissue engineering:the road from laboratory to clinic, part Ⅱ (BMP delivery)[J]. J Tissue Eng Regen Med, 2008, 2: 81–96. DOI: 10.1002/(ISSN)1932-7005 |
| [4] | KUBOKI Y, SASAKI M, SAITO A, TAKITA H, KATO H. Regeneration of periodontal ligament and cementum by BMP-applied tissue engineering[J]. Eur J Oral Sci, 1998, 106(Suppl 1): 197–203. |
| [5] | ZHANG Q, HUBENAK J, IYYANKI T, ALRED E, TURZA K C, DAVIS G, et al. Engineering vascularized soft tissue flaps in an animal model using human adipose-derived stem cells and VEGF+PLGA/PEG microspheres on a collagen-chitosan scaffold with a flow-through vascular pedicle[J]. Biomaterials, 2015, 73: 198–213. DOI: 10.1016/j.biomaterials.2015.09.024 |
| [6] | JABBARZADEH E, DENG M, LÜ Q, JIANG T, KHAN Y M, NAIR L S, et al. VEGF-incorporated biomimetic poly(lactide-co-glycolide) sintered microsphere scaffolds for bone tissue engineering[J]. J Biomed Mater Res B Appl Biomater, 2012, 100: 2187–2196. |
| [7] | JIANG J, FAN C Y, ZENG B F. Experimental construction of BMP-2 and VEGF gene modified tissue engineering bone in vitro[J]. Int J Mol Sci, 2011, 12: 1744–1755. DOI: 10.3390/ijms12031744 |
| [8] | PAULY S, KLATTE F, STROBEL C, SCHMIDMAIER G, GREINER S, SCHEIBEL M, et al. BMP-2 and BMP-7 affect human rotator cuff tendon cells in vitro[J]. J Shoulder Elbow Surg, 2012, 21: 464–473. DOI: 10.1016/j.jse.2011.01.015 |
| [9] | YILGOR P, HASIRCI N, HASIRCI V. Sequential BMP-2/BMP-7 delivery from polyester nanocapsules[J]. J Biomed Mater Res A, 2010, 93: 528–536. |
| [10] | MACIAS D, GANAN Y, SAMPATH T K, PIEDRA M E, ROS M A, HURLE J M. Role of BMP-2 and OP-1 (BMP-7) in programmed cell death and skeletogenesis during chick limb development[J]. Development, 1997, 124: 1109–1117. |
| [11] | LYONS K M, HOGAN B L, ROBERTSON E J. Colocalization of BMP 7 and BMP 2 RNAs suggests that these factors cooperatively mediate tissue interactions during murine development[J]. Mech Dev, 1995, 50: 71–83. DOI: 10.1016/0925-4773(94)00326-I |
| [12] | DOGǦAN A, DEMIRCI S, BAYIR Y, HALICI Z, KARAKUS E, AYDIN A, et al. Boron containing poly-(lactide-co-glycolide) (PLGA) scaffolds for bone tissue engineering[J]. Mater Sci Eng C Mater Biol App, 2014, 44: 246–253. DOI: 10.1016/j.msec.2014.08.035 |
| [13] | LI D, DAI K, TANG T. Effects of dextran on proliferation and osteogenic differentiation of human bone marrow-derived mesenchymal stromal cells[J]. Cytotherapy, 2008, 10: 587–596. DOI: 10.1080/14653240802238330 |
| [14] | QI H, YE Z, REN H, CHEN N, ZENG Q, WU X, et al. Bioactivity assessment of PLLA/PCL/HAP electrospun nanofibrous scaffolds for bone tissue engineering[J]. Life Sci, 2016, 148: 139–144. DOI: 10.1016/j.lfs.2016.02.040 |
| [15] | SCHOFER M D, VELTUM A, THEISEN C, CHEN F, AGARWAL S, FUCHS-WINKELMANN S, et al. Functionalisation of PLLA nanofiber scaffolds using a possible cooperative effect between collagen type Ⅰ and BMP-2:impact on growth and osteogenic differentiation of human mesenchymal stem cells[J]. J Mater Sci Mater Med, 2011, 22: 1753–1762. DOI: 10.1007/s10856-011-4341-4 |
| [16] | VALANEZHAD A, TSURU K, ISHIKAWA K. Fabrication of strongly attached hydroxyapatite coating on titanium by hydrothermal treatment of Ti-Zn-PO4 coated titanium in CaCl2 solution[J]. J Mater Sci Mater Med, 2015, 26: 212. DOI: 10.1007/s10856-015-5548-6 |
 2017, Vol. 38
2017, Vol. 38


