血管性痴呆(vascular dementia,VD)是老年期常见病之一[1~2]。关于VD的发病机制,目前还不十分清楚。慢性脑低灌注是其主要的发生机制之一,自噬激活及突触可塑性损伤在VD发病中的作用越来越受国内外学者的关注[3~4]。我们的前期研究[5~6]证明自噬及突触可塑性相关蛋白均在VD的发病中发挥重要作用。微管相关蛋白1轻链3 (microtubule associated protein 1 light chain 3,LC3)是自噬体从胞浆到空泡靶向囊泡所必需的蛋白,是常用的自噬标记物,检测LC3-Ⅱ或LC3-Ⅱ/LC3-Ⅰ比值是评价自噬活性简单易行的方法[7]。
突触素(synaptophysin,Syn)是位于突触囊泡膜上的钙结合蛋白,与突触的结构和功能密切相关,是突触发生的标志[8]。突触后膜致密物质(postsynaptic density material,PSD)含有多种蛋白质和酶,其成分的改变是突触生化变化的基础,其中突触后膜致密物质95 (PSD-95)是其主要蛋白,是神经元重塑的常用分子标记物[9]。Syn与PSD-95作为突触的特异性标记物及突触核心构建蛋白,在维持突触正常功能和可塑性方面具有重要作用。
为进一步探讨在VD发病中自噬与突触可塑性之间的关系,我们通过对VD模型大鼠分别进行侧脑室注射自噬抑制剂3-甲基腺嘌呤(3-MA)和自噬激动剂雷帕霉素(Rap)进行预处理,采用蛋白质印迹法分别检测大鼠海马CA1区LC3-Ⅱ、Syn和PSD-95蛋白表达,探讨自噬对VD大鼠海马CA1区Syn和PSD-95表达的影响,为探索VD的发病机制及治疗提供依据。
1 材料和方法 1.1 研究对象清洁级健康雄性Sprague-Dawley(SD)大鼠96只,2~3个月龄,体质量260~280 g,购于北京华阜康生物科技股份有限公司[动物生产许可证号SCXK(京)2013-0013]。实验前在华北理工大学屏障环境动物实验室适应喂养2周,自然光照,控制室温在(24±2)℃。本研究遵守《实验动物使用和管理指南》,研究方案通过华北理工大学附属医院伦理委员会批准后实施。
1.2 主要试剂与仪器兔抗大鼠LC3-Ⅱ多克隆抗体、兔抗大鼠Syn多克隆抗体、兔抗大鼠PSD-95多克隆抗体(北京博奥森生物技术有限公司),SP免疫组化试剂盒和DAB显色试剂盒(北京中杉金桥生物技术有限公司)。Morris水迷宫(淮北正华生物仪器设备有限公司),脑立体定位仪(Narishige公司),Olympus光学显微镜(Olympus公司),动物电凝仪器(张家港市航天医疗电器有限公司),组织切片机(德国Leitz公司)。
1.3 动物分组实验大鼠编号,用随机数生成器随机抽取不同数字,将大鼠随机分为假手术组(Sham组)、VD模型组(VD组)、自噬抑制剂3-MA预处理组(3-MA组)和自噬激动剂Rap预处理组(Rap组)。每组又分为模型制备成功后1、2、4、8周4个亚组,每个亚组6只大鼠。
1.4 VD模型制备用改良的Pulsinelli四血管阻断(4-VO)法制备VD大鼠模型[10]。10%水合氯醛(350 mg/kg)麻醉大鼠。VD模型组用电凝针烧灼双侧第1颈椎横突孔内的椎动脉,使双侧椎动脉永久性闭塞,消毒、缝合;分离双侧颈总动脉,并穿线备用。24 h后,用动脉夹夹闭双侧颈总动脉,每次夹闭5 min,间隔10 min,反复夹闭3次。可观察到大鼠四肢及尾巴僵硬,甚至出现尾巴向上强直卷曲,翻正反射消失。3-MA组和Rap组:将麻醉好的大鼠俯卧位固定于大鼠立体定位仪上,暴露颅骨十字缝处。于十字交叉前0.9 mm,侧1.5 mm定位标记。用无菌5 mL注射器针头钻孔,微量进样器进针深3.5 mm,分别缓慢注射3-MA(将14.92 mg 3-MA用灭菌生理盐水配制浓度为100 nmol/μL,6 μL/只)和Rap(将Rap配制成浓度为8 ng/μL,4 μL/只),注射完毕后将针头在侧脑室继续停留10 min后再缓缓拔出,然后消毒并缝合切口。侧脑室注射完毕后行VD模型手术。假手术组制备过程中只暴露双侧颈总动脉及第1颈椎横突孔,然后缝合,不进行椎动脉电凝及颈总动脉的夹闭。手术后给大鼠腹内注射庆大霉素注射液1万U/kg,每天1次,共3 d,以预防感染。
4周左右大鼠出现VD行为学改变。进行Morris水迷宫实验,观察大鼠穿越平台次数,筛选出造模成功的大鼠[11]。其中4只由于病情过重给予淘汰,另有4只死亡,均给予相应补充。
1.5 标本制备各组大鼠分别在模型制备成功后1、2、4、8周取材。用10%水合氯醛(350 mg/kg)对大鼠进行深度麻醉。断头后于冰上开颅取脑,用冷的PBS漂洗残余血,立即分离出新鲜海马,将海马CA1区组织置于15 mL离心管中,组织匀浆机12 000 r/min (r=3 cm)匀浆15 s,加入4℃预冷的组织裂解液,振荡混匀,4℃作用30 min,细胞悬液4℃低温离心12 000 r/min (r=3 cm)离心10 min,留取上清液4℃保存。经蛋白定量后分装,用4℃预冷的PBS调蛋白浓度到750 μg/mL,加入等体积的上样缓冲液,沸水中煮至少5 min,冷却至室温,放入4℃冰箱备用。
1.6 检测方法取等量蛋白样品(每个泳道50 μg)经10% SDS-PAGE分离后,以湿转法电转移至PVDF膜上。转移后的PVDF膜放入封闭液中封闭,然后分别加入稀释好的兔抗大鼠LC3-Ⅱ(1∶2 000)、Syn(1∶3 000)及PSD-95一抗 (1∶600) 4℃孵育过夜。PBS洗膜,加入相应稀释好的二抗(羊抗兔,1∶1 000),37℃反应1 h,洗膜,以ECL显色,胶片曝光显影。用Image J图像程序分析软件分析目的蛋白条带及内参的灰度值(D),以β-actin蛋白作为内参,目的蛋白与内参D比值即为目的蛋白的相对表达量。
1.7 统计学处理数据均采用SPSS 17.0软件进行分析,计量资料用x±s表示,多组间均值比较采用单因素方差分析(one-way ANOVA),两组间比较采用t检验,两变量间关系分析采用Pearson相关性分析。检验水准(α)为0.05。
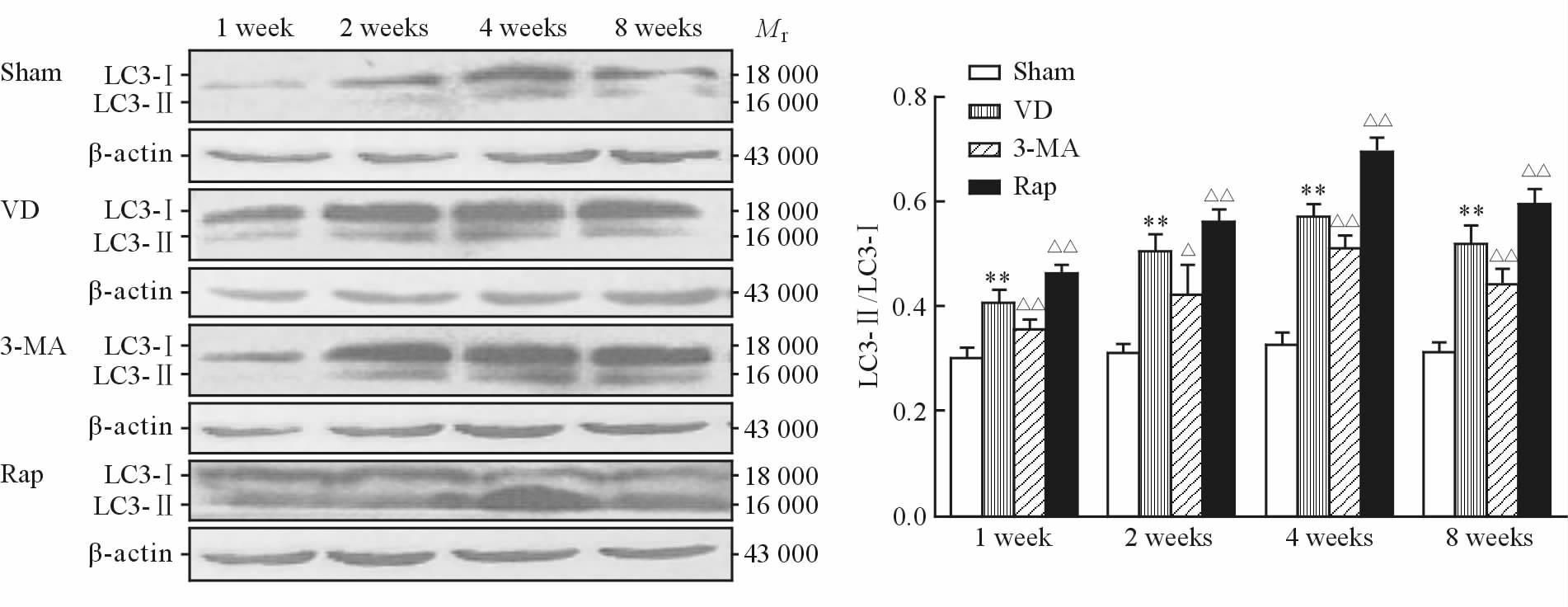
2 结 果 2.1 各组大鼠海马CA1区LC3-Ⅱ/LC3-Ⅰ检测结果Sham组各时间点大鼠海马LC3-Ⅱ的条带较窄,相反LC3-Ⅰ条带较宽,颜色较深,其比值较小;VD组LC3-Ⅱ/LC3-Ⅰ比值在1 周时开始增多,4周时达到最大,8周时减少。VD组各时间点LC3-Ⅱ/LC3-Ⅰ比值均大于Sham组,差异有统计学意义(P均<0.01);与VD组比较,3-MA组各时间点LC3-Ⅱ/LC3-Ⅰ比值减少(P<0.05或P<0.01),Rap组各时间点LC3-Ⅱ/LC3-Ⅰ比值增加(P均<0.01)。如图 1所示。
|
图 1 各组大鼠海马CA1区LC3-Ⅱ/LC3-Ⅰ蛋白质印迹结果 Fig 1 Western blotting results of LC3-Ⅱ/LC3-Ⅰ in CA1 hippocampal region of rats in each group VD: Vascular dementia; 3-MA: 3-Methyladenine; Rap: Rapamycin; LC3: Microtubule-associated protein 1 light chain 3. **P<0.01 vs sham group; △P<0.05,△△P<0.01 vs VD group. n=6,x±s |
2.2 各组大鼠海马CA1区Syn蛋白检测结果
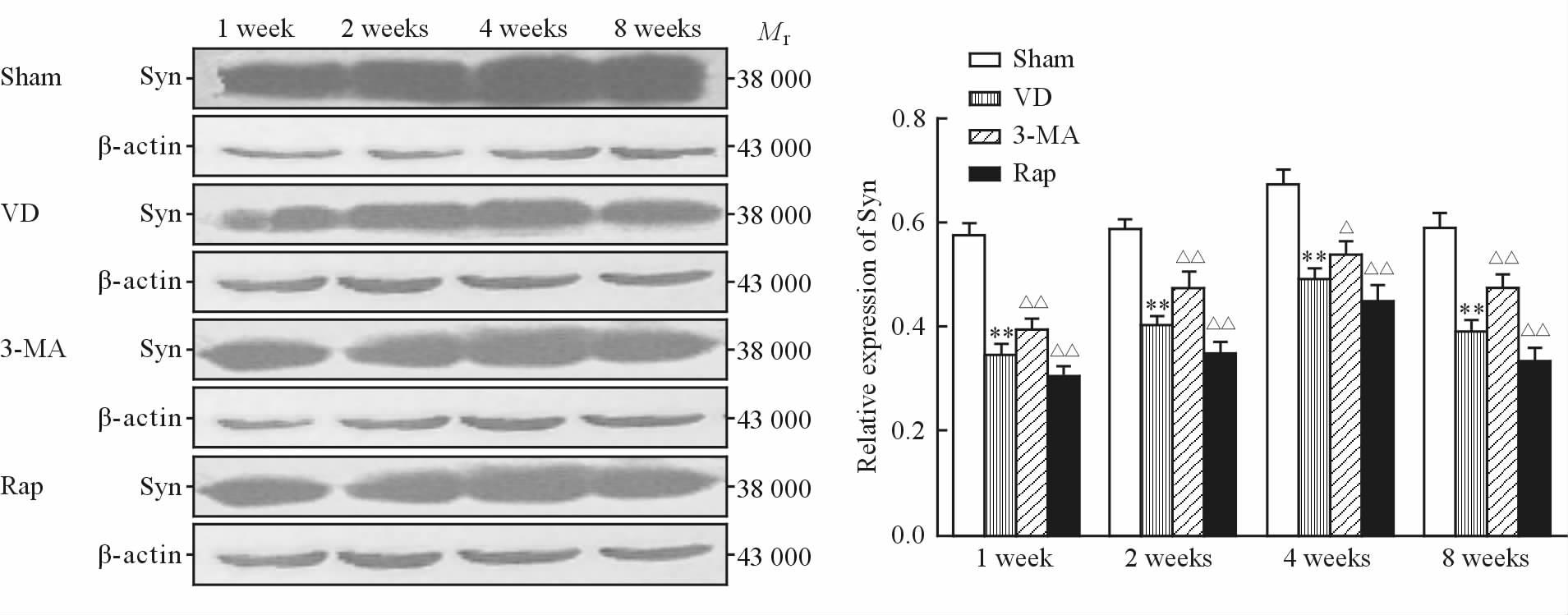
Sham组各时间点大鼠海马Syn的条带较宽,颜色较深。VD组Syn表达在1 周时较少,2周开始增多,4 周时达到最多,8周时减少。与Sham组比较,VD组各时间点Syn表达均减少,差异有统计学意义(P均<0.01);与VD组比较,3-MA组各时间点Syn表达均增多(P<0.05或P<0.01),Rap组各时间点Syn表达均减少(P均<0.01)。如图 2所示。
|
图 2 各组大鼠海马CA1区Syn蛋白质印迹结果 Fig 2 Western blotting results of Syn protein in CA1 hippocampal region of rats in each group VD: Vascular dementia; 3-MA: 3-Methyladenine; Rap: Rapamycin; Syn: Synaptophysin. **P<0.01 vs sham group; △P<0.05,△△P<0.01 vs VD group. n=6,x±s |
2.3 各组大鼠海马CA1区PSD-95蛋白检测结果
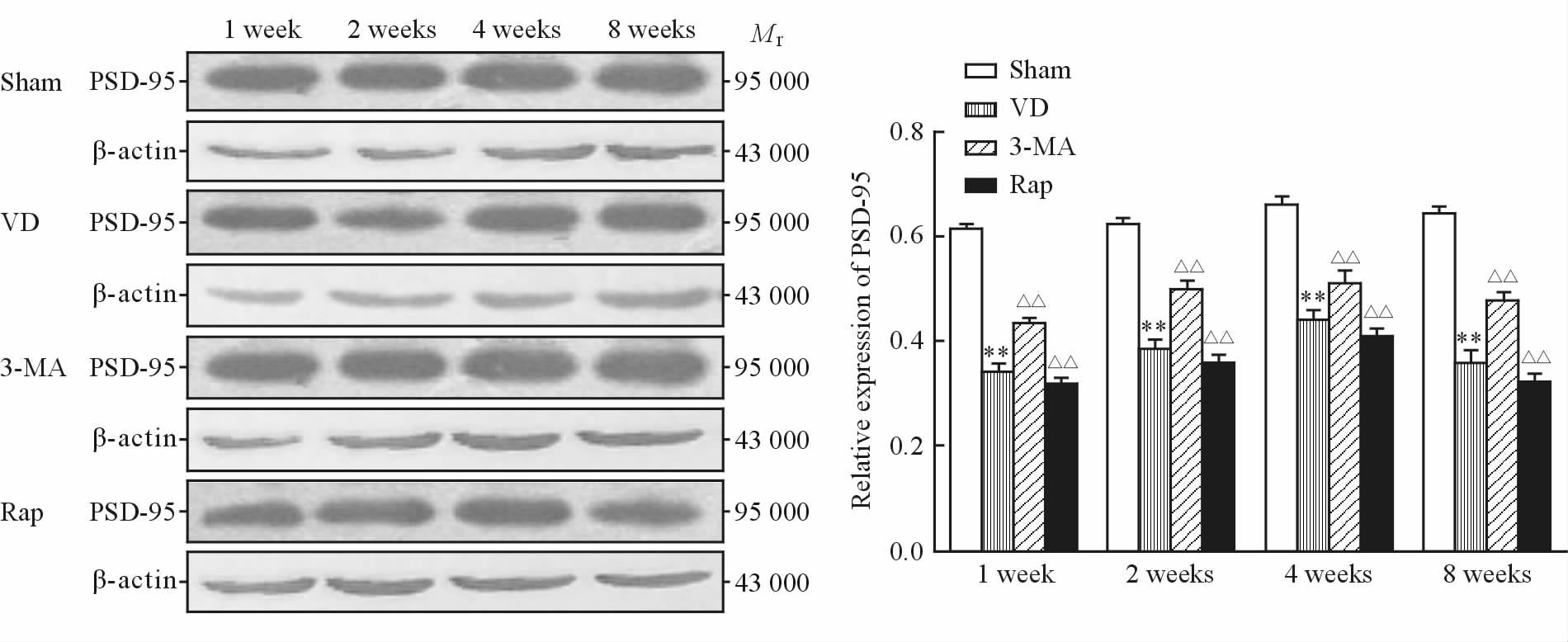
Sham组各时间点大鼠海马PSD-95蛋白的条带较宽,颜色较深。VD组PSD-95的表达在1 周时较少,2周时表达增多,4周时表达最多,8周时减少。与Sham组比较,VD组各时间点PSD-95表达均减少,差异有统计学意义(P均<0.01)。与VD组比较,3-MA组各时间点PSD-95表达均增多(P均<0.01),Rap组各时间点PSD-95的表达均减少(P均<0.01)。如图 3所示。
|
图 3 各组大鼠海马CA1区PSD-95蛋白质印迹结果 Fig 3 Western blotting results of PSD-95 protein in CA1 hippocampal region of rats in each group VD: Vascular dementia; 3-MA: 3-Methyladenine; Rap: Rapamycin; PSD-95: Postsynaptic density material 95. **P<0.01 vs sham group; △△P<0.01 vs VD group. n=6,x±s |
2.4 大鼠海马CA1区自噬与突触可塑性相关蛋白相关性分析
采用Pearson相关性分析法分析自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值与突触可塑性相关蛋白Syn、PSD-95的关系,结果为大鼠海马CA1区LC3-Ⅱ/LC3-Ⅰ比值与Syn蛋白(r=-0.481,P=0.000)和PSD-95蛋白(r=-0.656,P=0.000)表达均呈负相关。
3 讨 论自噬是主要来源于粗面内质网双层膜结构的自噬溶酶体包裹和溶解细胞内部分蛋白和细胞器的过程,是凋亡和坏死以外的另一种程序性细胞死亡方式[12]。适度的自噬是细胞正常生长发育和稳态维持的重要途径,不适当的自噬可导致机体的自噬性细胞死亡。LC3是在自噬泡内膜发现的第一种自噬体膜蛋白,是自噬相关蛋白8(Atg8)的同源物,参与多种信号转导调节相关的蛋白[3]。常通过检测LC3-Ⅱ或LC3-Ⅱ/LC3-Ⅰ比值来确定自噬是被诱导还是被抑制[7]。本实验结果显示,各时间点VD大鼠海马CA1区LC3-Ⅱ/ LC3-Ⅰ比值均高于Sham组,3-MA组各时间点LC3-Ⅱ/LC3-Ⅰ比值均低于VD组,Rap组各时间点LC3-Ⅱ/LC3-Ⅰ比值均高于VD组。说明VD大鼠缺血缺氧性损伤后,海马区自噬被激活,自噬参与了VD的发病过程。
突触是神经细胞信息传递的基本结构单位,神经系统许多重要功能的完成以突触为基础,其形态、数量的改变即为突触可塑性。突触可塑性是神经系统生长发育、损伤修复及学习记忆等活动的生物学基础[13~14]。学习和记忆功能与突触的结构及可塑性密切相关。Syn与神经生长、修复、再生等功能密切相关。有研究表明[15~16],Syn可通过磷酸化作用调节神经递质释放,又可通过对突触结构影响,在突触可塑性中发挥一定作用。因此,Syn是一种与突触结构和功能可塑性调节密切相关的突触前膜囊泡蛋白[17],可准确反映突触的分布、数量和密度,是反映突触可塑性变化最直接的指标[18]。PSD-95在突触后密度区含量丰富,作为突触后膜的代表物质之一,是膜相关的鸟苷酸激酶家族的一员[19],与膜受体、离子通道、细胞粘附因子和信号分子等相互作用,参与突触可塑性的调节[9, 20],在突触的可塑性、学习记忆及大脑的病理生理方面发挥重要作用。本实验结果显示,VD组各时间点Syn蛋白、PSD-95蛋白表达均低于Sham组,3-MA组各时间点Syn蛋白、PSD-95蛋白表达均高于VD组,Rap组各时间点Syn蛋白、PSD-95蛋白表达均低于VD组。这与文献报道的结果基本一致[4, 21]。结果表明,VD大鼠海马区的突触结构及功能均发生了明显的改变,突触变化在VD的认知障碍中扮演着重要角色。
自噬及突触可塑性相关蛋白在VD的发病中均有重要作用,但自噬与突触可塑性之间在VD发病中的关系目前尚未明确。Chen等[22]的研究表明,痴呆小鼠出现自噬增加、突触损失及认知功能障碍,通过应用细辛脑可以减少自噬的发生和突触的损失,改善认知功能,说明自噬对于突触发育至关重要。3-MA是一种常用的细胞自噬抑制剂[23],能通过抑制自噬体形成过程中的磷脂酰肌醇3激酶(PI3K)而抑制自噬体的形成。Rap是一种新型免疫抑制剂,它能与哺乳动物Rap靶蛋白特异性结合,抑制mTOR的蛋白激酶活性,诱导自噬发生[24]。本实验研究结果显示:增加VD大鼠海马CA1区自噬的发生,突触可塑性相关蛋白Syn、PSD-95表达减少,抑制VD大鼠海马CA1区自噬的发生,突触可塑性相关蛋白Syn、PSD-95表达增加,VD大鼠海马CA1区自噬与Syn、PSD-95蛋白表达呈负相关。结果表明自噬对VD大鼠海马CA1区突触可塑性相关蛋白Syn、PSD-9表达具有抑制作用,抑制自噬有利于VD大鼠海马CA1区神经突触重塑,这为VD的治疗及预防提供理论依据。
| [1] | PENNISI G, FERRI R, CANTONE M, LANZA G, PENNISI M, VINCIGUERRA L, et al. A review of transcranial magnetic stimulation in vascular dementia[J]. Dement Geriatr Cogn Disord, 2011, 31: 71–80. DOI: 10.1159/000322798 |
| [2] | GANGULI M, LEE C W, SNITZ B E, HUGHES T F, MCDADE E, CHANG C C. Rates and risk factors for progression to incident dementia vary by age in a population cohort[J]. Neurology, 2015, 84: 72–80. DOI: 10.1212/WNL.0000000000001113 |
| [3] | LIU B, TANG J, ZHANG J, LI S, YUAN M, WANG R. Autophagy activation aggravates neuronal injury in the hippocampus of vascular dementia rats[J]. Neural Regen Res, 2014, 9: 1288–1296. DOI: 10.4103/1673-5374.137576 |
| [4] | 肖雁, 苏艳丽, 井沆, 吴昌学, 李毅, 官志忠. 血管性痴呆大鼠海马突触素、发动蛋白Ⅰ的mRNA及蛋白表达变化[J]. 临床神经病学杂志, 2014, 27: 37–40. |
| [5] |
刘斌, 唐静, 袁敏, 李世英. 血管性痴呆大鼠海马CA1区自噬及微管相关蛋白1轻链3的表达[J]. 第二军医大学学报, 2013, 34: 940–945.
LIU B, TANG J, YUAN M, LI S Y. Expression of autophagy and microtubule-associated protein 1 light chain 3 in hippocampus CA1 area of vascular dementia rats[J]. Acad J Sec Mil Med Univ, 2013, 34: 940–945. |
| [6] | 刘金霞, 马原源, 刘斌, 邓春颖, 李世英. 微管相关蛋白1轻链3Ⅱ与微管相关蛋白2在血管性痴呆大鼠海马CA1区的表达[J]. 中国康复理论与实践, 2015, 21: 497–500. |
| [7] | CHERRA S J 3rd, KULICH S M, UECHI G, BALASUBRAMANI M, MOUNTZOURIS J, DAY B W, et al. Regulation of the autophagy protein LC3 by phosphorylation[J]. J Cell Biol, 2010, 190: 533–539. DOI: 10.1083/jcb.201002108 |
| [8] | MURPHY T H, CORBETT D. Plasticity during stroke recovery:from synapse to behaviour[J]. Nat Rev Neurosci, 2009, 10: 861–872. DOI: 10.1038/nrn2735 |
| [9] | 欧阳馥冰, 陈艺聪, 曾进胜. PSD-95抑制剂在缺血性脑损伤后的神经保护作用[J]. 中国神经精神疾病杂志, 2015, 41: 380–382. |
| [10] | PULSINELLI W A, BRIERLEY J B, PLUM F. Temporal profile of neuronal damage in a model of transient forebrain ischemia[J]. Ann Neurol, 1982, 11: 491–498. DOI: 10.1002/(ISSN)1531-8249 |
| [11] | 陈罗西, 郭玲玲, 李亮. Morris圆形水迷宫的应用及其相关检测指标分析[J]. 辽宁中医药大学学报, 2008, 10: 55–57. |
| [12] | HUETT A, GOEL G, XAVIER R J. A systems biology viewpoint on autophagy in health and disease[J]. Curr Opin Gastroenterol, 2010, 26: 302–309. DOI: 10.1097/MOG.0b013e32833ae2ed |
| [13] | HASAN A, NITSCHE M A, REIN B, SCHNEIDER-AXMANN T, GUSE B, GRUBER O, et al. Dysfunctional long-term potentiation-like plasticity in schizophrenia revealed by transcranial direct current stimulation[J]. Behav Brain Res, 2011, 224: 15–22. DOI: 10.1016/j.bbr.2011.05.017 |
| [14] |
马隽, 张展翅, 崔慧, 王铭维, 王彦永, 马芹颖. 磁刺激对小鼠原代海马神经元突触素、生长相关蛋白及脑源性神经营养因子表达的影响[J]. 第二军医大学学报, 2011, 32: 1096–1102.
MA J, ZHANG Z C, CUI H, WANG M W, WANG Y Y, MA Q Y. Effects of magnetic simulation on expression of SYN, GAP43, and BDNF in primary mouse hippocampal neurons[J]. Acad J Sec Mil Med Univ, 2011, 32: 1096–1102. |
| [15] | 乔思默, 王丽峰, 胡向军, 彭瑞云, 高亚兵, 赵黎, 等. 磷酸化突触素在神经元囊泡循环与递质释放中作用[J]. 中国公共卫生, 2015, 31: 1279–1282. |
| [16] | BOGEN I L, JENSEN V, HVALBY O, WALAAS S I. Synapsin-dependent development of glutamatergic synaptic vesicles and presynaptic plasticity in postnatal mouse brain[J]. Neuroscience, 2009, 158: 231–241. DOI: 10.1016/j.neuroscience.2008.05.055 |
| [17] | KWON S E, CHAPMAN E R. Synaptophysin regulates the kinetics of synaptic vesicle endocytosis in central neurons[J]. Neuron, 2011, 70: 847–854. DOI: 10.1016/j.neuron.2011.04.001 |
| [18] | GARRINGER H J, MURRELL J, SANMMETA N, GNEZDA A, GHETTI B, VIDAL R. Increased tau phosphorylation and tau truncation, and decreased sypaptophysin levels in mutant BRI(2)/tau transgenic mice[J/OL]. PLoS One, 2013, 8:e56426. doi:10.1371/journal.pone.0056426. |
| [19] | LI C, ZHOU Y, LIU Z, TUO J, HU N, GUAN H. Spatiotemporal expression of postsynanptic density 95 in rat retina after optic nerve injury[J]. J Mol Neurosci, 2012, 46: 595–605. DOI: 10.1007/s12031-011-9647-7 |
| [20] | 刘颖异, 胡玲芹, 张映, 李方钦, 王静, 潘玉君. PSD-95与脑缺血的关系及其调控机制研究[J]. 现代生物医学进展, 2014: 1796–1800. |
| [21] | NYFFELER M, ZHANG W N, FELDON J, KNUESEL I. Differential expression of PSD proteins in age-related spatial learning impairments[J]. Neurobiol Aging, 2007, 28: 143–155. DOI: 10.1016/j.neurobiolaging.2005.11.003 |
| [22] | CHEN Y, WEI G, NIE H, LIN Y, TIAN H, LIU Y, et al. β-Asarone prevents autophagy and synaptic loss by reducing ROCK expression in asenescence-accelerated prone 8 mice[J]. Brain Res, 2014, 1552: 41–54. DOI: 10.1016/j.brainres.2014.01.005 |
| [23] | HARRISON D E, STRONG R, SHARP Z D, NELSON J F, ASTLE C M, FLURKEY K, et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice[J]. Nature, 2009, 460: 392–395. |
| [24] | 吴伯艳, 刘新光, 陈维春. 雷帕霉素诱导细胞自噬在衰老相关疾病中的作用[J]. 中国药理学通报, 2015, 31: 11–14. |
 2017, Vol. 38
2017, Vol. 38


