糖皮质激素是临床上常用的免疫抑制剂,广泛用于治疗自身免疫性疾病及移植后免疫反应。但长期或者短期内高剂量使用糖皮质激素会导致骨丢失、骨密度下降等发生[1~3]。目前对此类激素型骨质疏松尚无有效的防治方法。在前期研究中,我们构建了糖皮质激素诱导的骨质疏松动物模型,并发现来自模型组小鼠的骨髓间充质干细胞(bone marrow stromal cells,BMSCs)成骨分化能力下降,且Wnt/β-catenin信号通路受到抑制;用Wnt/β-catenin信号通路激活剂氯化锂(lithium chloride,LiCl)处理细胞后能促进骨质疏松小鼠来源的BMSCs向成骨细胞分化[4]。由此我们推测,用LiCl激活Wnt/β-catenin信号通路可作为有效防治激素型骨质疏松的方法之一,然而LiCl对此类疾病治疗效果的研究仍未见报道。本研究继续以地塞米松诱导的小鼠骨质疏松模型为研究对象,通过口服LiCl激活小鼠体内的Wnt/β-catenin通路,探讨LiCl激活的Wnt/β-catenin信号通路对激素引发的骨丢失的防护作用。
1 材料和方法 1.1 实验材料C57BL6/J小鼠,雄性,5周龄,20~25 g,购自上海斯莱克实验动物有限公司[许可证号SYXK(沪)2013-0062]。LiCl、地塞米松、钙黄绿素及抗酒石酸酸性磷酸酶(TRAP)染色试剂盒均购自Sigma公司,活性β-catenin抗体购自Cell Signaling Technology公司。
1.2 动物模型的建立、分组及处理按文献[4]方法制备糖皮质激素诱导的骨质疏松动物模型。小鼠适应性饲养1周后随机分为3组:对照组、骨质疏松模型组、LiCl组,每组8只。骨质疏松模型组及LiCl组小鼠按50 mg/kg体质量皮下注射地塞米松注射液,每天1次,持续5周。对照组小鼠注射同等剂量的生理盐水。LiCl组小鼠在注射地塞米松的同时通过饮用水每天给予200 mg/kg体质量的LiCl,持续5周。
1.3 骨组织学检测小鼠处死后剥离后肢骨,剔除附着软组织,经4%多聚甲醛溶液固定、EDTA脱钙、冲洗、梯度乙醇脱水后常规石蜡包埋,做5 μm厚的连续切片。用免疫组化染色检测活性β-catenin的表达;用H-E染色观察骨组织形态;用TRAP染色试剂盒进行TRAP染色,鉴定小鼠骨吸收活性。
1.4 MicroCT检测小鼠处死后剥离后肢骨,剔除附着软组织,经4%多聚甲醛溶液固定后,用SCANCO Medical microCT (SCANCO Medical AG,Switzerland)扫描,预装64位图像处理软件行骨组织形态学相关指标检测。
1.5 钙黄绿素荧光标记钙黄绿素溶液用磷酸盐缓冲液(PBS)配制,小鼠在处死前10 d及处死前3 d分别按10 μg/g体质量给予腹腔注射钙黄绿素溶液。处死后剥离后肢骨,剔除软组织,于70%乙醇中避光固定24 h后进行硬组织包埋切片。组织切片于荧光显微镜下观察拍照。全部样本均用Image-Pro plus 6.0软件测量两条标记荧光线间的距离,进行矿化沉积率(mineral apposition rate,MAR)统计分析。MAR(μm/d)=双标记线间距离/标记间隔时间。
1.6 统计学处理应用Image-Pro plus 6.0软件进行统计学分析,数据以x±s表示,采用Student’s t检验比较组间差异。检验水准(α)为0.05。
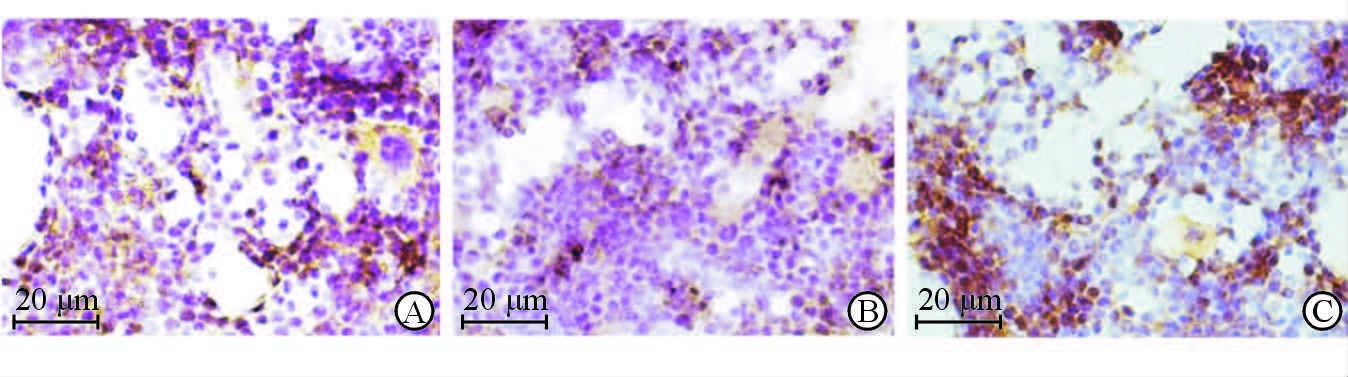
2 结 果 2.1 Wnt/β-catenin信号通路检测取小鼠股骨做骨组织切片,并采用免疫组化法检测骨组织中被激活的β-catenin的蛋白水平。结果显示,对照组小鼠骨髓腔中有大量活性β-catenin蛋白表达,骨质疏松模型组小鼠骨髓腔中活性β-catenin蛋白水平低于对照组;LiCl组小鼠骨髓腔中活性β-catenin蛋白水平较骨质疏松模型组增加,与对照组接近(图 1)。
|
图 1 免疫组化检测各组小鼠骨组织切片中活性β-catenin蛋白水平(SP法) Fig 1 Immunohistochemical staining of active β-catenin protein in bone sections of mice in differentgroups (SP method) A: Control group; B: OP (osteoporosis) group; C: LiCl (lithium chloride) group |
2.2 小鼠股骨形态学观察
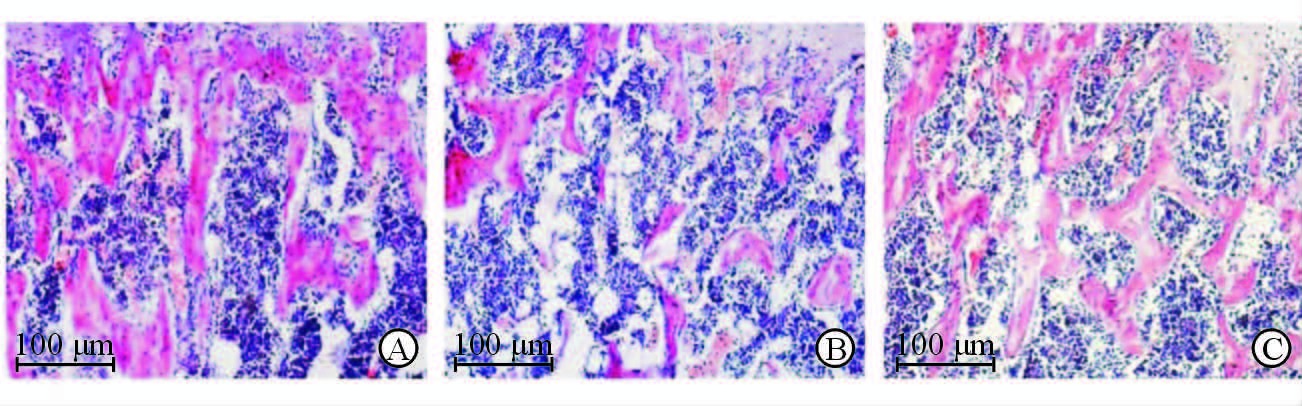
股骨远端的骨组织切片经H-E染色后,普通光学显微镜下可见:骨质疏松模型组小鼠与对照组相比骨小梁数量明显减少,小梁厚度降低,而骨小梁间隙增加,且在骨髓中出现大量脂肪组织;LiCl组小鼠的骨小梁数目及小梁厚度均较骨质疏松模型组增加,但与对照组相比仍有一定差异;LiCl处理后小鼠骨髓中脂肪组织减少,与对照组无明显差异(图 2)。
|
图 2 H-E染色观察各组小鼠骨组织形态 Fig 2 H-E staining showing bone morphology of mice in different groups A: Control group; B: OP (osteoporosis) group; C: LiCl(lithium chloride) group |
2.3 小鼠股骨MicroCT检测
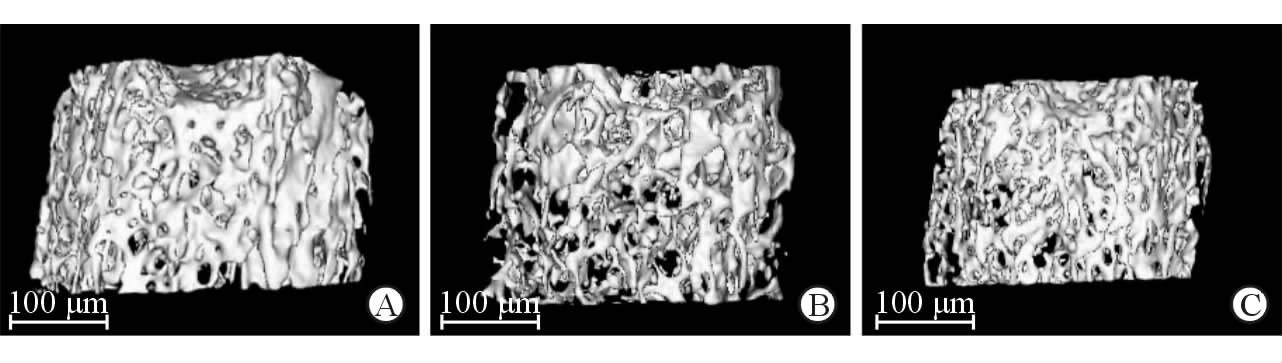
取小鼠后肢股骨进行microCT扫描。股骨近端三维重建图像显示骨质疏松模型组小鼠骨小梁数目明显少于对照组,小梁间隙增加。而LiCl组小鼠的骨小梁数目及间隙与骨质疏松模型组相比均有一定改善,但与对照组相比仍有一定差异(图 3)。骨组织形态计量学参数如表 1所示,骨质疏松模型组小鼠的骨量(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、骨小梁间隙(Tb.Sp)以及骨密度(BMD)与对照组相比差异均有统计学意义(P<0.05)。LiCl组小鼠骨量、骨小梁数量以及骨密度与骨质疏松模型组相比有提升(P<0.05),且骨小梁间隙减小(P<0.05);但骨小梁厚度、骨小梁数量及骨小梁间隙与对照组相比差异仍有统计学意义(P<0.05)。
|
图 3 microCT 三维重建图像显示各组小鼠股骨骨小梁形态 Fig 3 microCT images of trabecular morphology of mice in different groups A: Control group; B: OP (osteoporosis) group; C: LiCl(lithium chloride) group |
|
|
表 1 各组小鼠骨计量学参数比较 Tab 1 Comparison of bone histomorphometrical parameters of mice in different groups |
2.4 小鼠骨形成能力测定
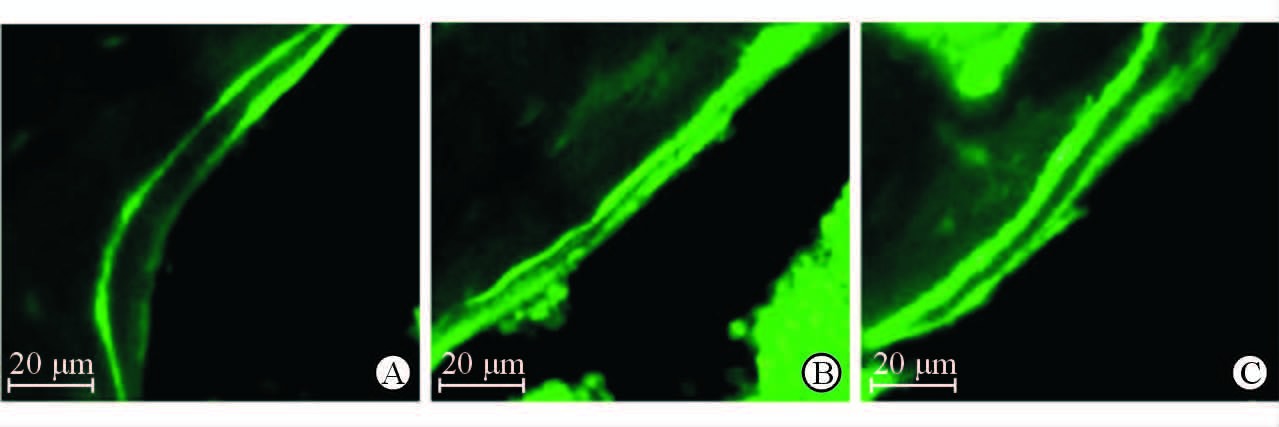
如图 4所示,亮绿色荧光双线之间间隔为7 d内新形成的经钙黄绿素荧光标记的骨组织。图中可见骨质疏松模型组小鼠的新骨形成量明显低于对照组,而LiCl处理后双线之间距离有所增加,但仍然低于对照组。骨质疏松模型组小鼠的MAR为(0.470±0.012) μm/d,小于对照组[(1.360±0.051) μm/d,P<0.05];LiCl组小鼠MAR为(0.840±0.025) μm/d,较骨质疏松模型组升高(P<0.05),但与对照组相比差异仍有统计学意义(P<0.05)。
|
图 4 钙黄绿素荧光标记显示各组小鼠新骨形成情况 Fig 4 Calcein staining showing new bone formation rate of mice in different groups A: Control group; B: OP (osteoporosis) group; C: LiCl (lithium chloride) group |
2.5 小鼠骨吸收活性测定
取小鼠股骨远端制作骨组织切片,以TRAP染色鉴定各组小鼠骨吸收活性。结果(图 5)显示,骨质疏松模型组、LiCl组与对照组小鼠骨组织的TRAP阳性区域均无明显差异,提示骨吸收活性无明显改变。
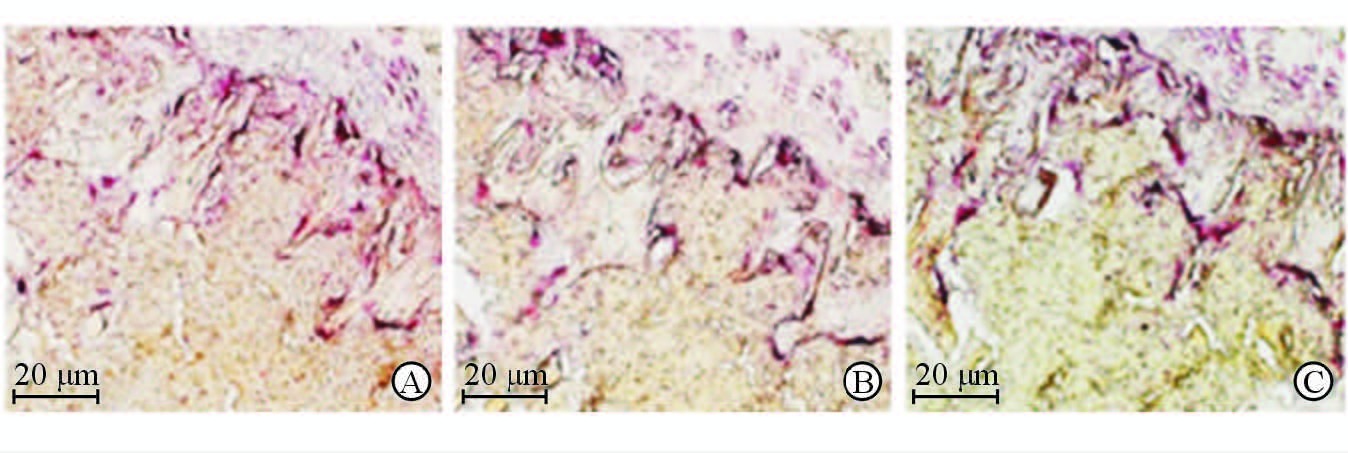
|
图 5 TRAP染色显示各组小鼠骨吸收活性 Fig 5 TRAP staining showing bone resorption activity of mice in different groups A: Control group; B: OP (osteoporosis) group; C: LiCl (lithium chloride) group |
3 讨 论
激素型骨质疏松为继发性骨质疏松中最常见的一类[1~3]。防治此类疾病首先应充分了解骨质疏松症的发病机制。研究表明,成体骨组织处于骨重建的平衡之中,即MSCs介导的新骨形成和破骨细胞介导的骨吸收[5]。导致骨质疏松症的本质原因是骨重建平衡被破坏,体现为骨吸收过度或者新骨形成不足[6~7]。前期我们对激素型骨质疏松小鼠模型进行研究,发现其骨髓MSCs向成骨细胞分化的能力明显下降,提示过量使用糖皮质激素导致骨丢失的原因之一是新骨形成能力下降[4]。因此提高MSCs向成骨细胞分化的能力,促进新骨形成将可能成为挽救激素性骨质疏松的有效策略之一。
MSCs向成骨细胞分化受到多种胞外信号及胞内因子调控。其中Wnt/β-catenin信号通路是调控MSCs成骨分化的重要通路之一[8~12]。该通路激活后会抑制β-catenin的降解,导致胞质中的β-catenin增加,并能入核与其他转录因子的成员如LEF/TCF转录因子形成异二聚体,调控成骨分化相关基因的表达,如Runx2、骨钙素等[8]。研究发现Wnt通路中的几乎每一种组分都参与MSCs的分化调控[9]。Wnt经典通路中蛋白因子的缺失都会导致骨缺损,如Lrp5或Wnt10b[10];而该通路的抑制因子DKK1的缺失则导致骨量增加,骨形成作用增强[11]。前期研究发现骨质疏松MSCs中该通路无法被激活,推测该通路受到抑制是导致骨质疏松MSCs成骨能力低下的原因之一[4]。本研究进一步发现,骨质疏松模型组小鼠体内活性β-catenin蛋白水平明显低于对照组,进一步证实了糖皮质激素能抑制MSCs中Wnt/β-catenin信号通路。LiCl是Wnt/β-catenin信号通路的激活剂,通过抑制该通路的负调控因子GSK3β来发挥作用[13]。体外研究已经证实LiCl处理MSCs后能增强其成骨能力,抑制脂肪细胞的分化[4, 14];体内实验证实服用LiCl可以增强绝经后骨质疏松环境中的骨重建[15]。体外实验证实LiCl对Wnt通路的激活不受糖皮质激素的影响,因此认为该药物对治疗激素型骨质疏松有巨大的潜力[13],但对LiCl体内治疗激素型骨质疏松的效果仍无确切研究。本研究中小鼠以LiCl处理后,骨质疏松MSCs的成骨分化能力也得到了恢复,提示激活该通路可能成为有效防止激素型骨质疏松的策略之一[4]。口服LiCl能有效提高骨质疏松模型小鼠体内活性β-catenin蛋白水平,说明LiCl能恢复骨质疏松小鼠体内的Wnt/β-catenin信号通路传递。这些结果为今后探讨Wnt/β-catenin信号对骨质疏松症的防治效果提供了可靠的实验依据。
在明确口服LiCl能有效激活体内的Wnt/β-catenin信号通路后,我们用骨组织学检测判定LiCl对骨质疏松症的治疗效果。结果发现小鼠在接受糖皮质激素的同时口服LiCl能有效缓解骨丢失症状,表现为骨小梁数目增加、骨小梁间隙减小。并且H-E染色还发现骨质疏松模型组小鼠骨髓出现大量脂肪化现象,与临床观察结果[1~3]一致,但LiCl处理后骨髓脂肪组织明显减少。这些结果说明LiCl激活的Wnt/β-catenin信号通路能够有效改善骨质疏松症的临床表现,缓解骨丢失,抑制骨髓脂肪化。骨计量学参数测定结果显示LiCl治疗组小鼠的骨量、骨密度等虽然得到明显改善,但与正常对照相比仍有显著差距,说明口服LiCl尚不能完全将骨丢失恢复到正常水平。由于体内LiCl治疗未能达到预期效果,我们从骨重建平衡角度出发探索其中原因。结果发现,骨质疏松模型组小鼠新骨形成能力与对照组相比大大降低,而接受LiCl治疗的小鼠新骨形成能力有一定的提高,但仍然低于正常对照组。而且各组小鼠的骨吸收活性没有明显改变。这些结果说明糖皮质激素引发骨质疏松的原因主要是抑制骨形成,而非促进骨吸收。LiCl激活的Wnt/β-catenin信号通路能有效缓解激素抑制的MSCs成骨分化,促进新骨形成,对骨吸收没有明显影响。但LiCl未能完全恢复体内MSCs新骨形成的能力,推测体内仍有干预新骨形成的未知因素。
本研究证实促进新骨形成是有效防治使用糖皮质激素引发的骨质疏松症的策略之一。LiCl激活的Wnt/β-catenin信号通路能有效促进新骨形成,缓解激素导致的骨丢失,但不能完全抑制骨质疏松症的发生。体内抑制新骨形成的机制及防治策略有待于进一步研究。
| [1] | LI X, JIN L, CUI Q, WANG G J, BALIAN G. Steroid effects on osteogenesis through mesenchymal cell gene expression[J]. Osteoporos Int, 2005, 16: 101–108. DOI: 10.1007/s00198-004-1649-7 |
| [2] | CUI Q, WANG G J, BALIAN G. Pluripotential marrow cells produce adipocytes when transplanted into steroid-treated mice[J]. Connect Tissue Res, 2000, 41: 45–56. DOI: 10.3109/03008200009005641 |
| [3] | VAN STAA T P, LEUFKENS H G, COOPER C. The epidemiology of corticosteroid-induced osteoporosis:a meta-analysis[J]. Osteoporos Int, 2002, 13: 777–787. DOI: 10.1007/s001980200108 |
| [4] | LI J, ZHANG N, HUANG X, XU J, FERNANDES J C, DAI K, et al. Dexamethasone shifts bone marrow stromal cells from osteoblasts to adipocytes by C/EBPalpha promoter methylation[J/OL]. Cell Death Dis, 2013, 4:e832. doi:10.1038/cddis.2013.348. |
| [5] | DELAISSE J M. The reversal phase of the bone-remodeling cycle:cellular prerequisites for coupling resorption and formation[J]. Bonekey Rep, 2014, 3: 561. |
| [6] | ERIKSEN E F, HODGSON S F, EASTELL R, CEDEL S L, O'FALLON W M, RIGGS B L. Cancellous bone remodeling in type Ⅰ(postmenopausal) osteoporosis:quantitative assessment of rates of formation, resorption, and bone loss at tissue and cellular levels[J]. J Bone Miner Res, 1990, 5: 311–319. DOI: 10.1002/jbmr.5650050402 |
| [7] | XIAO W, LI S, PACIOS S, WANG Y, GRAVES D T. Bone remodeling under pathological conditions[J]. Front Oral Biol, 2016, 18: 17–27. |
| [8] | PANDUR P, MAURUS D, KVHL M. Increasingly complex:new players enter the Wnt signaling network[J]. Bioessays, 2002, 24: 881–884. DOI: 10.1002/bies.v24:10 |
| [9] | ETHERIDGE S L, SPENCER G J, HEATH D J, GENEVER P G. Expression profiling and functional analysis of wnt signaling mechanisms in mesenchymal stem cells[J]. Stem Cells, 2004, 22: 849–860. DOI: 10.1634/stemcells.22-5-849 |
| [10] | BENNETT C N, LONGO K A, WRIGHT W S, SUVA L J, LANE T F, HANKENSON K D, et al. Regulation of osteoblastogenesis and bone mass by Wnt10b[J]. Proc Natl Acad Sci USA, 2005, 102: 3324–3329. DOI: 10.1073/pnas.0408742102 |
| [11] | MORVAN F, BOULUKOS K, CLÉMENT-LACROIX P, ROMAN ROMAN S, SUC-ROYER I, VAYSSIÈRE B, et al. Deletion of a single allele of the Dkk1 gene leads to an increase in bone formation and bone mass[J]. J Bone Miner Res, 2006, 21: 934–945. DOI: 10.1359/jbmr.060311 |
| [12] | BODINE P V N, BILLIARD J, MORAN R A, PONCE-DE-LEON H, MCLARNEY S, MANGINE A, et al. The Wnt antagonist secreted frizzled-related protein-1 controls osteoblast and osteocyte apoptosis[J]. J Cell Biochem, 2005, 96: 1212–1230. DOI: 10.1002/(ISSN)1097-4644 |
| [13] | SMITH E, FRENKEL B. Glucocorticoids inhibit the transcriptional activity of LEF/TCF in differentiating osteoblasts in a glycogen synthase kinase-3beta-dependent and -independent manner[J]. J Biol Chem, 2005, 280: 2388–2394. |
| [14] | TANG L, CHEN Y, PEI F, ZHANG H. Lithium chloride modulates adipogenesis and osteogenesis of human bone marrow-derived mesenchymal stem cells[J]. Cell Physiol Biochem, 2015, 37: 143–152. DOI: 10.1159/000430340 |
| [15] | JIN Y, XU L, HU X, LIAO S, PATHAK J L, LIU J. Lithium chloride enhances bone regeneration and implant osseointegration in osteoporotic conditions[J/OL]. J Bone Miner Metab, 2016. doi:10.1007/s00774-016-0783-6. |
 2017, Vol. 38
2017, Vol. 38


