2. 上海交通大学医学院附属苏州九龙医院护理部, 苏州 215028;
3. 第二军医大学长海医院呼吸及危重症医学科, 上海 200433
2. Department of Nursing, Suzhou Kowloon Hospital, Shanghai Jiaotong University School of Medicine, Suzhou 215028, Jiangsu, China;
3. Department of Respiratory and Critical Care Medicine, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
随着表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)被广泛应用于临床治疗伴有EGFR突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,EGFR-TKI获得性耐药成为靶向治疗的新难题。T790M突变导致50%的EGFR-TKI不能有效阻断信号通路而产生耐药。临床上针对TKI耐药的处理策略分为不停用TKI和停用TKI两种,继续TKI治疗是多联合局部治疗或者化疗,而停用TKI治疗则是改为化疗或更换其他靶向药物治疗,如第3代TKI药物AZD9291、CO-1686等,但AZD9291的耐药同样不可避免[1]。本课题组前期实验证实,洛伐他汀联合吉非替尼治疗可克服吉非替尼耐药,但相关机制尚不清楚[2]。
肿瘤生长的微环境中如肿瘤细胞黏附分子及其受体、细胞因子和细胞外基质(extracellular matrix,ECM) 等成分的改变均可能参与EGFR-TKI 耐药。而整合素是参与细胞黏附介导的耐药(cell adhesion-mediated drug resistance,CAM-DR) 中最重要的黏附分子,已有研究证实整合素β1能介导细胞与ECM间的黏附,从而影响肿瘤细胞的增殖、侵袭。Fornaro等[3]在体外实验中发现整合素可以通过激活整合素-蛋白激酶B/Akt-Survivin信号通路使前列腺癌细胞逃避细胞凋亡;Okamura等[4]研究发现整合素β1-整合素连接激酶(integrin-linked kinase,ILK)-p-Akt信号通路是一种新的NSCLC的预后标记物和治疗靶点;Okamoto等[5]发现吉非替尼诱导肿瘤细胞凋亡主要是通过阻断磷脂酰肌醇3激酶-蛋白激酶B(phosphatidylinositol 3 kinase-protein kinase B,PI3K-Akt)-Survivin信号通路实现的。本课题组前期实验证实洛伐他汀联合吉非替尼可使对TKI耐药的NSCLC PC9细胞中信号通路蛋白p-EGFR、p-Akt等的表达水平明显下调,在此基础上本研究进一步观察两药联合是否干扰Akt上游的整合素β1以及下游的Survivin信号通路蛋白的表达,探讨洛伐他汀克服吉非替尼耐药与阻断整合素β1-p-Akt-Survivin信号通路的相关性。
1 材料和方法 1.1 细胞株及其培养吉非替尼耐药的NSCLC细胞株PC9由上海市肺科医院肿瘤科周彩存教授惠赠,用RPMI 1640培养液培养,培养液内含10%新生胎牛血清、100 U/mL青霉素、100 μg/mL链霉素,置于CO2培养箱中进行传代培养。
1.2 实验试剂吉非替尼由英国AstraZeneca公司生产(生产批号:MR099),去糖衣后用二甲基亚砜(DMSO)溶解,制成浓度为2.5×104 μmol/L的溶液,实验时用RPMI 1640培养液稀释,使DMSO体积分数<0.005%。CCK-8购自日本株式公社同仁化学研究所;洛伐他汀购自美国Sigma公司;整合素β1抗体、Survivin兔抗人多克隆抗体和β-actin(内对照)购自英国Abcam公司;整合素β1、Survivin引物购自生工生物工程(上海)股份有限公司;磷酸甘油醛脱氢酶(GAPDH)引物购自美国Fermentas公司。PCR试剂盒购自日本TaKaRa公司,总RNA 提取试剂盒购自美国Omega公司,反转录试剂盒购自美国Fermentas公司。其他试剂为国产分析纯。
1.3 实验分组洛伐他汀、吉非替尼分别用无水乙醇和DMSO溶解,药物配制浓度和处理时间以及研究方法参照前期实验[2]。分组如下:(1)无药对照组,以RPMI 1640培养液培养;(2)吉非替尼组,吉非替尼终浓度为1 μmol/L;(3)洛伐他汀组,洛伐他汀终浓度为5 μmol/L;(4)吉非替尼与洛伐他汀联合组(两药联合组),吉非替尼和洛伐他汀终浓度分别为1 μmol/L和5 μmol/L。
1.4 CCK-8法检测洛伐他汀联合吉非替尼对细胞增殖的影响取对数生长期的细胞按2×103/孔的密度将细胞悬液铺于96孔板,按1.3项下分组各孔分别加入不同浓度的药物孵育24、48、72 h,每孔加入10 μL CCK-8,继续孵育4 h后,用酶联免疫检测仪检测各孔在波长450 nm处的光密度(D)值。实验设空白对照组(只加DMSO液),实验重复3次。按下式计算细胞生长抑制率,细胞生长抑制率(%)=1-(D药物组-D空白对照组)/(D无药对照组-D空白对照组)×100%。
1.5 PCR法检测整合素β1、Survivin mRNA的表达取对数生长期的PC9细胞,胰酶消化后,用磷酸盐缓冲液(PBS)冲洗,离心2 min,弃上清后收集细胞。用总RNA 提取试剂盒提取细胞的总RNA,按试剂盒操作说明反转录合成cDNA。分别扩增整合素β1、Survivin和内参GAPDH。设计引物序列如下,整合素β1:正义 5′-CGT AGC AAA GGA ACA GCA GA-3′,反义 5′-GTA AGA CAG GTC CAT AAG GTA GTA G-3′,扩增片段长度为168 bp;Survivin:正义 5′-CAC CGC ATC TCT ACA TTC AA-3′,反义 5′-CAC TTT TTC GCA GTT TCC T-3′,扩增产物长度为345 bp;GAPDH:正义 5′-GAG TCA ACG GAT TTG GTC GT-3′,反义 5′-GAC AAG CTT CCC GTT CTC AG-3′,扩增产物长度为185 bp。PCR反应条件:95℃预变性10 min;95℃变性30 s、55℃退火30 s、72℃延伸30 s,共30个循环。PCR产物用2%琼脂糖凝胶电泳鉴定,用Bio-Rad凝胶成像系统拍照记录。将图像传入Quantity One分析系统对扩增产物进行图像分析,以相对光密度代表基因的表达丰度,以整合素β1、Survivin表达丰度分别与GAPDH表达丰度的比值表示mRNA的相对表达强度。
1.6 蛋白质印迹法检测整合素β1、Survivin蛋白的表达取对数生长期的PC9细胞,以不同药物孵育48 h后收集细胞并提取蛋白,BCA法测定蛋白浓度。SDS-PAGE分离蛋白后转膜,转膜成功后置于含5%脱脂奶粉的Tris盐缓冲液-吐温液(Tris-buffered saline-Tween,TBST)中,4℃条件下孵育过夜,然后用TBST进行漂洗。分别加入整合素β1抗体(1∶500)、Survivin兔抗人多克隆抗体(1∶1 000)室温温育2 h,TBST漂洗3次,每次10 min;然后加入相应的二抗(1∶10 000稀释)进行漂洗。用电化学发光法进行显像,检测目的蛋白条带;以β-actin作为内对照,实验重复3次。蛋白相对表达量计算公式:蛋白相对表达量=(目的蛋白条带灰度值-本底灰度值)/(β-actin条带灰度值-本底灰度值)。
1.7 统计学处理应用SPSS 17.0软件进行统计学分析,结果以x±s表示。组间比较采用单因素方差(One-way ANOVA)分析,组间两两比较采用SNK法。检验水准(α)为0.05。
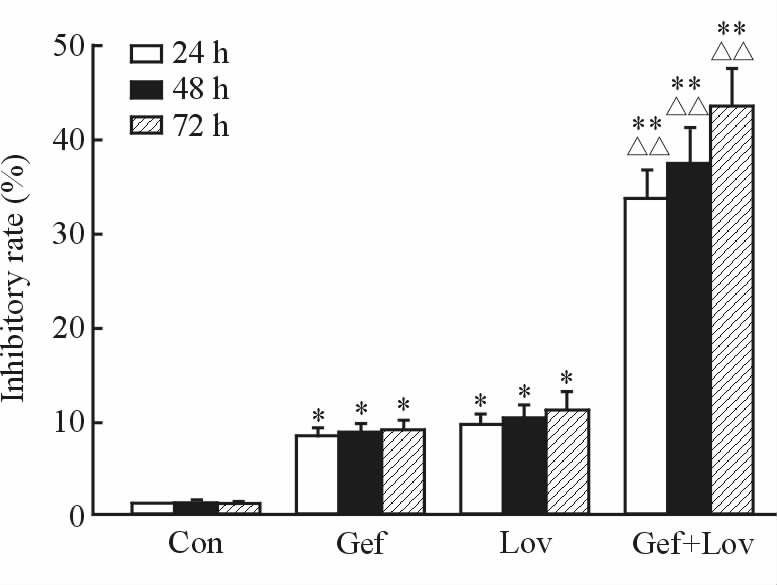
2 结 果 2.1 洛伐他汀与吉非替尼联用对PC9细胞增殖的影响CCK-8法检测结果显示,分别处理24、48、72 h 后,与无药对照组相比,洛伐他汀组、吉非替尼组以及两药联合组PC9细胞均呈现增殖抑制,差异有统计学意义(P<0.05或P<0.01);洛伐他汀组与吉非替尼组差异无统计学意义(P>0.05);两药联合组细胞增殖的抑制效应强于吉非替尼组和洛伐他汀组,差异有统计学意义(P<0.01,图 1)。
|
图 1 各组药物对耐药PC9细胞增殖的抑制作用 Fig 1 Inhibition of PC9 cells proliferation after treatment with different drugs Con: Control group; Gef: Gefitinib group; Lov: Lovastatin group; Gef+Lov: Gefitinib+lovastatin group. *P<0.05,**P<0.01 vs Con group; △△P<0.01 vs Gef group and Lov group. n=3,x±s |
2.2 洛伐他汀与吉非替尼联用对整合素β1、Survivin mRNA表达的影响
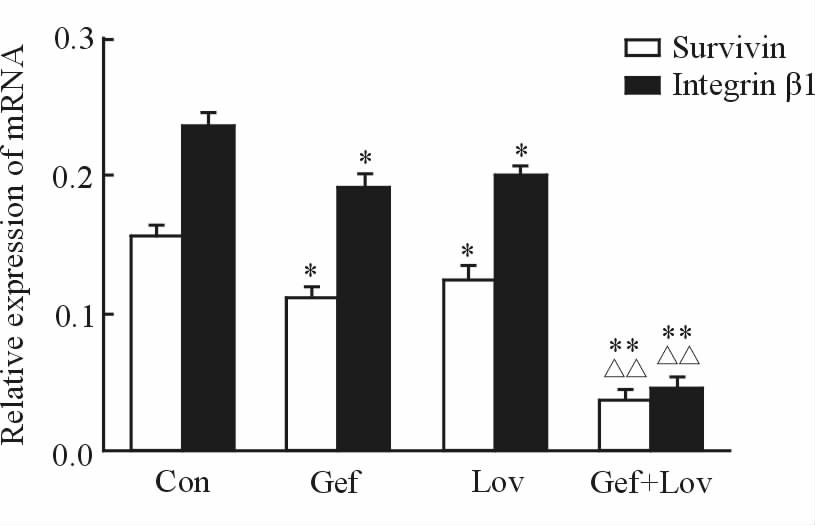
PCR法检测结果显示,与无药对照组相比,洛伐他汀组、吉非替尼组细胞中整合素β1、Survivin mRNA的表达均降低(P<0.05或P<0.01),而两药联合组与洛伐他汀组、吉非替尼组相比,整合素β1、Survivin mRNA的表达降低,差异有统计学意义(P<0.01,图 2)。
|
图 2 各组药物处理后的PC9细胞中整合素β1、Survivin mRNA表达水平 Fig 2 Levels of Survivin and integrin β1 mRNA in PC9 cells after treatment with different drugs Con: Control group; Gef: Gefitinib group; Lov: Lovastatin group; Gef+Lov: Gefitinib+lovastatin group. *P<0.05,**P<0.01 vs Con group; △△P<0.01 vs Gef group and Lov group. n=3,x±s |
2.3 洛伐他汀与吉非替尼联用对整合素β1、Survivin蛋白表达的影响
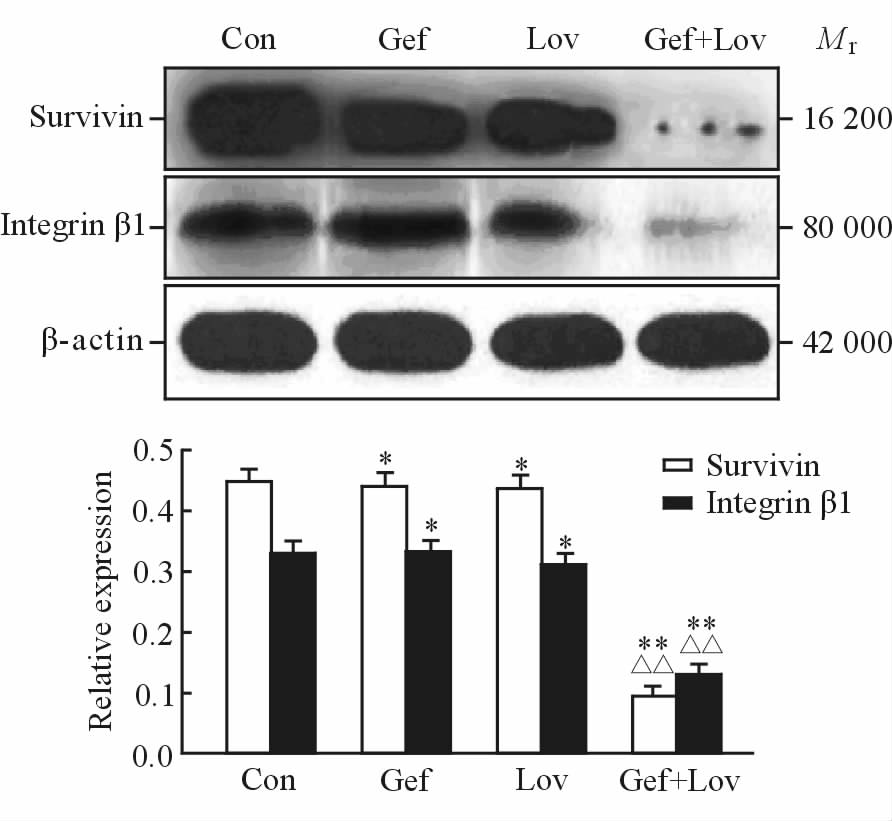
应用蛋白质印迹法检测整合素β1、Survivin蛋白的表达水平,结果显示,与吉非替尼组、洛伐他汀组相比,两药联合组细胞中整合素β1蛋白、Survivin蛋白的表达均降低(P<0.01,图 3)。
|
图 3 不同药物处理后PC9细胞中整合素β1、Survivin蛋白表达水平 Fig 3 Expressions of Survivin and integrin β1 protein in PC9 cells after treatment with different drugs Con: Control group; Gef: Gefitinib group; Lov: Lovastatin group; Gef+Lov: Gefitinib+lovastatin group. *P<0.05,**P<0.01 vs Con group; △△P<0.01 vs Gef group and Lov group. n=3,x±s |
3 讨 论
整合素β1表达上调可降低细胞株或移植瘤对吉非替尼的敏感性,而其过表达可通过PI3K途径激活下游信号分子,这可能是一种重要的EGFR-TKI耐药机制[6]。Okamura等[4]检测了118例病理证实的NSCLC组织标本发现,整合素β1、ILK、p-Akt的表达水平与NSCLC的预后呈负相关,提示三者同时过表达与传统的预后因素如T因子以及淋巴管浸润相比是一个独立的预后因素。
Survivin是目前发现的功能最强的凋亡抑制因子,它可以通过有丝分裂促进细胞增殖,抑制细胞凋亡。Survivin蛋白可直接作用于细胞凋亡途径中的终末效应酶-半胱氨酸蛋白酶Dispose-3、caspase-7,从而促进细胞增殖和参与血管形成。Survivin在许多肿瘤组织中表达而在成人正常组织中不表达,可作为临床评估肿瘤的进展、转移、预后及治疗的重要检测指标[7-8]。Okamoto等[5]发现吉非替尼诱导细胞凋亡是通过同时中断PI3K-Akt-Survivin和Raf/丝裂原激活蛋白激酶的激酶(mitogen-activated protein kinase kinase,MEK)-细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)-Bim(Bcl-2 interacting medicator of cell death)上游的信号通路来实现的。另有一项研究也证实,联合应用PI3K抑制剂和MEK抑制剂可通过抑制PI3K-Akt-Survivin和MEK-ERK-Bim信号通路来治疗伴有EGFR突变的NSCLC [9]。
本课题组前期在体外实验中已经证实洛伐他汀能够克服吉非替尼耐药,发现洛伐他汀联合吉非替尼可诱导耐药PC9细胞凋亡,同时使耐药PC9细胞中p-EGFR、p-Akt和p-ERK1/2蛋白的表达水平明显下调[2],这与Park等[10]的研究结果基本一致。近期有研究在体内和体外实验中联合应用洛伐他汀和吉非替尼处理吉非替尼耐药的胆管癌细胞株SSP-25和HuH-28,结果发现洛伐他汀主要通过诱导肿瘤坏死因子α的表达来克服吉非替尼耐药[11]。本研究进一步证实,洛伐他汀克服吉非替尼耐药的机制可能主要是干扰上游整合素β1蛋白的表达,进而阻断Akt、Survivin等下游信号通路蛋白的表达,从而促进耐药PC9细胞的凋亡。Hwang等[12]研究证实,辛伐他汀可以通过阻断Akt/β-链蛋白依赖的Survivin信号通路来抑制伴有EGFR T790M突变的NSCLC细胞凋亡,与本研究结果一致。
综上所述,本研究结合前期实验结果证实洛伐他汀联合吉非替尼克服继发性吉非替尼耐药主要是通过抑制Akt上游整合素β1及下游Survivin的表达,进而阻断整合素β1-p-Akt-Survivin信号通路实现的,因此,洛伐他汀联合吉非替尼有望成为克服吉非替尼耐药的一种有效策略。
| [1] | KIM T M, SONG A, KIM D W, KIM S, AHN Y O, KEAM B, et al. Mechanisms of acquired resistance to AZD9291, a mutation-selective, irreversible EGFR inhibitor[J]. J Thorac Oncol, 2015, 10: 1736–1744. DOI: 10.1097/JTO.0000000000000688 |
| [2] | 吉泽, 范理宏, 季现秀, 宋丽, 祁慧薇. 洛伐他汀克服吉非替尼耐药的非小细胞肺癌PC9细胞株的体外研究[J]. 肿瘤, 2011, 31: 682–687. |
| [3] | FORNARO M, PLESCIA J, CHHEANG S, TALLINI G, ZHU Y M, KING M, et al. Fibronectin protects prostate cancer cells from tumor necrosis factor-α-induced apoptosis via the AKT/survivin pathway[J]. J Biol Chem, 2003, 278: 50402–50411. DOI: 10.1074/jbc.M307627200 |
| [4] | OKAMURA M, YAMAJI S, NAGASHIMA Y, NISHIKAWA M, YOSHIMOTO N, KIDO Y, et al. Prognostic value of integrin β1-ILK-pAkt signaling pathway in non-small cell lung cancer[J]. Hum Pathol, 2007, 38: 1081–1091. DOI: 10.1016/j.humpath.2007.01.003 |
| [5] | OKAMOTO K, OKAMOTO I, OKAMOTO W, TANAKA K, TAKEZAWA K, KUWATA K, et al. Role of survivin in EGFR inhibitor-induced apoptosis in non-small cell lung cancers positive for EGFR mutations[J]. Cancer Res, 2010, 70: 10402–10410. DOI: 10.1158/0008-5472.CAN-10-2438 |
| [6] |
邓沁芳, 徐建芳, 粟波, 赵印敏, 周彩存. 整合素β1信号通路参与非小细胞肺癌吉非替尼获得性耐药[J]. 第二军医大学学报, 2012, 33: 585–589.
DENG Q F, XU J F, SU B, ZHAO Y M, ZHOU C C. Integrin β1 participates in acquired resistance to gefitinib in non-small cell lung cancer[J]. Acad J Sec Mil Med Univ, 2012, 33: 585–589. |
| [7] |
祝丽双, 王浩, 陈佳, 刘畅, 陆慧琪, 韩焕兴. 布洛芬抑制人NSCLC细胞株NCI-H460和乳腺癌细胞株SKBR3增殖和转移的机制探讨[J]. 第二军医大学学报, 2014, 35: 1327–1332.
ZHU L S, WANG H, CHEN J, LIU C, LU H Q, HAN H X. Ibuprofen suppresses proliferation and metastasis of human non-small cell lung cancer cell line NCI-H460 and breast cancer cell line SKBR3[J]. Acad J Sec Mil Med Univ, 2014, 35: 1327–1332. DOI: 10.3724/SP.J.1008.2014.01327 |
| [8] |
檀碧波, 李勇, 范立侨, 赵群, 王冬, 刘羽. 抑制Vav3基因表达对胃癌细胞凋亡抑制蛋白及肿瘤多药耐药性的影响[J]. 第二军医大学学报, 2015, 36: 136–141.
THAN B B, LI Y, FAN L Q, ZHAO Q, WANG D, LIU Y. Effect of Vav3 gene inhibition on inhibitor of apoptosis proteins and multidrug resistance in gastric cancer cells[J]. Acad J Sec Mil Med Univ, 2015, 36: 136–141. DOI: 10.3724/SP.J.1008.2015.00136 |
| [9] | FABER A C, LI D, SONG Y, LIANG M C, YEAP B Y, BRONSON R T, et al. Differential induction of apoptosis in HER2 and EGFR addicted cancers following PI3K inhibition[J]. Proc Natl Acad Sci USA, 2009, 1069: 19503–19508. |
| [10] | PARK I H, KIM J Y, JUNG J I, HAN J Y. Lovastatin overcomes gefitinib resistance in human non-small cell lung cancer cells with K-Ras mutations[J]. Invest New Drugs, 2010, 28: 791–799. DOI: 10.1007/s10637-009-9319-4 |
| [11] | YANG S H, LIN H Y, CHANG V H, CHEN C C, LI Y R, WANG J, et al. Lovastatin overcomes gefitinib resistance through TNF-α signaling in human cholangiocarcinomas with different LKB1 statuses in vitro and in vivo[J]. Oncotarget, 2015, 6: 23857–23873. DOI: 10.18632/oncotarget |
| [12] | HWANG K E, KWON S J, KIM Y S, PARK D S, KIM B R, YOON K H, et al. Effect of simvastatin on the resistance to EGFR tyrosine kinase inhibitors in a non-small cell lung cancer with the T790M mutation of EGFR[J]. Exp Cell Res, 2014, 323: 288–296. DOI: 10.1016/j.yexcr.2014.02.026 |
 2017, Vol. 38
2017, Vol. 38


