引导组织再生(guided tissue regeneration,GTR)是为恢复因牙周病导致丧失的牙周支持组织的特殊技术,其在牙周和种植方面的作用越来越受到重视[1]。在组织学愈合过程中,如果牙周膜细胞(PDL-C)接触牙根面结缔组织就会形成,所以其中屏障膜材料是GTR的关键因素[2]。目前,生物可降解膜材料省去了二次取出膜材料的手术过程,具有生物相容性好和降解产物无毒性作用等特点[3],研究和应用广泛。
聚乳酸-羟基乙酸共聚物(PLGA)具有良好的降解性能、生物相容性、无毒性和结构可变性,广泛应用于药物、医学组织工程等领域[4]。通过在制备过程中调整聚乳酸和聚乙醇酸的比例,可以调整PLGA的降解性能[5],为药物的持久释放提供了可能[6]。壳聚糖(CS)有良好的生物相容性和降解性,还具有抗菌、止血、阻止组织粘连、加速愈合等特性[7]。对于口腔常见病原菌,研究人员通过体外实验证实较低浓度的CS能够抑制放线杆菌和变形链球菌[8]。纳米羟基磷灰石(nHA)是人体硬组织的主要组成部分,因为其置入人体后能和软骨组织紧密结合,而被广泛用作骨替代物[9];其化学成分与天然骨中的矿物成分非常相近,其生物活性能够支持必要的骨组织再生[10]。然而,PLGA等高分子材料在体内发生水解时会产生轻微炎症,虽然对人体无害,但会影响GTR的效果[11-12];CS膜加工性能差且脆性大,限制了其在GTR等生物医学领域的应用。将PLGA与CS混合制成复合材料,可以将合成高分子材料的理化性能和加工性能与天然高分子材料的生物相容性结合在一起,克服单一聚合物的缺点。在其中添加nHA可进一步增加复合材料的生物活性。
本研究旨在采用冷冻干燥法,按CS和PLGA以不同的质量比制备成牙周GTR载药PLGA/CS/nHA复合膜,并检测其表征、药物缓释及细胞相容性。
1 材料和方法 1.1 实验设备、材料及试剂磁力搅拌器(常州华冠仪器有限公司);FD-1CE冷冻干燥机(北京德天佑科技发展有限公司);S-4800型扫描电子显微镜(日本日立公司);电子万能材料实验机(WDW-2C,无锡建仪实验器材有限公司);紫外分光光度计(U-3900H,日本日立公司)。乙醇酸-羟基乙酸共聚物(乙醇酸与羟基乙酸体积比为75∶25,长春圣博玛生物材料有限公司);医用级CS(脱乙酰度>90%,南通兴成生物制品厂);聚乙烯吡咯烷酮(PVP-K30,相对分子质量10 000,天津光复精细化工研究所)。nHA(20 nm,兰州旋光化学技术有限公司)。克林霉素(批号H20031253,西安力邦制药有限公司)。
1.2 优化分组按照PLGA与CS质量比100∶0、90∶10、80∶20、70∶30 分为4组,并按CS所占的质量分数分别标记为C0、C10、C20、C30,每组加入nHA 1 g。PLGA、CS总量与致孔剂的质量比约为1∶1。
1.3 PLGA/CS/nHA复合膜的制备PLAG 37℃真空干燥24 h,分别配制PLGA的丙酮溶液和CS的冰醋酸溶液,分别按照PLGA/CS质量比为90∶10、80∶20、70∶30这3种比例混合,磁力加热搅拌2 h。对照组为未加CS的原溶液。配制10%的nHA水溶液10 mL,超声混合均匀。精密称取100 mg克林霉素溶于蒸馏水,并将致孔剂PVP分别缓慢逐滴加入到上述溶液中,继续磁力搅拌2 h,超声波振荡1 h,停止反应;缓慢倾倒入培养皿中,形成厚度为1 mm 的凝胶,将制得的凝胶置于25℃恒温24 h,使其中丙酮挥发,再于-80℃预冻12 h,冷冻干燥24 h,获得PLGA/CS/nHA膜。将膜用2%的NaOH溶液浸泡除酸,大量去离子水反复清洗去除致孔剂后,二次冷冻干燥,得到PLGA/CS/nHA克林霉素复合药膜。
1.4 PLGA/CS/nHA复合膜的性能考察 1.4.1 孔隙率采用无水乙醇液体置换法检测其孔隙率。将制备的膜干燥后剪裁成10 mm×10 mm×1 mm的小片,浸入装有无水乙醇的量筒中,其中无水乙醇的体积为V1。将量筒置于真空干燥器中 5 min,抽真空,将材料孔隙内空气抽空,使乙醇进入材料孔隙内,至无气泡溢出为止,此时总体积计为 V2。将材料取出后,剩余乙醇体积计为 V3。材料孔隙率ε(%)=(V1-V3)/(V2-V3)×100%。设置3组平行样品,取其平均值作为孔隙率测试结果。
1.4.2 吸水率将制备的膜干燥后剪裁成10 mm×10 mm×1 mm的小片,称其干质量(W0)后置于水中4 h,取出用滤纸将膜表面的水分吸去,称其湿质量(Wwet)。吸水率(%)=(Wwet-W0)/W0×100%。
1.4.3 力学性能将制备的膜干燥后用标准的哑铃试样裁制成大约30 mm×120 mm×1 mm的薄片,将样条浸入pH=7.4的PBS中3 min,取出后将试样表面水分用滤纸吸干,立即进行湿态力学性能测试。测试条件:温度21℃,相对湿度45%,拉伸速率5 mm/min。各组样品测试3次取平均值。
1.4.4 体外降解将制备的膜干燥后剪裁成10 mm×10 mm×1 mm的小片,真空干燥后称量其干质量W0,将其放入装有20 mL 模拟体液(SBF)的离心管中,然后将离心管放置在37℃ 100 r/min(r=5 cm)的摇床上进行降解。每5 d取出1次,更换离心管中的SBF;分别在第5、10、15、20、25、30 天将膜取出,用滤纸吸干膜表面的水分,再将其放入到40℃烘箱中烘12 h,称量干质量Wdry。膜的质量损失率(%)=(W0-Wdry)/Wdry×100%。
1.5 紫外光谱测定克林霉素线性关系参考文献[13]。
1.6 体外药物释放实验取含克林霉素的药膜,裁成10 mm×10 mm×1 mm的小片,分别在5 mL盐酸溶液、37℃恒温条件下进行14 d体外释放实验,每隔24 h取出4 mL用1.5项下方法测得其光密度(D)值,同时再补充4 mL介质,根据标准曲线求得其每日的释药量,并对释药时间作图。
1.7 牙周膜成纤维细胞培养和增殖将购于Cyagen Biosciences Inc. 的牙周膜成纤维细胞复苏,加入5 mL DMEM培养液(20%胎牛血清,青霉素100 U/mL,链霉素100 μg/mL)置CO2培养箱(5% CO2,95%空气,100%湿度,37℃恒温)中培养,隔天换液,传至第3代备用。
将牙周膜成纤维细胞种植在支架上,将涂有不同比例PLGA/CS/nHA薄膜的方形玻璃片放入24孔培养板中,以涂PLGA薄膜和未涂膜的玻璃片为对照组,选取3个观察时间点(1、4、7 d),每组3个平行样,紫外光照2 h;将培养的第3代牙周膜成纤维细胞经0.25%胰蛋白酶消化,计数,按每孔3.5×104的密度接种牙周膜成纤维细胞,37℃、5% CO2培养箱培养7 d,隔天换液,倒置显微镜每天观察细胞生长情况。
1.8 扫描电子显微镜观察细胞的生长形态支架置入细胞7 d后在2.5%戊二醛中固定24 h,用PBS冲洗3次,在乙醇中梯度脱水(分别为30%、50%、70%、90%、100%),干燥、喷金,扫描电子显微镜观察。
1.9 CCK-8测试细胞活性和扩增情况牙周膜成纤维细胞分别浸在20%胎牛血清的完全培养基支架上培养1、4、7 d。将200 μL上清液的等分试样用移液管移到96孔板,加入10% CCK-8溶液,于5% CO2 37℃孵育4 h,酶标仪 (Infinite M200,TECAN,Swiss) 测450 nm处D值。
1.10 统计学处理所有实验重复3次,结果以x±s 表示,采用SPSS 16.0软件对数据进行分析,以t检验进行组间比较。检验水准(α)为0.05。
2 结 果 2.1 PLGA/CS/nHA复合膜的性能考察结果 2.1.1 孔隙率C0、C10、C20、C30组复合膜的孔隙率分别为(10.26±0.38)%、(28.66±1.35)%、(38.28±2.11)%、(40.02±1.33)%。可见与纯PLGA膜相比,添加CS后复合膜的孔隙率增加,溶出致孔剂PVP后PLGA/CS/nHA复合膜的孔隙率为28%~40%。
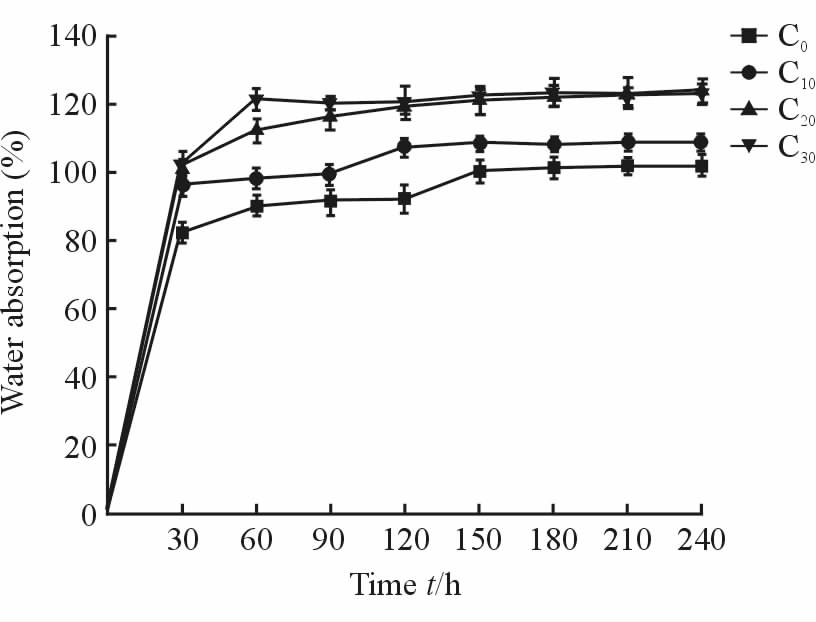
2.1.2 吸水率由图 1可见,C0、C10、C20、C30组复合膜均在最初的30 min内吸水率升高很快,但在随后的30 min 内吸水率增加有所减缓,60 min后各组复合膜均基本达到吸水平衡。
|
图 1 各组PLGA/CS/nHA复合膜随时间变化的吸水率 Fig 1 Water absorption changes of PLGA/CS/nHA composite membranes PLGA/CS/nHA: Polylactic-co-glycolic acid/chitosan/nano-hydroxyapatite. C0: m(PLGA)∶m(CS)=100∶0; C10: m(PLGA)∶m(CS)=90∶10; C20: m(PLGA)∶m(CS)=80∶20; C30: m(PLGA)∶m(CS)=70∶30. n=3,x±s |
2.1.3 力学性能
由表 1可见各组PLGA/CS/nHA复合膜在湿态条件下的拉伸强度为1.43~2.36 MPa,断裂伸长率为185.06%~224.32%,断裂力为33.04~45.98 N。
|
|
表 1 各组PLGA/CS/nHA复合膜的湿态力学性能 Tab 1 The mechanical properties of PLGA/CS/nHA composite membranes under wet conditions |
2.1.4 体外降解
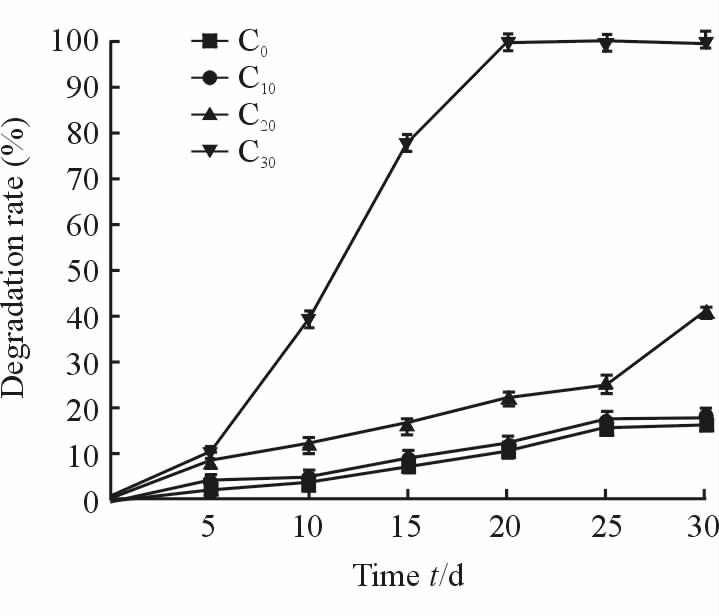
从图 2可以看出,C30组复合膜在20 d左右完全降解,这是因为CS降解较快,使复合膜的溶胀度随着CS含量的增加而增大。C20组复合膜在降解至30 d时失去强度,C10降解30 d时降解率为(17.60±0.86)%,仍具有部分强度。理想的GTR材料膜发挥功能时间最好为6周;体外降解显示组别C10降解与组织生长相适应,能够创造和维持牙周引导组织生长特定的空间,是一种理想的牙周GTR屏障膜。
|
图 2 各组PLGA/CS/nHA复合膜在模拟体液中的降解曲线 Fig 2 The degradation rates of PLGA/CS/nHA composite membranes in simulated body fluid solution PLGA/CS/nHA: Polylactic-co-glycolic acid/chitosan/nano-hydroxyapatite. C0: m(PLGA)∶m(CS)=100∶0; C10: m(PLGA)∶m(CS)=90∶10; C20: m(PLGA)∶m(CS)=80∶20; C30: m(PLGA)∶m(CS)=70∶30. n=3,x±s |
2.2 PLGA/CS/nHA载药复合膜的体外药物释放
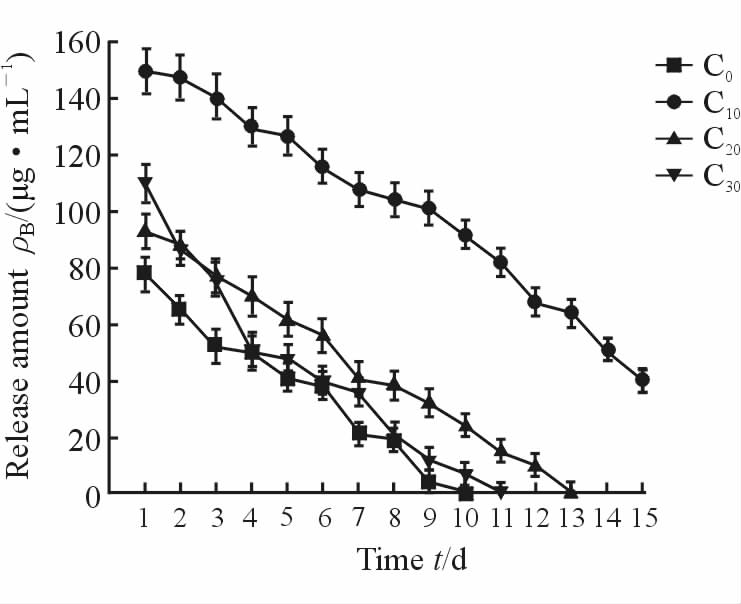
以药物释药量为纵坐标、药物释放时间为横坐标分别绘制药膜每日缓释曲线(图 3)。图 3显示,不同PLGA/CS质量比的载药膜均有突释现象,直到2 d后载药膜的药物缓释量才趋于平稳,并可维持有效释药量10 d以上。由图 3可知,C10组复合膜第1天药物释放量为150 μg/mL,高于C0组(75 μg/mL)、C20组(93 μg/mL)及C30组(110 μg/mL)。C10组复合膜可维持有效药物浓度时间>15 d,而其他组复合膜可维持有效药物浓度的时间均达到10 d。
|
图 3 各组PLGA/CS/nHA复合膜的每日释药曲线 Fig 3 The daily drug release curves of PLGA/CS/nHA composite membranes PLGA/CS/nHA: Polylactic-co-glycolic acid/chitosan/nano-hydroxyapatite. C0: m(PLGA)∶m(CS)=100∶0; C10: m(PLGA)∶m(CS)=90∶10; C20: m(PLGA)∶m(CS)=80∶20; C30: m(PLGA)∶m(CS)=70∶30. n=3,x±s |
2.3 细胞形态学观察
如图 4示,牙周膜成纤维细胞单独培养7 d后可见细胞增殖明显,细胞质开始彼此接触(图 4A)。牙周膜成纤维细胞在C10组支架上培养7 d后,细胞增殖明显,彼此相连并聚集,支架上单个细胞难以看见且已经长入孔中,细胞层和细胞外基质层继续增厚并将支架基本覆盖,而且细胞基质层表面光滑(图 4C)。C0、C20、C30组支架上可见散在的细胞分布,细胞间相互接触较少,未将支架表面覆盖(图 4B、4D、4E)。

|
图 4 倒置相差显微镜下PLFs(A)和SEM多孔PLGA/CS/nHA复合膜(B-E) Fig 4 The PLFs under inverted phase contrast microscope (A) and porous PLGA/CS/nHA composite membrane under SEM (B-E) A: PLFs cultured for 7 days (Original magnification: ×100); B: PLFs cultured on C0 group for 7 days; C: PLFs cultured on C10 group for 7 days; D: PLFs cultured on C20 group for 7 days; E: PLFs cultured on C30 group for 7 days. PLFs: Periodontal ligament fibroblasts; SEM: Scanning electron microscope; PLGA/CS/nHA: Poly-lactic-co-glycolic acid/chitosan/nano-hydroxyapatite |
2.4 细胞增殖情况
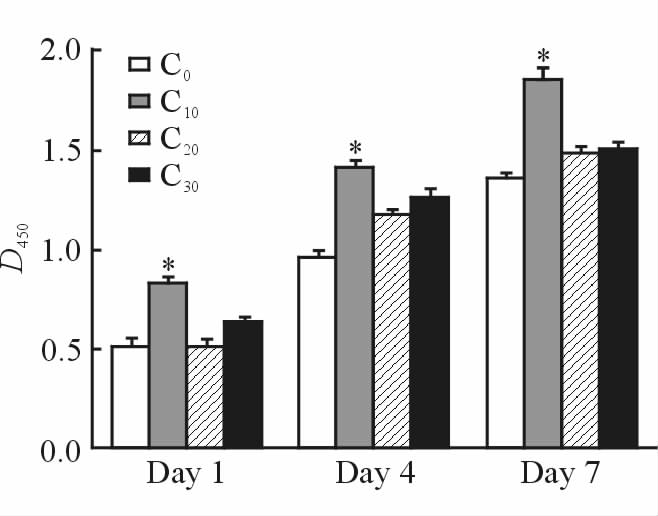
如图 5示,随着培养时间的延长,牙周膜成纤维细胞在各支架材料上均呈现出良好的增殖状态,表明4种材料对牙周膜成纤维细胞均有良好的生物相容性。牙周膜成纤维细胞在C10组复合材料上呈现出最高的增殖能力,与其他3组间的差异均有统计学意义(P<0.05)。
|
图 5 CCK-8法检测多孔PLGA/CS/nHA 复合膜上PLFs的增殖情况 Fig 5 The proliferation of PLFs in porous PLGA/CS/nHA composite membranes with CCK-8 method at 450 nm PLGA/CS/nHA:Polylactic-co-glycolic acid/chitosan/nano-hydroxyapatite. C0: m(PLGA)∶m(CS)=100∶0; C10: m(PLGA)∶m(CS)=90∶10; C20: m(PLGA)∶m(CS)=80∶20; C30: m(PLGA)∶m(CS)=70∶30. *P<0.05 vs other three groups. n=3,x±s |
3 讨 论
近年来兴起的牙周GTR疗法可在一定程度上使牙周膜、牙槽骨等牙周组织再生[14]。1976 年,Melcher 提出PDL-C能分化出牙骨质细胞、牙槽骨细胞和牙周膜纤维细胞,若PDL-C 先接触牙根面进行增殖分化则产生理想的牙周再生,这一理论即是GTR 的基础。GTR通过膜屏障阻挡牙龈上皮和结缔组织与牙根面接触,阻止成纤维细胞与上皮细胞进入需要引导再生的部位,从而能够使新的组织再生。
理想的牙周GTR屏障膜应该允许组织液通过,隔离牙龈上皮和结缔组织,为牙周组织再生提供空间。而本研究使用PVP作为致孔剂,PVP是一种水溶性高分子化合物,极易溶于水,它具有优异的溶解性能和生理相容性。孔隙率太高会影响膜的力学性能,孔隙率在30%左右的复合膜结构稳定,为骨再生提供生长空间[15],所以C10组复合膜的孔隙率较为理想。牙周GTR屏障膜置入人体后在湿态环境下发挥作用,从本研究中可看出,PLGA/CS/nHA复合膜在湿态环境下具有一定的力学强度,足够支持牙龈结缔组织,防止牙龈上皮细胞和结缔组织细胞进入牙周组织再生的区域。说明PLGA/CS/nHA复合膜能够创造并维持引导牙周组织再生的独特空间,为分隔开牙龈组织、结缔组织提供了良好的条件,其中C10组复合膜的拉伸强度及断裂力优于其余3组。此外,PLGA/CS/nHA复合膜具有一定的拉伸强度和可塑性,能够满足临床医师根据患者牙周状况的不同而制作成不同形状膜载体的要求[16],有利于牙周疾病的治疗,减轻牙周疾病治疗过程中的治疗创伤。
牙周组织再生是在湿态环境下进行的,所以为保持组织再生区域的湿润,屏障膜需要有一定的吸水率,PLGA/CS/nHA复合膜的吸水率随着CS含量的增加而增大,这是因为CS具有亲水性的羟基和氨基。纯PLGA复合膜中结晶较多,分子与分子间链缠结紧密,水分子很难进入,因而吸水率不高。
Shin等[17]认为,一般的牙周组织再生时间为4~6周,屏障膜在体内存在的时间过长则会影响引导牙周组织再生的效果,过短则不能发挥屏障膜的作用,无法使牙龈结缔组织隔离。所以,生物可降解性是牙周GTR屏障膜的重要性能,其要求膜材料的降解速率与新生组织形成速率相匹配,使缺损处的牙周组织再生的同时阻止牙龈上皮和结缔组织的进入。本实验结果显示C10组复合膜的体外降解速率与新生组织再生的速率相适应,可以为组织再生提供空间。并且CS的降解产物呈弱碱性,与PLGA降解出的弱酸性产物中和,调节局部pH,减少了局部炎症的发生概率。
牙龈卟啉单胞菌(Porphyromonas gingivalis)是革兰阴性厌氧菌,是主要的牙周致病菌之一,在引发牙周组织破坏过程中发挥重要作用[18],研究发现,卟啉单胞菌对克林霉素敏感[19]。克林霉素能明显改善牙周炎的临床症状[20]。PLGA/CS/nHA复合膜的载药量与以下条件有关:结晶度越高载药量越高,本实验中C10组复合膜的结晶程度较高;PLGA含量越高载药量越高[21],本实验4组中C10组复合膜中PLGA的含量最高。C10组复合膜的释药最稳定,由此可见,PLGA/CS/nHA载药膜在CS含量为10%时降解速率最慢,结晶区的药物释放缓慢,因此维持药物浓度的时间最长。不同PLGA/CS质量比的载药膜均有突释现象,可能是因为载药复合膜浸泡于介质中,其接近表面的克林霉素快速释放到介质中造成药物突释。本研究仅可观察到载药复合膜的释药大体趋势,具体效果还需进行进一步研究,并且药物突释问题也有待解决。
对于大面积的牙周组织缺损和老年牙周炎患者,牙周GTR技术并不能有效地使其牙周组织再生和重建,这主要由患者牙周缺损区域组织再生的细胞活力较低或来源受限[22-23]所致。Amar等[24]认为将牙周GTR技术与牙周膜细胞结合起来是未来的研究方向,这样可弥补单纯的牙周GTR技术的不足。因此将组织工程与牙周再生结合起来,将种子细胞与组织工程支架共同培养,并作为隔离膜材料置入牙周缺损区域,在激发组织自身再生的同时增加缺损区域的细胞数量和活性,这一方法提高了牙周GTR的治疗效果。基于上述观点,我们对载药复合膜的细胞相容性进行了研究。本实验采用扫描电子显微镜和CCK-8检测法观察了1、4、7 d 3个时间点的细胞生长增殖情况。在7 d的细胞培养过程中4组支架上的细胞活力均持续增加,在1、4、7 d C10组支架上的细胞密度高于另3组(P<0.05);这与C10组支架的高孔隙率及孔与孔之间存在大量微孔的高贯通性有关。细胞需要孔隙来维持它们生长、增殖和分化,营养物质和废物的迁移以及新生血管的生长,高孔隙率有助于细胞更有效地黏附在支架上以及发生细胞反应,从而促进细胞更好地生长增殖。
综上所述,PLGA与CS质量比为90/10时,载药PLGA/CS/nHA复合膜是较为理想的牙周GTR屏障,其体内实验有待进一步研究,为GTR膜的临床应用提供理论依据。
| [1] | 刁晓悦, 柳忠豪. 牙周组织再生治疗方法研究进展[J]. 中国口腔种植学杂志, 2014, 19: 34–37. |
| [2] | BEHRING J, JUNKER R, WALBOOMERS X F, CHESSNUT B, JANSEN J A. Toward guided tissue and bone regeneration:morphology, attachment, proliferation, and migration of cells cultured on collagen barrier membranes. A systematic review[J]. Odontology, 2008, 96: 1–11. DOI: 10.1007/s10266-008-0087-y |
| [3] | 葛柳莹, 赵利芬, 段开文. 牙周引导组织的再生膜材料[J]. 中国组织工程研究与临床康复, 2010, 14: 7895–7898. |
| [4] | LÜ J M, WANG X, MARIN-MULLER C, WANG H, LIN P H, YAO Q, et al. Current advances in research and clinical applications of PLGA-based nanotechnology[J]. Expert Rev Mol Diagn, 2009, 9: 325–341. DOI: 10.1586/erm.09.15 |
| [5] | SHIVE M S, ANDERSON J M. Biodegradation and biocompatibility of PLA and PLGA microspheres[J]. Adv Drug Deliv Rev, 1997, 28: 5–24. DOI: 10.1016/S0169-409X(97)00048-3 |
| [6] | MAKADIA H K, SIEGEL S J. Poly lactic-co-glycolic acid (PLGA) as biodegradable controlled drug delivery carrier[J]. Polymers, 2011, 3: 1377–1397. DOI: 10.3390/polym3031377 |
| [7] | 顾其胜, 陶伟栋, 蒋丽霞. 壳聚糖基复合材料类新型生物医用材料[J]. 上海生物医学工程, 2007, 28: 31–35. |
| [8] | CHOI B K, KIM K Y, YOO Y J, OH S J, CHOI J H, KIM C Y. In vitro antimicrobial activity of a chitooligosaccharide mixture against Actinobacillus actinomycetemcomitans and Streptococcus mutans[J]. Int J Antimicrob Agents, 2001, 18: 553–557. DOI: 10.1016/S0924-8579(01)00434-4 |
| [9] | 郭恩言, 王峰, 赵萍, 储新宏, 姜倩. 纳米羟基磷灰石/壳聚糖复合材料的制备及发展趋势[J]. 中国组织工程研究与临床康复, 2010, 14: 500–504. |
| [10] | KIM H W, SONG J H, KIM H E. Nanofiber generation of gelatin-hydroxyapatite biomimetics for guided tissue regeneration[J]. Adv Func Mater, 2005, 15: 1988–1994. DOI: 10.1002/(ISSN)1616-3028 |
| [11] | ZELLIN G, GRITLI-LINDE A, LINDE A. Healing of mandibular defects with different biodegradable and non-biodegradable membranes:an experimental study in rats[J]. Biomaterials, 1995, 16: 601–609. DOI: 10.1016/0142-9612(95)93857-A |
| [12] | ZHAO S, PINHOLT E M, MADSEN J E, DONATH K. Histological evaluation of different biodegradable and non-biodegradable membranes implanted subcutaneously in rats[J]. J Craniomaxillofac Surg, 2000, 28: 116–122. DOI: 10.1054/jcms.2000.0127 |
| [13] | 张萍, 吴捷. 盐酸克林霉素胶囊溶出度测定方法研究[J]. 现代医药卫生, 2009, 25: 2607–2609. |
| [14] | 万蕾蕾, 钮晓勇, 宋萌. 牙周引导组织再生技术在牙周病治疗中的应用[J]. 口腔医学, 2006, 26: 73–74. |
| [15] | GENTILE P, CHIONO V, TONDA-TURO C, FERREIRA A M, CIARDELLI G. Polymeric membranes for guided bone regeneration[J]. Biotechnol J, 2011, 6: 1187–1197. DOI: 10.1002/biot.v6.10 |
| [16] | 艾合麦提·玉素甫, 陈统一, 陈中伟, 刘大鹏, 王振斌. 可降解聚己内酯修复骨缺损的实验研究[J]. 中国修复重建外科杂志, 2005, 19: 439–442. |
| [17] | SHIN S Y, PARK H N, KIM K H, LEE M H, CHOI Y S, PARK Y J, et al. Biological evaluation of chitosan nanofiber membrane for guided bone regeneration[J]. J Periodontol, 2005, 76: 1778–1784. DOI: 10.1902/jop.2005.76.10.1778 |
| [18] | 潘亚萍, 刘静波. 牙龈卟啉单胞菌研究进展[J]. 国际口腔医学杂志, 2011, 38: 125–127. |
| [19] | 张雄. 克林霉素治疗牙周炎的临床观察[J]. 广东牙病防治, 2004, 12: 290–291. |
| [20] | 唐明, 章锦才, 肖晓蓉, 朱珠, 刘豫蓉. 常用抗厌氧菌药物对牙龈卟啉单胞菌的体外抗菌活性研究[J]. 重庆医学, 2001, 30: 200–202. |
| [21] | 孙美丽, 班俊峰, 黄思玉, 吕竹芬. PLGA微球载药量和包封率的影响因素及控制[J]. 广东药学院学报, 2011, 27: 643–648. |
| [22] | PONTORIERO R, LINDHE J. Guided tissue regeneration in the treatment of degree Ⅲ furcation defects in maxillary molars[J]. J Clin Periodontol, 1995, 22: 810–812. DOI: 10.1111/cpe.1995.22.issue-10 |
| [23] | BRATTHALL G, SÖDERHOLM G, NEIDERUD A M, KULLENDORFF B, EDWARDSSON S, ATTSTRÖM R. Guided tissue regeneration in the treatment of human infrabony defects. Clinical, radiographical and microbiological results:a pilot study[J]. J Clin Periodontol, 1998, 25(11 Pt 1): 908–914. |
| [24] | AMAR S, CHUNG K M. Clinical implications of cellular biologic advances in periodontal regeneration[J]. Curr Opin Periodontol, 1994: 128–140. |
 2017, Vol. 38
2017, Vol. 38


