2. 重庆市南岸区妇幼保健院药剂科, 重庆 400060
2. Department of Pharmacy, Chongqing Nan'an Maternal and Child Health Care Hospital, Chongqing 400060, China
吴茱萸碱(evodiamine,EDA)是中药吴茱萸中的一种生物碱,对阿尔茨海默病、疼痛、肥胖、月经不调以及产后出血等症状有一定作用[1]。研究表明EDA具有广泛的抗癌活性,对结肠癌、乳腺癌、前列腺癌、宫颈癌和肺癌等都具有一定的疗效[2]。但EDA存在水溶性差、生物利用度低、代谢过快等缺点,使其临床应用受到限制[3]。磷脂复合物常作为中药活性成分的载体,可改善药物的溶解性、渗透性,提高药物的吸收、口服生物利用度,磷脂是组成生物膜的成分,在携带药物进入组织细胞时对细胞无毒性[4~5]。但磷脂复合物提高药物生物利用度的能力有限[6]。新型药物载体纳米乳具有较好的溶解性、缓释性、靶向性以及较高的生物利用度[7]。所以本实验将EDA和磷脂形成复合物后,进一步制成吴茱萸碱油包水型复合纳米乳(evodiamine complex water-in-oil nanoemulation,WECNE),希望结合两种药物载体的优势,进一步提高EDA的生物利用度。本文考察了WECNE在大鼠中的药代动力学行为和体肠吸收特征,为EDA在临床上的应用提供基础。
1 材料和仪器 1.1 主要仪器Agilent 1100液相色谱仪,美国Agilent公司;AB 204 S电子分析天平,瑞士Mettler Toledo仪器公司;HHS-4S 电子恒温不锈钢水浴锅,上海康路仪器设备有限公司;QL-901型旋涡混合器,其林贝尔仪器制造有限公司; TGL-16B台式高速离心机,上海安亭科学仪器厂;DF-101S集热式磁力搅拌器,予华仪器有限责任公司;HL-1恒流泵,上海青浦沪西仪器厂。
1.2 主要试剂EDA(纯度>99%),武汉远城科技发展有限公司;甲醇(色谱纯),美国新天地科技有限公司;Krebs-Ringer循环液,实验室自制(批号为20151102);实验用水,超纯水。
1.3 实验动物健康雄性SD大鼠,体质量210~250 g,由重庆医科大学实验动物中心提供,许可证号为SCXK(渝)2011-0001。
2 方法和结果 2.1 WECNE的制备称取磷脂和EDA(质量比25∶1)溶于乙醇中,搅拌3 h,挥干得复合物。取乙酸乙酯、聚氧乙烯蓖麻油和聚乙二醇,加入复合物,搅拌6 h,冷却后滴加纯化水,溶液澄清,即得到WECNE。取适量WECNE,用水稀释10倍,涡旋后测得其平均zeta电位为-8.16 mV。
2.2 药代动力学实验 2.2.1 色谱条件[8]色谱柱为大连伊利特 Lichrospher C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水(体积比70∶30);检测波长为225 nm,流速1 mL·min-1,柱温35℃;以和厚朴酚为内标,进样量为40 μL。
2.2.2 药代动力学实验步骤12只SD大鼠给药前禁食12 h,可饮水,分别单剂量灌EDA混悬液和WECNE (EDA质量浓度100 mg·kg-1)。给药后在预设的时间点(0.083、0.25、0.5、0.75、1、2、5、8、12、24、48、72 h)眼底取血,将血样品置于预先肝素化的离心管中,离心10 min。吸取血浆、和厚朴酚内标工作液(体积比15∶1)适量,涡旋后加入氨水,再次涡旋后加入乙醚,涡旋后静置,再涡旋,反复3次。再次涡旋后,吸取上清液于离心管中,挥干乙醚,加入甲醇,涡旋,离心,吸取上清液,在2.2.1 项色谱条件下检测药物含量。
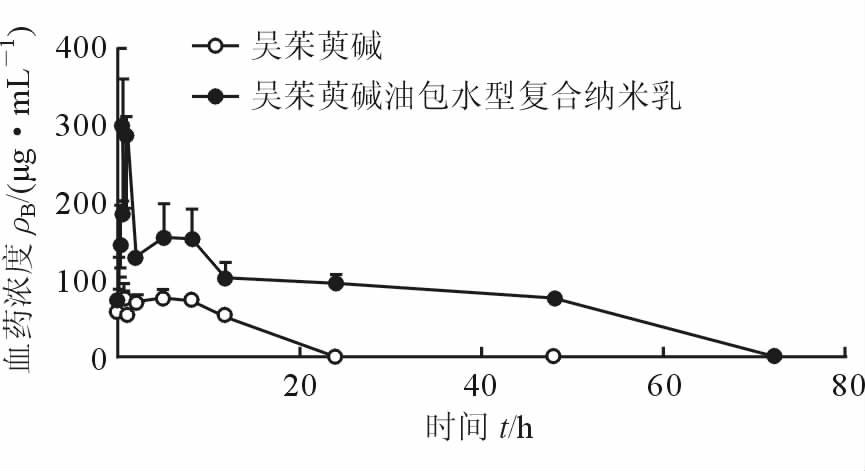
2.2.3 血药浓度-时间曲线的绘制以EDA的血药浓度作为纵坐标,取样时间点作为横坐标作图,得图 1。WECNE的曲线和EDA曲线相似,但其相同时间点对应的血药浓度大于EDA,且其最高血药浓度(Cmax)和药时曲线下面积(AUC)大于EDA,表明WECNE在体内的吸收比EDA好;WECNE的完全消除时间(72 h)是EDA(24 h)的3倍,说明WECNE比EDA消除慢,药物可长时间维持在较高血药浓度。
|
图 1 吴茱萸碱油包水型复合纳米乳和吴茱萸碱的血药浓度-时间曲线 n=6,x±s |
药动学数据用DAS 2.1.1软件进行拟合,WECNE和EDA非房室模型主要药动学参数见表 1。用拟合度、加权残差平方和赤池信息量准则判断两者的隔室模型,WECNE表现为二室模型,而EDA动力学行为符合单室模型,两者房室模型主要药动学参数见表 1。
|
|
表 1 吴茱萸碱油包水型复合纳米乳和吴茱萸碱药动学参数 |
由非房室模型参数可知,WECNE和EDA的AUC0-72 h比值约为6.30,说明将EDA制成WECNE后,生物利用度明显提高;WECNE与EDA的Cmax比值为3.71,表明WECNE能增加EDA的吸收,有利于EDA发挥药效;WECNE的平均滞留时间(MRT0-∞)为EDA的2.32倍,表明WECNE能延长EDA在体内的停留时间;WECNE的Tmax小于EDA,说明WECNE能加快EDA进入血液循环的速率。
由房室模型参数可知,WECNE和EDA的AUC0-72 h、t1/2比值分别约为6.30、2.32,说明EDA在体内的吸收增加,消除减慢。所以,无论是根据房室模型还是非房室模型分析,结果都表明WECNE可以增加EDA的生物利用度,延缓EDA的释放。
2.3 在体肠吸收实验 2.3.1 色谱条件[9]色谱柱为大连伊利特 Lichrospher C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水(体积比75∶25);检测波长225 nm,流速为1 mL·min-1,柱温为35℃;进样量20 μL。
2.3.2 在体肠吸收实验步骤SD大鼠给药前禁食18 h,可饮水,大鼠麻醉后固定。沿大鼠的腹中线打开腹腔,在胃幽门、贲门两侧各剪开一个小口,插管,将两端用线绳结扎。用人工胃液排除胃内容物后,分别灌入4 mL EDA质量浓度为100 μg·mL-1的EDA混悬液和WECNE,2 h后取出药液,冲洗胃内的剩余药液,用25 mL容量瓶定容。然后依次找到所需的各个肠段,幽门以下1 cm处为十二指肠段,幽门向下15 cm 处为空肠段,至盲肠上段20 cm处为回肠段,盲肠后段为结肠段,各肠段均取10 cm。在待测肠段的上端和下端插管结扎,将肠内容物排净,将空白Krebs-Ringer循环液以0.5 mL·min-1流速循环10 min后,换含药的循环液,灌流液进入肠段开始计时,调节流速为0.21 mL·min-1,灌流1 h后收集灌流液。将实验肠段用空白Krebs-Ringer液冲洗后合并灌流液,定容,-20℃条件下保存,在2.3.1项条件下检测EDA含量。实验结束后剪下不同的肠段,测定各个肠段的长度、内径,计算药物的吸收速率常数(Ka)和有效渗透系数(Peff)[10]。
由表 2知,WECNE的Ka在胃、十二指肠、空肠、回肠和结肠中与EDA的比值依次为1.52、2.85、3.79、3.99和3.61;其Peff在4个肠段中和EDA的比值依次为6.24、4.40、4.92、7.38。WECNE使EDA在胃部和各个肠段的吸收程度均提高,但在结肠中的Peff提高更明显,提示其对结肠有一定的靶向作用。
|
|
表 2 吴茱萸碱油包水型复合纳米乳和吴茱萸碱的吸收速率常数和有效渗透系数 |
3 讨 论
乳剂因具有靶向性、缓释性等优点而广泛应用于抗癌药物中,如鸦胆子油乳剂和环孢素口服微乳均已在国内上市。WECNE具有长效、靶向、高效等优点,可以考虑作为抗癌药物。EDA制备成为磷脂复合物后,生物利用度增加约2倍[4],但制备为WECNE后,口服药物的生物利用度提高到6倍以上,达到了实验预期的效果。因WECNE为油包水型纳米乳,在胃肠道中可能会出现二次乳化,可将WECNE以软胶囊形式给药,提高在胃肠道中的稳定性。
小肠被认为是口服药物的主要吸收部位[11],所以要提高EDA的生物利用度可通过增加其在小肠中的吸收速度和程度,减少其在体内的代谢和消除。WECNE使EDA生物利用度增加的原因可能为:(1)和EDA相比,WECNE可经多种方式透过生物膜屏障,增强了药物分子的透膜吸收程度,增加了药物的吸收[12]。(2)WECNE可增加药物的溶解,提高药物和胃肠道的接触时间和面积[7],使药物吸收增加。(3)EDA和磷脂形成复合物后,药物被包埋于磷脂中[13],提高了EDA的水溶性和脂溶性,使其亲水性、亲脂性在适合范围内,增加了药物的溶解和吸收,提高了生物利用度[4~5]。(4)WECNE中表面活性成分和磷脂将细胞膜中的脂质成分溶解,改变了细胞膜的渗透性,有利于药物的吸收。(5)药物包裹于磷脂或者纳米乳中,阻碍了酶促反应进行,减少了EDA的代谢和消除[14]。
| [1] | 张志仙, 蒋美玲, 王欣慧, 李云展, 龚国清. 吴茱萸碱的药理学研究进展[J]. 现代生物医学进展, 2014, 14: 4189–4195. |
| [2] | JIANG J, HU C. Evodiamine:a novel anti-cancer alkaloid from evodiamine rutaecarpa[J]. Molecules, 2009, 14: 1852–1859. DOI: 10.3390/molecules14051852 |
| [3] | SHYR M H, LIN L C, LIN T Y, TSAI T H. Determination and pharmacokinetics of evodiamine in the plasma and feces of conscious rats[J]. Anal Chim Acta, 2006, 558: 16–21. DOI: 10.1016/j.aca.2005.11.045 |
| [4] | TAN Q, LIU S, CHEN X, WU M, WANG H, YIN H, et al. Design and evaluation of a novel evodiamine-phospholipid complex for improved oral bioavailability[J]. AAPS Pharm Sci Tech, 2012, 13: 534–547. DOI: 10.1208/s12249-012-9772-9 |
| [5] | KHAN J, ALEXANDER A, AJAZUDDIN, SARAF S, SARAF S. Recent advances and future prospects of phyto-phospholipid complexation technique for improving pharmacokinetic profile of plant actives[J]. J Control Release, 2013, 168: 50–60. DOI: 10.1016/j.jconrel.2013.02.025 |
| [6] | 郝海军, 张红芹, 贾幼智, 韩茹, 王航. 采用制剂新技术提高中药磷脂复合物的溶出度和生物利用度研究进展[J]. 中草药, 2013, 44: 2474–2479. |
| [7] | 李艳萍, 张志荣. 纳米乳的研究进展及其应用[J]. 华西药学杂志, 2010, 25: 485–488. |
| [8] | 柳珊, 谭群友, 刘雨, 王红, 张景勍. 液液萃取高效液相色谱法测定纳米乳中吴茱萸碱的血浆浓度[J]. 中成药, 2012, 34: 472–476. |
| [9] | 柳珊, 谭群友, 廖红, 王红, 张景勍. 高效液相色谱法测定复方吴茱萸碱纳米乳的含量[J]. 中国医院药学杂志, 2012, 32: 244–246. |
| [10] | 孙全, 杨林, 陈学梁, 赵德璋, 张景勍. 溴吡斯的明纳米乳体外释放行为评价[J]. 中国医院药学杂志, 2015, 35: 132–135. |
| [11] | LUO Z, LIU Y, ZHAO B, TANG M, DONG H, ZHANG L, et al. Ex vivo and in situ approaches used to study intestinal absorption[J]. J Pharmacol Toxicol Methods, 2013, 68: 208–216. DOI: 10.1016/j.vascn.2013.06.001 |
| [12] | 袁媛, 孙亚楠, 鲁传华. 纳米药物的生物学特点及其机制研究概况[J]. 中国药理学通报, 2013, 29: 1180–1184. |
| [13] | SINDHUMOL P G, THOMAS M, MOHANACHANDRAN P S. Phytosomes:a novel dosage form for enhancement of bioavailability of botanicals and neutraceuticals[J]. Int J Pharm Pharm Sci, 2010, 2: 10–14. |
| [14] | SUN H Z, FANG Z Z, CAO Y F, SUN X Y, HONG M. Investigation of the in vitro metabolism of evodiamine:characterization of metabolites and involved cytochrome p450 isoforms[J]. Phytother Res, 2013, 27: 705–712. DOI: 10.1002/ptr.v27.5 |
 2017, Vol. 38
2017, Vol. 38


