2. 第二军医大学东方肝胆研究所信号转导实验室, 上海 200438
2. Signal Transduction Laboratory, Institute of Eastern Hepatobiliary, Second Military Medical University, Shanghai 200438, China
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)又称胆管细胞性肝癌,是起源于二级及以上肝内胆管上皮细胞的恶性肿瘤,占肝脏原发恶性肿瘤的5%~20%[1-2]。近30年来,全球ICC的发病率及死亡率有明显上升趋势[1-3]。尽管1年生存率有所改善,但5年生存率并没有显著性变化(仍低于5%)[3]。根治性外科切除仍是治愈ICC唯一有效的途径。由于多数患者在确诊时已处于肿瘤晚期,且由于切除后早期复发等诸多原因,造成ICC预后较差,这与肿瘤局部复发和远处转移发生率较高密切相关[4-5]。且ICC对放化疗不敏感,临床缺乏有效的辅助性治疗手段和早期特异性分子标记物[6]。因此需要寻找ICC新的特异性分子靶点,以期提高分子靶向治疗对ICC的治疗效果。
转录信号传导子及激活子3 (signal transducers and activators of transcription 3,STAT3)是一类表达于多种细胞和组织的癌基因,是JAK-STAT信号通路的重要组成部分,STAT3主要以磷酸化的方式被多种激酶活化[7],活化的STAT3介导多种细胞因子和生长因子信号向细胞核传递,参与调节相应靶基因的转录,从而参与调控细胞生存、增殖、血管生成等过程[4, 8]。多项研究证实STAT3活化与多发性骨髓瘤、胃癌、肝细胞性肝癌、肺癌、喉癌的预后密切相关[9-12]。然而,STAT3在ICC组织中的表达及其对ICC患者预后的意义仍不明确。在本研究中,我们检测了人ICC组织中STAT3的表达情况,并分析其与临床病理因素和ICC患者预后之间的关系。
1 资料和方法 1.1 研究对象选取2006年1月到2008年12月期间在第二军医大学东方肝胆外科医院接受肝切除联合肝十二指肠韧带淋巴结清扫术(R0切除)的ICC患者61例,所有患者均术后病理确诊。本研究的纳入条件为:患者在围手术期未行任何放化疗。生存期定义为手术之日至死亡或最后一次随访的时间间隔。无瘤生存期定义为手术之日至肿瘤复发的时间间隔。本研究通过东方肝胆外科医院伦理委员会批准,所有患者均签署知情同意书。
1.2 PCR检测ICC和癌旁组织STAT3 mRNA的表达采用TRIzol法提取细胞总RNA并定量。取总RNA 2 μg进行反转录获得cDNA,取2 μL cDNA进行PCR扩增。引物序列如下:GAPDH Forward 5′-CCC ATC ACC ATC TTC CAG GA-3′,Reverse 5′-TTG TCA TAC CAG GAA ATG AGC A-3′;STAT3 Forward 5′-CAT ATG CGG CCA GCA AAG AA-3′,Reverse 5′-ATA CCT GCT GAA GAA ACT-3′。PCR扩增条件为:95℃ 5 min;95℃ 30 s,95℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。反应后各取2 μL PCR产物进行1.5%琼脂糖凝胶电泳,采用2-ΔΔCt方法对目的片段与内参基因GAPDH的比值进行半定量分析。每组实验重复3次。
1.3 免疫组织化学分析对肿瘤组织进行H-E染色切片后,行组织芯片检查。对甲醛固定、石蜡包埋的标本进行免疫组织化学法检测。在免疫组织化学检查中,对切片行去石蜡化,在柠檬酸钠缓冲液中再次水和,从而恢复抗原活性。内源性过氧化物活性被0.3%过氧化氢灭活。在用10%正常羊血清阻断了所有非特异性反应后,将切片置于适量稀释后的STAT3小鼠抗人单克隆抗体(sc-8019,北京碧橙蓝生物科技有限责任公司)内4℃过夜,然后室温下标记二抗30 min。二氨基联苯胺作为色原体,切片行苏木精复染色,进行可视性分析。阴性对照组中以正常的鼠免疫球蛋白替代一抗。免疫组化结果由两位不知病史资料的病理科医生负责读片,标准统一共同判定,判定方法参考文献[13]。
1.4 预后因素为了评估影响外科切除术后患者远期生存率的因素,对17个临床变量与STAT3表达水平之间的关系进行单因素和多因素分析。
1.5 统计学处理采用SPSS 17.0软件对数据进行统计学分析。计量资料用x±s描述,两组间比较采用t检验。采用Pearson χ2检验和Fisher精确检验分析STAT3表达与其他临床病理参数之间的关系。采用Kaplan-Meier (KM)法估计和绘制生存曲线,采用log-rank检验进行组间生存曲线的比较。采用Cox危险度回归模型分析临床病理参数和STAT3表达对生存率的影响。检验水准(α)为0.05。
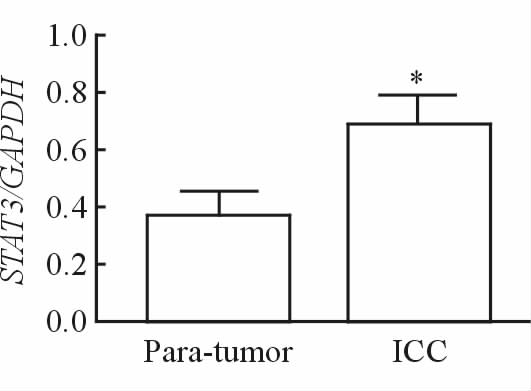
2 结 果 2.1 STAT3在ICC组织中呈高表达免疫组化结果显示,ICC和癌旁组织中STAT3的阳性表达率分别为72.1%(44/61)和18.0%(18/61),两者差异具有统计学意义(P<0.05)。PCR结果显示,ICC组织内STAT3 mRNA的表达高于癌旁组织,两组间差异有统计学意义(P<0.05,图 1)。提示STAT3在ICC组织中的表达升高。
|
图 1 ICC组织和癌旁组织内STAT3 mRNA的表达情况 Fig 1 The STAT3 mRNA levels in Para-tumor and ICC tissues Para-tumor: Peritumoral tissues; ICC: Intrahepatic cholangiocarcinoma; STAT3: Signal transducers and activators of transcription 3. *P<0.05 vs Para-tumor.n=61,x±s |
2.2 STAT3表达和预后的关系
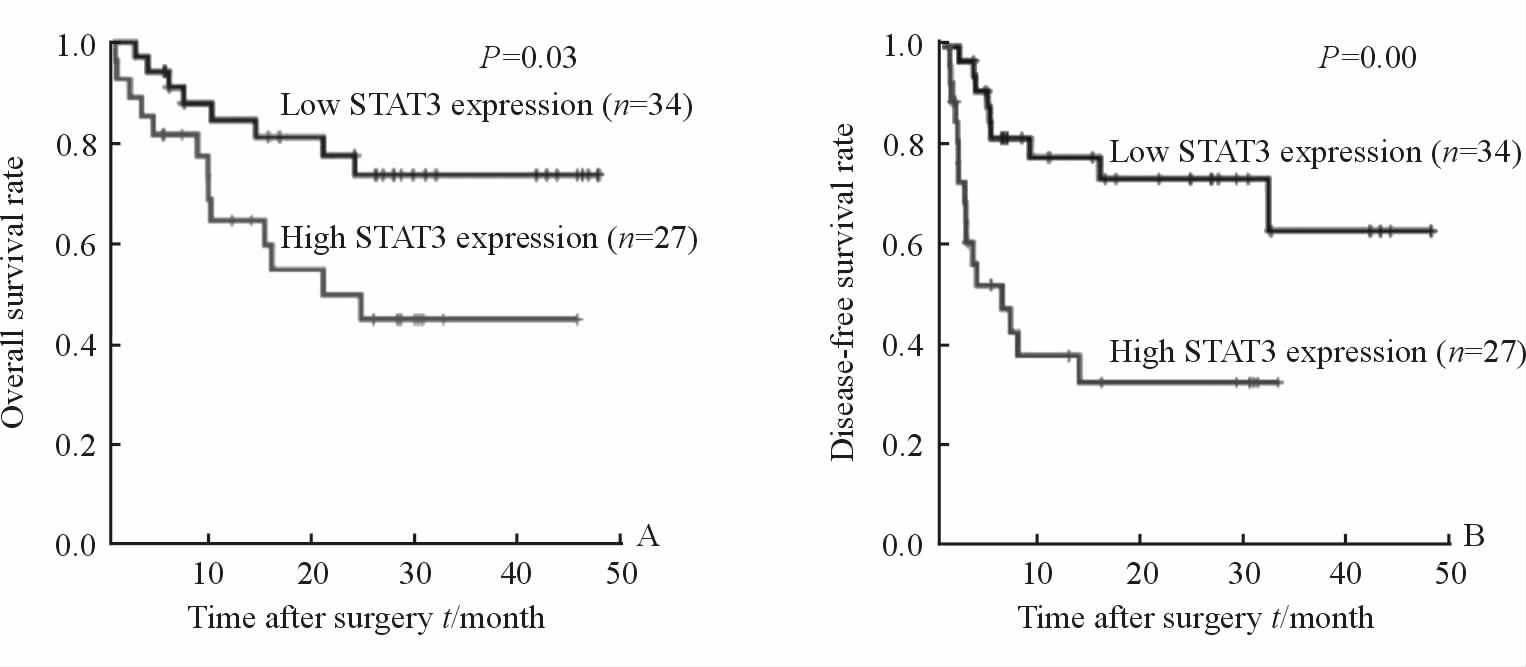
对ICC患者中与总体生存期和无瘤生存期相关的临床病理因素进行Cox回归模型单因素分析,结果显示肿瘤直径、病理性卫星灶、肝硬化和STAT3表达水平与总体生存期有关(表 1);进一步行多因素分析发现肿瘤直径和STAT3表达水平是总体生存期的独立影响因素,其HR(95%CI)分别是5.116(1.851-14.141)和0.391(0.163-0.939)。而血清白蛋白(ALB)、甲胎蛋白(AFP)、肿瘤直径、微血管侵犯和STAT3表达水平与肿瘤复发(无瘤生存期)有关(表 1);进一步行多因素分析发现ALB、肿瘤直径、微血管侵犯和STAT3表达水平是无瘤生存期的独立影响因素,其HR(95%CI)分别是0.223 (0.074-0.676)、4.300(1.724-10.742)、4.695(1.600-13.782)和6.711(2.687-16.758)。根据免疫组化结果筛选STAT3高表达(n=27)和低表达(n=34)的患者,分别评估其预后,结果显示STAT3高表达的ICC患者总体生存期和无瘤生存期均较短,预后更差(图 2)。
|
|
表 1 影响总体生存期和无瘤生存期的临床病理参数分析 Tab 1 Analysis of clinicopathological parameters influencing overall survival and disease-free survival of ICC patients |
|
图 2 不同STAT3表达水平患者的总体生存(A)和无瘤生存(B) 曲线 Fig 2 Effect of STAT3 expression on overall survival and disease-free survival in ICC patients ICC: Intrahepatic cholangiocarcinoma; STAT3: Signal transducers and activators of transcription 3 |
2.3 STAT3表达与临床病理参数之间的关系
分析肿瘤组织中STAT3的表达与ICC临床病理参数之间的关系,发现STAT3高表达与肿瘤体积大、病理性卫星灶、微血管侵犯、肿瘤分化差以及淋巴结转移相关(表 2)。为了进一步确认STAT3表达与ICC转移之间的关系,本研究检测了发生淋巴结转移的15例ICC患者原发病灶与淋巴结转移灶STAT3的表达,发现60%(9/15)的患者淋巴结转移灶中STAT3表达高于原发病灶,提示STAT3高表达与ICC淋巴结高转移之间可能存在一定的相关性。
|
|
表 2 STAT3的表达与ICC临床病理特征之间的关系 Tab 2 Correlation analysis of clinical parameters and STAT3 expression in ICC patients |
3 讨 论
STAT3表达在多项研究中被认为与肿瘤预后密切相关。Benekli等[14]对急性髓细胞型白血病的研究发现,STAT3高表达的患者无瘤生存期更短;Sheen-Chen等[15]运用组织芯片技术对102 例原发性乳腺癌患者的研究发现,STAT3表达水平与5 年生存率相关(P=0.024);Abou-Ghazal等[16]运用组织芯片技术对129 例不同病理类型的神经胶质瘤患者进行研究,证实多形性成胶质细胞瘤的p-STAT3表达和其中位生存时间相关。尽管在多项研究中被证实与预后相关,但是STAT3的表达和活化是否与ICC预后相关,目前尚未见文献报道。
在这项研究中,我们发现ICC组织中STAT3表达显著性升高。分析ICC组织中STAT3表达与临床病理参数之间的关系,发现STAT3表达与多项临床参数之间存在相关性,STAT3高表达与肿瘤的恶性程度较高之间存在相关性,其中包括肿瘤体积大、病理性卫星灶、微血管侵犯、肿瘤分化差以及淋巴结转移。而Cox回归模型分析也发现:肿瘤直径(肿瘤体积大)和STAT3表达水平是影响总体生存期的独立影响因素。这些均说明肿瘤体积大的患者ICC组织中STAT3高表达预示着这类患者的预后不佳,这2个高危因素之间存在一定的内在相关性,分别从临床和实验室指标两个方面反映了其与预后之间的关系。
本研究发现STAT3高表达与微血管侵犯和淋巴结转移之间存在相关性。微血管侵犯和淋巴结转移与ICC术后肿瘤复发密切相关,淋巴结转移是ICC患者预后不佳的显著性影响因素[17-18]。为了进一步明确高表达STAT3的ICC患者更易发生淋巴结转移,我们检测了有淋巴结转移的15例ICC患者的原发肿瘤病灶与淋巴结转移灶中STAT3的表达情况,发现60%(9/15)患者的淋巴结转移灶中STAT3表达比原发病灶更高,提示STAT3高表达预示着肿瘤恶性程度和淋巴结转移潜能更高,预后更差。
STAT3的表达与活化在机体内受到多种机制的调控,一些细胞因子和生长因子通过与特异性受体结合激活STAT3,参与病理生理过程。微环境中的间质细胞(如骨髓来源细胞、间质成纤维细胞、肌上皮细胞等)被证实能够通过释放IL-6、IL-1、TNF-α等活化上皮细胞内STAT3并调控其表达,进而影响上皮源性肿瘤的发生、发展,上皮细胞本身也能够通过自分泌细胞因子的形式影响自身及间质细胞内STAT3的表达和活化[19],这些反馈调节机制被认为是细胞外微环境对肿瘤实施影响的重要方式。通过抑制胞外细胞因子信号、抑制JAK激酶活性、调节特异性磷酸酶、激活蛋白抑制子PIAS直接抑制活化的STAT3 等方法均能够有效地调节STAT3的表达与活化[20-22]。关于胆管癌研究进展的综述文章中,也提出炎症类信号通路可激活炎症通路,导致细胞因子和STAT3的高表达,从而调节细胞的生长和存活并参与细胞癌变[23]。以上都提示炎症微环境与肿瘤发生之间存在密切的相关性,这一过程是否通过调控ICC细胞内STAT3 的表达与活化来完成,以及STAT3是否有可能成为ICC靶向治疗新的靶点,需要进一步探讨。
考虑到ICC的浸润特征和缺乏有效的辅助性治疗手段,根治性手术切除仍是其唯一有效的治愈方法。即使行根治性手术切除的患者仍有较高的术后复发率,总体生存期仍不尽人意。结合STAT3高表达与肝内胆管癌恶性程度和预后较差之间存在显著相关性,STAT3有望成为临床疾病分期的一种辅助性分子标记物,并且有可能成为一种新的治疗靶点。
| [1] | POULTSIDES G A, ZHU A X, CHOTI M A, PAWLIK T M. Intrahepatic cholangiocarcinoma[J]. Surg Clin North Am, 2010, 90: 817–837. DOI: 10.1016/j.suc.2010.04.011 |
| [2] | SHAIB Y H, DAVILA J A, MCGLYNN K, EL-SERAG H B. Rising incidence of intrahepatic cholangiocarcinoma in the United States:a true increase?[J]. J Hepatol, 2004, 40: 472–477. DOI: 10.1016/j.jhep.2003.11.030 |
| [3] | NATHAN H, PAWLIK T M, WOLFGANG C L, CHOTI M A, CAMERON J L, SCHULICK R D. Trends in survival after surgery for cholangiocarcinoma:a 30-year population-based SEER database analysis[J]. J Gastrointest Surg, 2007, 11: 1488–1496. DOI: 10.1007/s11605-007-0282-0 |
| [4] | WELZEL T M, GRAUBARD B I, EL-SERAG H B, SHAIB Y H, HSING A W, DAVILA J A, et al. Risk factors for intrahepatic and extrahepatic cholangiocarcinoma in the United States:a population-based case-control study[J]. Clin Gastroenterol Hepatol, 2007, 5: 1221–1228. DOI: 10.1016/j.cgh.2007.05.020 |
| [5] | NATHAN H, ALOIA T A, VAUTHEY J N, ABDALLA E K, ZHU A X, SCHULICK R D, et al. A proposed staging system for intrahepatic cholangiocarcinoma[J]. Ann Surg Oncol, 2009, 16: 14–22. DOI: 10.1245/s10434-008-0180-z |
| [6] | SIRICA A E. Cholangiocarcinoma:molecular targeting strategies for chemoprevention and therapy[J]. Hepatology, 2005, 41: 5–15. DOI: 10.1002/(ISSN)1527-3350 |
| [7] | JARNICKI A, PUTOCZKI T, ERNST M. Stat3:linking inflammation to epithelial cancer-more than a "gut" feeling?[J]. Cell Div, 2010, 5: 14. DOI: 10.1186/1747-1028-5-14 |
| [8] | YU H, PARDOLL D, JOVE R. STATs in cancer inflammation and immunity:a leading role for STAT3[J]. Nat Rev Cancer, 2009, 9: 798–809. DOI: 10.1038/nrc2734 |
| [9] | BHARTI A C, SHISHODIA S, REUBEN J M, WEBER D, ALEXANIAN R, RAJVADHAN S, et al. Nuclear factor-κB and STAT3 are constitutively active in CD138+ cells derived from multiple myeloma patients, and suppression of these transcription factors leads to apoptosis[J]. Blood, 2004, 103: 3175–3184. DOI: 10.1182/blood-2003-06-2151 |
| [10] | KANDA N, SENO H, KONDA Y, MARUSAWA H, KANAI M, NAKAJIMA T, et al. STAT3 is constitutively activated and supports cell survival in association with survivin expression in gastric cancer cells[J]. Oncogene, 2004, 23: 4921–4929. DOI: 10.1038/sj.onc.1207606 |
| [11] | HAURA E B, ZHENG Z, SONG L, CANTOR A, BEPLER G. Activated epidermal growth factor receptor-STAT-3 signaling promotes tumor survival in vivo in non-small cell lung cancer[J]. Clin Cancer Res, 2005, 11: 8288–8294. DOI: 10.1158/1078-0432.CCR-05-0827 |
| [12] | LIU B, REN Z, SHI Y, GUAN C, PAN Z, ZONG Z. Activation of signal transducers and activators of transcription 3 and overexpression of its target gene CyclinD1 in laryngeal carcinomas[J]. Laryngoscope, 2008, 118: 1976–1980. DOI: 10.1097/MLG.0b013e31817fd3fa |
| [13] | LANAYA H, NATARAJAN A, KOMPOSCH K, LI L, AMBERG N, CHEN L, et al. EGFR has a tumour-promoting role in liver macrophages during hepatocellular carcinoma formation[J]. Nat Cell Biol, 2014, 16: 972–981. DOI: 10.1038/ncb3031 |
| [14] | BENEKLI M, XIA Z, DONOHUE K A, FORD L A, PIXLEY L A, BAER M R, et al. Constitutive activity of signal transducer and activator of transcription 3 protein in acute myeloid leukemia blasts is associated with short disease-free survival[J]. Blood, 2002, 99: 252–257. DOI: 10.1182/blood.V99.1.252 |
| [15] | SHEEN-CHEN S M, HUANG C C, TANG R P, CHOU F F, ENG H L. Prognostic value of signal transducers and activators of transcription 3 in breast cancer[J]. Cancer Epidemiol Biomarkers Prev, 2008, 17: 2286–2290. DOI: 10.1158/1055-9965.EPI-08-0089 |
| [16] | ABOU-GHAZAL M, YANG D S, QIAO W, REINA-ORTIZ C, WEI J, KONG L Y, et al. The incidence, correlation with tumor-infiltrating inflammation, and prognosis of phosphorylated STAT3 expression in human gliomas[J]. Clin Cancer Res, 2008, 14: 8228–8235. DOI: 10.1158/1078-0432.CCR-08-1329 |
| [17] | OHTSUKA M, ITO H, KIMURA F, SHIMIZU H, TOGAWA A, YOSHIDOME H, et al. Results of surgical treatment for intrahepatic cholangiocarcinoma and clinicopathological factors influencing survival[J]. Br J Surg, 2002, 89: 1525–1531. DOI: 10.1046/j.1365-2168.2002.02268.x |
| [18] | NAKAGOHRI T, ASANO T, KINOSHITA H, KENMOCHI T, URASHIMA T, MIURA F, et al. Aggressive surgical resection for hilar-invasive and peripheral intrahepatic cholangiocarcinoma[J]. World J Surg, 2003, 27: 289–293. DOI: 10.1007/s00268-002-6696-7 |
| [19] | EREZ N, TRUITT M, OLSON P, HANAHAN D. Cancer-associated fibroblasts are activated in incipient neoplasia to orchestrate tumor-promoting inflammation in an NF-κB-dependent manner[J]. Cancer Cell, 2010, 17: 135–147. DOI: 10.1016/j.ccr.2009.12.041 |
| [20] | KREBS D L, HILTON D J. SOCS:physiological suppressors of cytokine signaling[J]. J Cell Sci, 2000, 113: 2813–2819. |
| [21] | SHUAI K, LIU B. Regulation of gene-activation pathways by PIAS proteins in the immune system[J]. Nat Rev Immunol, 2005, 5: 593–605. DOI: 10.1038/nri1667 |
| [22] | WOETMANN A, NIELSEN M, CHRISTENSEN S T, BROCKDORFF J, ALOFT K, ENGEL A M, et al. Inhibition of protein phosphates 2A induces serine/heroine phosphorylation, subcellular redistribution, and functional inhibition of STAT3[J]. Proc Natl Acad Sci USA, 1999, 96: 10620–10625. DOI: 10.1073/pnas.96.19.10620 |
| [23] | Razumilava N, Gores G J. Cholangiocarcinoma[J]. Lancet, 2014, 383: 2168–2179. DOI: 10.1016/S0140-6736(13)61903-0 |
 2017, Vol. 38
2017, Vol. 38


