自2002年国际蛛网膜下腔出血动脉瘤试验(intnational subarachnoid aneurysm trial,ISAT)结果发表以来,介入治疗相关研究得到了迅猛发展,随着介入材料的不断增多和技术的不断成熟,介入治疗在颅内动脉瘤治疗过程中的作用越来越不可忽视[1-4],众多研究表明介入治疗是安全、有效的[5-7]。然而,介入治疗过程中依旧存在一些不容忽视的并发症,对于颅内未破裂动脉瘤,术中并发症包括动脉瘤术中破裂(intra-procedural rupture,IPR; 典型病例见图 1,未发表数据)、支架内急性血栓形成等[8-10]。IPR虽然发生率较低,但其预后差,目前仍缺少IPR危险因素的研究[11-13]。本研究旨在分析可能导致IPR发生的危险因素,为临床降低IPR的发生率提供对策。
|
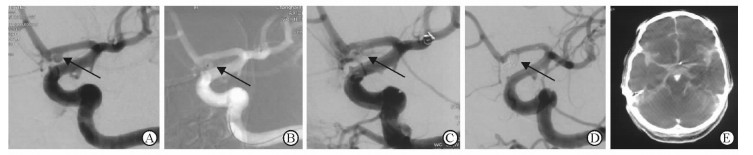
图 1 介入治疗颅内未破裂动脉瘤IPR患者的典型图像 Fig 1 Typical images of endovascular treatment of IPR in patients with unruptured intracranial aneurysm A 53-year female patient. A: Anterior communicating artery aneurysm (arrow) showed by angiography; B: Microcatheater in placement, arrow shows the tip of microcatheter; C: Intra-procedural rupture, and the contrast break out from the aneurysm body (arrow); D: Final outcome of rescued coiling (arrow); E: Immediate Dyna CT shows subarachnoid hemorrhage. IPR: Intra-procedural rupture |
1 资料和方法 1.1 临床资料
连续性收集2010年1月至2017年2月间于我院接受介入治疗的未破裂动脉瘤患者的临床资料,所有患者均经数字减影血管造影(DSA)证实为颅内未破裂动脉瘤。排除标准:(1)梭形、假性、外伤性、感染性动脉瘤;(2)合并硬脑膜动静脉瘘、脑动静脉畸形、烟雾病或恶性肿瘤;(3)1个月内有脑出血或蛛网膜下腔出血;(4)资料不完整。最终共1 232个动脉瘤介入程序纳入本研究。
1.2 纳入的危险因素IPR是指术中DSA显示造影剂外溢或术后即刻CT提示有蛛网膜下腔出血且伴有对应可以解释的症状。本研究纳入的IPR相关危险因素包括:(1)患者相关的危险因素,即年龄、性别、高血压史、糖尿病史、蛛网膜下腔出血病史、术前改良Rankin量表(mRS)评分、既往短暂性脑缺血发作(transient ischemic attack,TIA)或脑梗史、吸烟史、饮酒史、颅内血管狭窄、心血管疾病史(冠心病、心律不齐、心房颤动等);(2)动脉瘤相关的危险因素,即动脉瘤最大径、瘤颈、多发动脉瘤、动脉瘤位置、不规则形态、穿支丰富区域等;(3)介入治疗相关的危险因素,即治疗策略(单纯弹簧圈栓塞、球囊辅助栓塞、支架辅助弹簧圈栓塞、单纯支架植入以及其他方式)、支架应用、血流导向装置、重叠支架、一次手术治疗多个动脉瘤。
1.3 统计学处理采用SPSS 23.0软件进行数据分析。计数资料以率(百分比)表示,计量资料以x±s表示。计数资料的组间比较使用Fisher精确检验或Pearson χ2检验,计量资料的组间比较使用Student t检验。将单因素分析中P < 0.10的危险因素纳入logistic多因素分析(向后逐步法),进入标准为0.10,剔除标准为0.15。检验水准(α)为0.05。
2 结果 2.1 患者基线资料与单因素分析共纳入1 232个颅内未破裂动脉瘤程序,其中男性患者395例,女性患者837例。根据是否发生IPR将患者分为IPR组(n=11)与非IPR组(n=1 221),两组患者的平均年龄分别为(55.09±14.15)、(57.42±11.05)岁。单因素分析结果显示,患者相关的危险因素中仅心血管疾病史差异有统计学意义(P=0.025)。动脉瘤相关的危险因素中,动脉瘤位置(P=0.011)、不规则形态(P=0.001)与IPR相关;动脉瘤最大径按照连续性变量或分类变量分析显示可能与IPR相关(P < 0.10),但将动脉瘤最大径按照5 mm、7 mm分界转化为二分类资料后,发现其与IPR之间无关联(分别为P=0.439、0.188)。进一步对动脉瘤位置中位于前交通动脉、大脑中动脉行单因素分析后发现,前交通动脉瘤(P=0.009)与IPR的发生相关。介入治疗相关的危险因素中,支架应用与IPR的发生相关(P=0.016)。见表 1。
|
|
表 1 颅内未破裂动脉瘤患者的基线资料与IPR危险因素的单因素分析 Tab 1 Characteristics of patients with unruptured intracranial aneurysm and univariate analysis of IPR |
2.2 未破裂动脉瘤发生IPR的多因素分析
将单因素分析所得的5项P < 0.10的危险因素(心血管疾病史、动脉瘤最大径、前交通动脉瘤、不规则形态、支架应用)纳入多因素分析,结果(表 2)显示,心血管疾病史(OR=6.919,P=0.008)、不规则形态(OR=9.758,P < 0.001)、前交通动脉瘤(OR=4.648,P=0.024)是颅内未破裂动脉瘤发生IPR的独立危险因素,支架应用是颅内未破裂动脉瘤发生IPR的保护因素(OR=0.238,P=0.026)。
|
|
表 2 颅内未破裂动脉瘤IPR的多因素分析 Tab 2 Multivariate analysis of IPR in patients with unruptured intracranial aneurysms |
2.3 支架治疗未破裂动脉瘤的安全性分析
单因素分析结果(表 1)显示,未应用支架患者IPR的发生率高于应用支架患者,差异有统计学意义(P=0.016);多因素分析结果(表 2)也显示支架应用是IPR的保护因素(P=0.026,OR=0.238)。本研究中85.0%(1 047/1 232)的患者应用了支架治疗,其中IPR的发生率为0.6%(6/1 047),可认为支架治疗未破裂动脉瘤是安全的。
2.4 IPR患者的临床特点共11例患者发生了IPR,其中2例在超选过程中发生,6例于弹簧圈填塞过程中发生,3例于造影过程中即发生。导致IPR的原因如下:6例由弹簧圈引起、2例由微导管引起、1例由微导丝引起,另有2例患者的IPR病因无法确认,无1例是由于支架植入引起的。其中4例患者发生IPR后的即刻CT结果显示其Hunt-Hess评分为4~5分,经术中挽救性技术抢救后依然死亡;1例患者残留永久性功能障碍,其余6例预后均较好(mRS评分 < 2分)。患者的总体死亡率为0.3%(4/1 232)。
3 讨论随着影像学、介入学技术的不断发展,越来越多的无症状或轻微症状颅内未破裂动脉瘤可被检查发现。对于颅内未破裂动脉瘤,介入治疗已逐渐成为其主要治疗方式,该方法具有恢复时间短、安全性高的特点,但依旧存在一定比例的并发症,包括IPR、急性支架内血栓形成、血管痉挛等。IPR是一类发生率较低的并发症,但其往往导致较差的预后[14],因此,研究IPR发生的危险因素对于预防IPR具有重要的临床价值。
Zang等[12]收集了437例动脉瘤患者(137例未破裂动脉瘤和370例破裂动脉瘤),其中14例患者发生了IPR,他们发现IPR更可能发生在小动脉瘤中,死亡率高达21.4%。Fang等[15]进行了一项meta分析,共纳入了14项研究的1 552例采用血管内治疗的前交通动脉瘤,4%的患者发生了IPR。然而,很少有研究调查与IPR有关的危险因素,已发表的研究存在样本量少、资料中含有破裂动脉瘤数据、纳入危险因素不够、缺少动脉瘤形态学参数、大脑中动脉瘤数据不足等问题,无法为寻找未破裂动脉瘤发生IPR的危险因素提供充足的证据[8, 10-12, 16]。赵展等[17]报道了885例接受介入治疗的颅内未破裂动脉瘤,其中28例(3.2%)发生了IPR,结果显示高血压病史、动脉瘤大小(微小动脉瘤)、前交通动脉瘤、不规则形态、术中载瘤动脉痉挛与IPR的发生相关。另一项纳入了1 038例接受介入栓塞治疗的未破裂动脉瘤的研究显示,IPR的发生率为1.1%,填圈过程中发生的IPR预后一般较好,前交通动脉瘤更易发生IPR[18]。日本的一项研究纳入了1 375例患者共计1 406枚未破裂动脉瘤,结果显示,前交通动脉瘤及瘤体较小是IPR发生的危险因素,但该研究未纳入分析动脉瘤形态、动脉瘤位于大脑中动脉等危险因素[11]。
本研究通过回顾我院大样本未破裂动脉瘤数据库,纳入了较多的危险因素,单因素分析结果显示心血管疾病史(P=0.025)、前交通动脉瘤(P=0.009)、不规则形态(P=0.001)、支架应用(P=0.016)与IPR相关,多因素分析结果显示心血管疾病史(OR=6.919,P=0.008)、不规则形态(OR=9.758,P < 0.001)、前交通动脉瘤(OR=4.648,P=0.024)是颅内未破裂动脉瘤发生IPR的独立危险因素,支架应用(OR=0.238,P=0.026)是颅内未破裂动脉瘤发生IPR的保护因素。
既往研究发现,直径更小的动脉瘤是IPR的危险因素之一[11, 16]。日本学者研究发现瘤顶直径小于5 mm是动脉瘤发生IPR的显著预测因子[11]。Fan等[16]发现肿瘤最大径 < 3.5 mm可增加动脉瘤发生IPR的风险。分析其原因可能是动脉瘤最大径、体积越小,供操作者调整弹簧圈、微导管等栓塞系统的空间越小,导致IPR的发生风险提高。本研究将动脉瘤最大径按照连续性变量或分类变量分析,结果显示可能与IPR相关(P < 0.10),但进一步分别按照5 mm、7 mm分界转化为分类变量后,其与IPR之间均无关联(P>0.10)。可能的原因是既往文献中纳入的变量为瘤顶直径,而本研究纳入的变量为动脉瘤最大径,纳入的变量不完全相同,从而导致结果有差异。本研究发现不规则形态(OR=9.081,P < 0.001)也是IPR发生的重要危险因素,形态不规则或伴有子囊被广泛认为是动脉瘤形成和生长过程中破裂的预测因素,并与破裂状态有关[19]。形态不规则导致动脉瘤更容易在自然病程中破裂[20]。但是,其潜在机制仍需进一步的研究探讨。
支架治疗在未破裂动脉瘤尤其是宽颈动脉瘤中的应用越来越广泛,且被证明是相对安全、有效的[21-22],然而,既往研究报道尚未对支架应用与IPR的相关性进行分析。本研究中1 047例(85.0%)患者接受了支架治疗,且应用支架的患者较未应用支架患者的IPR发生率更低(0.6% vs 2.7%,P=0.016),分析其原因可能是支架应用可以降低介入手术的难度,使术者更从容完成手术,特别是对于宽颈动脉瘤的栓塞。11例IPR患者中无支架植入原因引起的,证明了支架应用的安全性。
综上所述,目前导致颅内未破裂动脉瘤介入治疗中IPR发生的危险因素包括心血管疾病史、高血压病史、不规则形态、前交通动脉瘤、微小动脉瘤、瘤顶较小等,而保护因素有支架应用。IPR是一种较罕见的术中并发症,致残、致死率高,严重影响患者预后,及时的挽救性治疗是改善预后的关键。
| [1] | 张隆辉, 高天, 张士永, 汪晶, 白志峰, 周明月. 颅内未破动脉瘤的研究进展[J]. 介入放射学杂志, 2016, 25: 829–833. DOI: 10.3969/j.issn.1008-794X.2016.09.021 |
| [2] | THOMPSON B G, BROWN R D Jr, AMIN-HANJANI S, BRODERICK J P, COCKROFT K M, CONNOLLY E S Jr, et al. Guidelines for the management of patients with unruptured intracranial aneurysms:a guideline for healthcare professionals from the american heart association/american stroke association[J]. Stroke, 2015, 46: 2368–2400. DOI: 10.1161/STR.0000000000000070 |
| [3] | MOLYNEUX A, KERR R, STRATTON I, SANDERCOCK P, CLARKE M, SHRIMPTON J, et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J]. Lancet, 2002, 360: 1267–1274. DOI: 10.1016/S0140-6736(02)11314-6 |
| [4] | MOLYNEUX A J, KERR R S, YU L M, CLARKE M, SNEADE M, YARNOLD J A, et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion[J]. Lancet, 2005, 366: 809–817. DOI: 10.1016/S0140-6736(05)67214-5 |
| [5] | HIGASHIDA R T, LAHUE B J, TORBEY M T, HOPKINS L N, LEIP E, HANLEY D F. Treatment of unruptured intracranial aneurysms:a nationwide assessment of effectiveness[J]. AJNR Am J Neuroradiol, 2007, 28: 146–151. |
| [6] | IM S H, HAN M H, KWON O K, KWON B J, KIM S H, KIM J E, et al. Endovascular coil embolization of 435 small asymptomatic unruptured intracranial aneurysms:procedural morbidity and patient outcome[J]. AJNR Am J Neuroradiol, 2009, 30: 79–84. DOI: 10.3174/ajnr.A1551 |
| [7] | OISHI H, YAMAMOTO M, SHIMIZU T, YOSHIDA K, ARAI H. Endovascular therapy of 500 small asymptomatic unruptured intracranial aneurysms[J]. AJNR Am J Neuroradiol, 2012, 33: 958–964. DOI: 10.3174/ajnr.A2858 |
| [8] | ZHENG Y, LIU Y, LENG B, XU F, TIAN Y. Periprocedural complications associated with endovascular treatment of intracranial aneurysms in 1764 cases[J]. J Neurointerv Surg, 2016, 8: 152–157. DOI: 10.1136/neurintsurg-2014-011459 |
| [9] | DELGADO ALMANDOZ J E, KAYAN Y, TENREIRO A, WALLACE A N, SCHOLZ J M, FEASE J L, et al. Clinical and angiographic outcomes in patients with intracranial aneurysms treated with the pipeline embolization device:intra-procedural technical difficulties, major morbidity, and neurological mortality decrease significantly with increased operator experience in device deployment and patient management[J]. Neuroradiology, 2017, 59: 1291–1299. DOI: 10.1007/s00234-017-1930-z |
| [10] | VAN ROOIJ W J, SLUZEWSKI M, BEUTE G N, NIJSSEN P C. Procedural complications of coiling of ruptured intracranial aneurysms:incidence and risk factors in a consecutive series of 681 patients[J]. AJNR Am J Neuroradiol, 2006, 27: 1498–1501. |
| [11] | KAWABATA S, IMAMURA H, ADACHI H, TANI S, TOKUNAGA S, FUNATSU T, et al. Risk factors for and outcomes of intraprocedural rupture during endovascular treatment of unruptured intracranial aneurysms[J/OL]. J Neurointerv Surg, 2017. pii:neurintsurg-2017-013156. doi:10.1136/neurintsurg-2017-013156.[Epubaheadofprint] |
| [12] | ZANG P, LIANG C, SHI Q, WANG Y. Intraprocedural cerebral aneurysm rupture during endovascular coiling[J]. Neurol India, 2011, 59: 369–372. DOI: 10.4103/0028-3886.82736 |
| [13] | DOERFLER A, WANKE I, EGELHOF T, DIETRICH U, ASGARI S, STOLKE D, et al. Aneurysmal rupture during embolization with guglielmi detachable coils:causes, management, and outcome[J]. AJNR Am J Neuroradiol, 2001, 22: 1825–1832. |
| [14] | CHO S H, DENEWER M, PARK W, AHN J S, KWUN B D, LEE D, et al. Intraprocedural rupture of unruptured cerebral aneurysms during coil embolization:a single center experience[J]. World Neurosurg, 2017, 105: 177–183. DOI: 10.1016/j.wneu.2017.05.147 |
| [15] | FANG S, BRINJIKJI W, MURAD M H, KALLMES D F, CLOFT H J, LANZINO G. Endovascular treatment of anterior communicating artery aneurysms:a systematic review and meta-analysis[J]. AJNR Am J Neuroradiol, 2014, 35: 943–947. DOI: 10.3174/ajnr.A3802 |
| [16] | FAN L, LIN B, XU T, XIA N, SHAO X, TAN X, et al. Predicting intraprocedural rupture and thrombus formation during coiling of ruptured anterior communicating artery aneurysms[J]. J Neurointerv Surg, 2017, 9: 370–375. DOI: 10.1136/neurintsurg-2016-012335 |
| [17] | 赵展, 舒航, 卓礼霞, 贺龙双, 张威, 殷利明, 等. 颅内破裂动脉瘤介入术中再破裂的因素及防治[J]. 广东医学, 2015, 36: 1069–1072. |
| [18] | LEE K M, JO K I, JEON P, KIM K H, KIM J S, HONG S C. Predictor and prognosis of procedural rupture during coil embolization for unruptured intracranial aneurysm[J]. J Korean Neurosurg Soc, 2016, 59: 6–10. DOI: 10.3340/jkns.2016.59.1.6 |
| [19] | KLEINLOOG R, DE MUL N, VERWEIJ B H, POST J A, RINKEL G J E, RUIGROK Y M. Risk factors for intracranial aneurysm rupture:a systematic review[J/OL]. Neurosurgery, 2017. doi:10.1093/neuros/nyx238.[Epubaheadofprint] |
| [20] | MORITA A. [Natural history of unruptured cerebral aneurysms][J]. Brain Nerve, 2008, 60: 1383–1389. |
| [21] | FRONTERA J A, MOATTI J, DE LOS REYES K M, MCCULLOUGH S, MOYLE H, BEDERSON JB, et al. Safety and cost of stent-assisted coiling of unruptured intracranial aneurysms compared with coiling or clipping[J]. J Neurointerv Surg, 2014, 6: 65–71. DOI: 10.1136/neurintsurg-2012-010544 |
| [22] | HETTS S W, TURK A, ENGLISH J D, DOWD C F, MOCCO J, PRESTIGIACOMO C, et al. Stent-assisted coiling versus coiling alone in unruptured intracranial aneurysms in the matrix and platinum science trial:safety, efficacy, and mid-term outcomes[J]. AJNR Am J Neuroradiol, 2014, 35: 698–705. DOI: 10.3174/ajnr.A3755 |
 2017, Vol. 38
2017, Vol. 38


