2. 第二军医大学基础医学部组织胚胎学教研室, 上海 200433
2. Department of Histology and Embryology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
男性不育是全球性的生殖健康难题,由少弱精子症引起的男性不育逐渐受到越来越多的关注[1-2]。少弱精子症的发病机制多种多样,其中常见原因有精液液化异常、精索静脉曲张、吸烟、饮酒以及自身免疫因素等[3-4]。精子的发生主要在生精小管中进行,其大部分微环境因素只能通过精浆成分来体现[5]。精浆不仅是精子运输和存活的媒介,其还包括如免疫球蛋白、炎性趋化因子、细胞因子等许多关键调节因子。有文献报道,精子的发生过程与多种细胞因子的分泌和作用有关[5]。因此精液中细胞因子的种类和表达水平可能可以直接反映精子发生微环境的改变,具有重要的研究价值[6]。本研究通过蛋白质芯片技术筛选出并分析精浆中胎盘生长因子(placental growth factor,PlGF)的含量,探讨PlGF在精浆中的表达水平及其与精子质量的相关性,为临床诊断和治疗少弱精子症及无精子症提供参考。
1 材料和方法 1.1 研究资料收集2014年9月至11月于第二军医大学长海医院生殖医学中心行精液检测的88例患者的病例资料,排除明显血精症、菌精症、畸精子症等患者。根据精液检测结果将患者分为3组:精液正常组、少弱精子症组和无精子症组。所有患者的精液样本均由患者禁性生活5 d后手淫法1 h内射精所得。待精液液化后,严格按照《世界卫生组织(WHO)人类精液检查与处理实验室手册》(第5版)的精子正常与少弱精子症的2个参数[精子浓度(×106/mL)和精子活力(%)]标准分析精子质量,且至少分析3次。本研究通过第二军医大学长海医院伦理委员会审核批准,患者均自愿参加本次研究并签署知情同意书。
1.2 蛋白质芯片分析随机挑选出5例精液正常者和5例少弱精子症者精浆样本进行蛋白质芯片分析。统计结果并进行Student t检验分析,筛选出精液正常组和少弱精子症组组间比较变化倍数最为显著的细胞因子,然后对其进一步验证和分析。
1.3 ELISA法检测精浆中PlGF的含量将收集的精液4 ℃ 1 500×g离心15 min,收集上清液。利用ELISA法检测精浆中PlGF的含量。ELISA检测委托上海西唐生物科技有限公司进行,所用试剂盒为PlGF ELISA试剂-96T-3000进口分装。
1.4 统计学处理采用SPSS 21.0软件进行数据分析。呈正态分布的计量资料以x±s表示,两组间比较采用Student t检验,3组间比较采用单因素方差分析。少弱精子症者精浆中PlGF含量与精子浓度、活力和患者年龄之间的相关性分析采用Pearson相关性分析。检验水准(α)为0.05。
2 结果 2.1 3组患者精液参数的比较共88例患者纳入本研究,其中精液正常组10例,年龄27~40岁,平均年龄(32.3±4.0)岁;少弱精子症组68例,年龄24~44岁,平均年龄(30.9±4.7)岁;无精子症组10例,年龄23~35岁,平均年龄(31.3±5.0)岁;3组患者年龄差异无统计学意义(F=0.746, P>0.05)。少弱精子症组患者的精子浓度、前向运动(A级和B级)精子率与精液正常组相比差异均无统计学意义(P均>0.05),无精子症组精液检测未查到精子。
|
|
表 1 3组患者精液参数的比较 |
2.2 蛋白质芯片筛选差异表达的细胞因子
使用蛋白质芯片分析技术检测5例精液正常者和5例少弱精子症者的精浆样本。结果(图 1)显示,精液正常组和少弱精子症组患者精浆的PlGF表达水平组间比较变化倍数最为显著,平均值比值为0.80,差异有统计学意义(t=0.022,P < 0.05)。
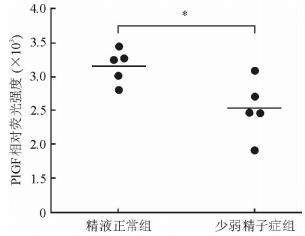
|
图 1 蛋白质芯片技术分析精液正常者和少弱精子症患者精浆中的胎盘生长因子(PlGF) Student t检验.*P < 0.05. n=5 |
2.3 ELISA法检测精浆中PlGF的含量
采用ELISA试剂盒检测所有入组患者精浆中PlGF的含量,结果(图 2)显示,精液正常组患者精浆PlGF含量高于少弱精子症组(t=1.828, P < 0.05)和无精子症组(t=2.369, P < 0.05)。
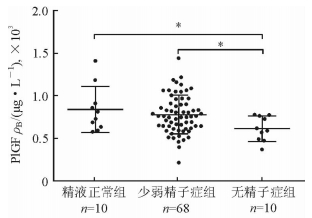
|
图 2 ELISA法检测不同精浆样本中胎盘生长因子(PlGF)的表达水平 Student t检验.*P < 0.05 |
2.4 精浆中PlGF含量与精子质量参数的相关性分析
由图 3所示,少弱精子症者精浆中PlGF含量与精子浓度呈中度相关(r=0.362,P < 0.05),与精子活力(A级+B级)呈弱相关(r=0.253,P < 0.05),与患者年龄无明显相关性。
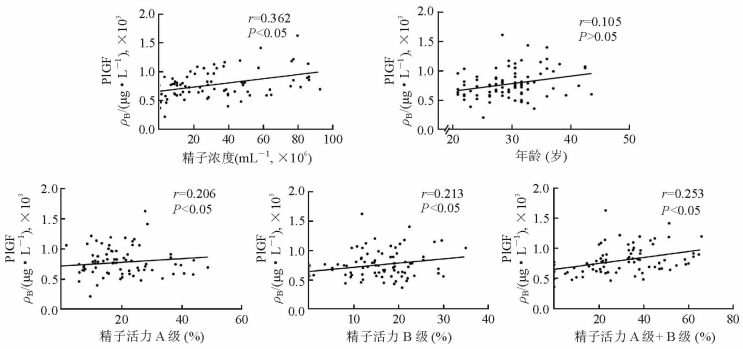
|
图 3 精浆中胎盘生长因子(PlGF)表达水平与临床精子质量参数相关性分析 Pearson相关性分析.n=68 |
3 讨论
精浆细胞因子主要由睾丸间质细胞分泌,影响睾丸内细胞的发育和成熟,直接或间接影响精子的发生及功能。研究发现,精子的发生过程与多种细胞因子有关,如不育症患者精浆中白介素(IL)-2、IL-6、肿瘤坏死因子α(TNF-α)水平均与精子活力呈负相关[7-10]。本研究运用蛋白质芯片技术检测发现少弱精子症患者精浆中PlGF含量减少,因此进一步验证其与精子浓度、活力和患者年龄的相关性,以期为少弱精子症及无精子症患者的临床诊断和治疗提供参考。
PlGF是一种分泌型同型二聚体糖蛋白,属于血管内皮生长因子(vascular endothelial growth factor,VEGF)家族。PlGF最初在人类胎盘中被发现,且在体内分布广泛[11],是多效的细胞因子,具有刺激血管形成和刺激内皮细胞生长、迁移等功能,同时其还可以促进白细胞浸润、肿瘤生长、基质细胞迁移、缺血组织血管再通等[12],其作用机制主要是和VEGF特异性受体结合后被磷酸化,然后通过酪氨酸蛋白激酶激活途径将信号传入细胞质进而发挥效应[13]。PlGF表达水平降低后可导致胎盘功能不全,从而影响正常妊娠过程,因此已被用于评估胎盘功能,以及预测和监测胎盘功能不全引起的子痫前期[14]。
本研究发现,精液正常组患者精浆中PlGF的含量高于少弱精子症组和无精子症组,且在精子发生过程中,精浆中PlGF含量与精子浓度呈中度相关,与精子活力(A级和B级)呈弱相关,表明PlGF可能通过促进精子发生的数量,即影响精浆中的精子浓度来影响精子质量,但其机制是否也与VEGF特异性受体相关仍需进一步证实。
| [1] | NYBOE ANDERSEN A, CARLSEN E, LOFT A. Trends in the use of intracytoplasmatic sperm injection marked variability between countries[J]. Hum Reprod Update, 2008, 14: 593–604. DOI: 10.1093/humupd/dmn032 |
| [2] | SKAKKEBAEK N E, RAJPERT-DE MEYTS E, BUCK LOUIS G M, TOPPARI J, ANDERSSON A M, EISENBERG M L, et al. Male reproductive disorders and fertility trends:influences of environment and genetic susceptibility[J]. Physiol Rev, 2016, 96: 55–97. |
| [3] | PIZZOL D, BERTOLDO A, FORESTA C. Male infertility:biomolecular aspects[J]. Biomol Concepts, 2014, 5: 449–456. |
| [4] | GASKINS A J, MENDIOLA J, AFEICHE M, JORGENSEN N, SWAN S H, CHAVARRO J E. Physical activity and television watching in relation to semen quality in young men[J]. Br J Sports Med, 2015, 49: 265–270. DOI: 10.1136/bjsports-2012-091644 |
| [5] | MARTINETS P, PROVERBIO F, CAMEJO M I. Sperm lipid peroxdation and pro-inflammatory cytokines[J]. Asian J Androl, 2007, 9: 102–107. DOI: 10.1111/ajan.2007.9.issue-1 |
| [6] | OLIVEIRA P F, ALVES M G, RATO L, LAURENTINO S, SILVA J, SÁ R, et al. Effect of insulin deprivation on metabolism and metabolism-associated gene transcript levels of in vitro cultured human Sertoli cells[J]. Biochim Biophys Acta, 2012, 1820: 84–89. DOI: 10.1016/j.bbagen.2011.11.006 |
| [7] | HEDGER M P, MEINHARDT A. Cytokines and the immune-testicular axis[J]. J Reprod Immunol, 2003, 58: 1–26. DOI: 10.1016/S0165-0378(02)00060-8 |
| [8] | LAFLAMME J, AKOUM A, LECLERC P. Induction of human sperm capacitation and protein tyrosine phosphorylation by endometrial cells and interleukin-6[J]. Mol Hum Reprod, 2005, 11: 141–150. DOI: 10.1093/molehr/gah142 |
| [9] | FURUYA Y, AKASHI T, FUSE H. Soluble Fas and interleukin-6 and interleukin-8 levels in seminal plasma of infertile men[J]. Arch Androl, 2003, 49: 449–452. DOI: 10.1080/01485010390219926 |
| [10] | LI M W, XIA W, MRUK D D, WANG C Q, YAN H H, SIU M K, et al. Tumor necrosis factor α reversibly disrupts the blood-testis barrier and impairs Sertoli-germ cell adhesion in the seminiferous epithelium of adult rat testes[J]. J Endocrinol, 2006, 190: 313–329. DOI: 10.1677/joe.1.06781 |
| [11] | IYER S, LEONIDAS D D, SWAMINATHAN G J, MAGLIONE D, BATTISTI M, TUCCI M, el al. The crystal structure of human placenta growth factor-1(PlGF-1), an angiogenic protein, at 2.0 A resolution[J]. J Biol Chem, 2001, 276: 12153–12161. DOI: 10.1074/jbc.M008055200 |
| [12] | YANG W, AHN H, HINRICHS M, TORRY R J, TORRY D S. Evidence of a novel isoform of placental growth factor (PlGF-4) expressed in human trophoblast and endothelial cells[J]. J Reprod Irnrnunol, 2003, 60: 53–60. |
| [13] | DE FALCO S. The discovery of placenta growth factor and its biological activity[J]. Exp Mol Med, 2012, 44: 1–9. DOI: 10.3858/emm.2012.44.1.025 |
| [14] | FISCHER C, JONCKX B, MAZZONE M, ZACCHIGNA S, LORGES S, PATTARINI L, et al. Anti-PlGF inhibits growth of VEGF(R)-inhibitor-resistant tumors without affecting healthy vessels[J]. Cell, 2007, 131: 463–475. DOI: 10.1016/j.cell.2007.08.038 |
 2017, Vol. 38
2017, Vol. 38


