2. 火箭军总医院普外科, 北京 100088
2. Department of General Surgery, General Hospital of Rocket Force of PLA, Beijing 100088, China
脑胶质瘤是常见的中枢神经系统肿瘤,恶性程度高。近年来,关于胶质瘤发生、发展及治疗的研究较多,并取得了一定的成果。但其治疗临床上仍主要采用手术、放射治疗、化学治疗等综合治疗,复发率高。目前发现原发性和复发性胶质瘤均伴有原癌基因激活和抑癌基因突变或缺失,且相关基因的突变不仅参与了肿瘤的发生、发展,还可能参与了肿瘤化学治疗耐药性的发生。在脑胶质瘤的治疗过程中,化学治疗耐药现象较为普遍,但具体机制目前尚不清楚。
基因芯片技术是通过与一组已知序列的核酸探针杂交进行核酸序列测定的方法。本课题组前期通过基因芯片技术在不同生存期的胶质母细胞瘤患者中筛选出表达差异的基因,应用生物信息学技术深入分析,发现了29个化学治疗敏感性相关基因,CCND1基因即为其中之一[1]。CCND1基因的主要功能是调节细胞周期从G1期向S期过渡,其表达产物细胞周期蛋白D1(Cyclin D1)水平异常会影响细胞周期,并与多种肿瘤的化学治疗耐药性相关[2]。人胶质瘤细胞中存在CCND1基因表达异常,且其表达产物Cyclin D1水平与星形胶质细胞瘤的恶性程度密切相关[3-4]。研究显示,Cyclin D1过表达可以增加人纤维肉瘤HT1080细胞对甲氨蝶呤(methotrexate,MTX)的耐药性[5];而在人胰腺癌BxPC3细胞中其表达异常能够促进肿瘤细胞增殖、干扰化学治疗药物诱导的凋亡,最终导致肿瘤细胞对化学治疗药物耐受[6]。另一方面,CCND1表达沉默可以通过抑制耐药基因的表达、促进肿瘤细胞凋亡等增加肿瘤细胞对米托蒽醌、依托泊苷(VP16)、5-氟尿嘧啶(5-fluorouracil,5-FU)和顺铂等化学治疗药物的敏感性[7-10]。可见CCND1基因表达水平异常与多种肿瘤化学治疗耐药相关,但CCND1基因表达异常与脑胶质瘤化学治疗敏感性之间的关系少有研究。本研究拟检测CCND1表达沉默对胶质母细胞瘤细胞株SHG-44和U251化学治疗敏感性的影响,筛选与CCND1表达沉默具有协同作用的化学治疗药物,为后期深入研究CCND1表达沉默与化学治疗药物敏感性的关系提供依据。
1 材料和方法 1.1 细胞及试剂自中国科学院上海细胞库购买人源性胶质母细胞瘤细胞株SHG-44及U251,于含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的DMEM培养液,5% CO2、37 ℃、饱和湿度的条件下培养。小鼠抗Bcl-2单克隆抗体(sc-130307)、兔抗β-actin多克隆抗体(sc-130656)、小鼠抗P-糖蛋白(P-gp)单克隆抗体(sc-59593)和羊抗Caspase-3多克隆抗体(sc-1225)均购自美国Santa Cruz公司。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide,MTT]、卡莫司汀(carmustine,BCNU)、洛莫司汀(lomustine,CCNU)和替莫唑胺(remozolomide,TMZ)均购自美国Sigma公司。
1.2 CCND1表达沉默或过表达根据本课题组前期CCND1表达沉默和过表达研究方法[11-12],采用慢病毒载体系统(LVTHM载体,美国Invitrogen公司)构建Lenti-shRNA、Lenti-CCND1和Lenti-GFP表达载体。
1.3 蛋白质印迹法收集亲代SHG-44细胞、对照组(Lenti-GFP)、CCND1过表达组(Lenti-CCND1)和CCND1表达沉默组(Lenti-shRNA)对数生长期细胞,根据文献[3]方法提取蛋白并定量、电泳、转膜、封闭、标记一抗和二抗、洗膜、显色、扫膜。一抗包括抗Bcl-2一抗(1:1 000稀释)、抗β-actin一抗(1:1 000稀释)、抗P-gp一抗(1:1 000稀释)和抗Caspase-3一抗(1:1 000稀释)。
1.4 MTT实验采用0.25%胰酶消化生长良好的SHG-44细胞,配制单细胞悬液,调细胞密度为2×104/mL,然后取180 μL细胞悬液接种至96孔板,每株细胞设3个实验孔。于37 ℃、5% CO2、饱和湿度条件下培养24 h,然后3孔分别加入20 μL BCNU、CCNU、TMZ继续培养。设置药物浓度为BCNU 0.05、0.25 μg/mL,CCNU 20、80 μg/mL及TMZ 9.1 μg/mL。各组每个条件均设3个复孔。细胞培养48 h后,每天取1块96孔板行MTT实验:(1)弃去培养液,每孔加入20 μL 5 mg/mL MTT溶液和180 μL新鲜培养液,混匀;(2)37 ℃、5% CO2条件下培养4 h;(3)弃去反应液,每孔添加150 μL二甲基亚砜(dimethyl sulfoxide,DMSO);(4)振荡10 min使反应液溶解混匀;(5)使用酶标仪读取570 nm处的光密度(D)值,连续检测5 d,绘制细胞生长曲线。
1.5 统计学处理数据分析采用SPSS 19.0软件。呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析。检验水准(α)为0.05。
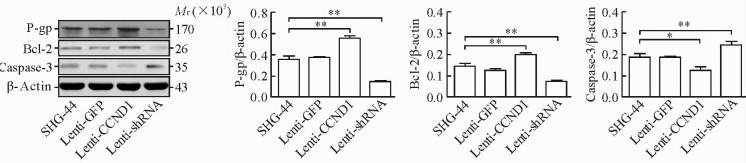
2 结果 2.1 CCND1表达沉默及过表达对P-gp、Bcl-2和Caspase-3的影响与亲代SHG-44细胞和对照组细胞相比,CCND1过表达组细胞多药耐药1(multidrug resistance 1,MDR1)基因表达产物P-gp和凋亡因子Bcl-2的表达水平均增高,Caspase-3的表达水平降低,差异均有统计学意义(P < 0.05,P < 0.01);而CCND1表达沉默组细胞P-gp和Bcl-2表达水平均降低,Caspase-3表达升高,差异均有统计学意义(P均 < 0.01)。见图 1。
|
图 1 CCND1表达沉默和过表达对MDR1基因表达产物P-gp和Bcl-2、Caspase-3蛋白质表达的影响 Fig 1 Effects of CCND1 silencing and overexpression on MDR1 gene expression product P-gp and Bcl-2, Caspase-3 protein expressions MDR1: Multidrug resistance 1; P-gp: P-glycoprotein; Bcl-2: B-cell lymphoma-2. *P < 0.05, **P < 0.01. n=3, x±s |
2.2 化学治疗药物对CCND1表达沉默的SHG-44细胞生长曲线的影响
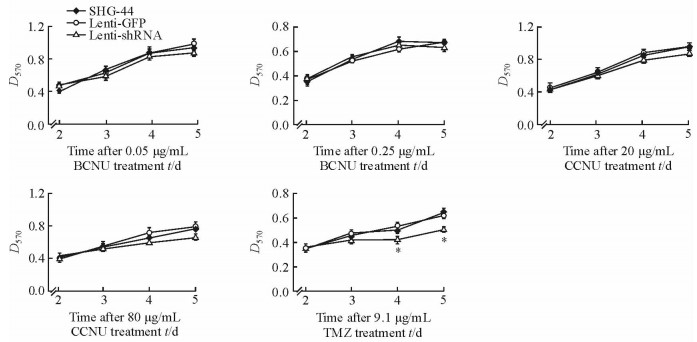
由图 2可见,各浓度BCNU、CCNU处理SHG-44细胞的第2、3、4、5天,CCND1表达沉默组、对照组细胞及亲代SHG-44细胞的生长曲线差异均无统计学意义(P均>0.05)。而9.1 μg/mL TMZ处理细胞的第4、5天,CCND1表达沉默组SHG-44细胞的生长被抑制,与对照组细胞和亲代SHG-44细胞相比差异均有统计学意义(P均 < 0.05)。结果表明CCND1表达沉默可能与TMZ对SHG-44细胞的生长有协同抑制作用,而BCNU、CCNU则无此协同作用。
|
图 2 BCNU、CCNU和TMZ对CCND1表达沉默的SHG-44细胞生长曲线的影响 Fig 2 Effects of BCNU, CCNU and TMZ on growth curves of CCND1-silenced SHG-44 cells BCNU: Carmustine; CCNU: Lomustine; TMZ: Temozolomide.*P < 0.05 vs SHG-44 and Lenti-GFP groups at the same time point. n=3, x±s |
2.3 CCND1表达沉默促进U251细胞对TMZ的治疗敏感性
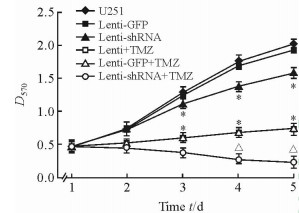
为进一步明确CCND1表达沉默在其他胶质母细胞瘤细胞株中能否促进TMZ的治疗敏感性,本研究以U251细胞IC50浓度(9.1 μg/mL)的TMZ处理CCND1表达沉默组、对照组和亲代人胶质母瘤细胞株U251细胞,并绘制细胞生长曲线。结果(图 3)显示,CCND1表达沉默联合TMZ共同作用较CCND1表达沉默或TMZ单独作用能更有效地抑制U251细胞的增殖,差异均有统计学意义(P均 < 0.05)。
|
图 3 CCND1表达沉默促进U251细胞对TMZ的治疗敏感性 Fig 3 CCND1 silencing promotes chemosensitivity of U251 cell lines to TMZ TMZ: Temozolomide. *P < 0.05 vs U251 and Lenti-GFP groups at the same time point; △P < 0.05 vs Lenti-shRNA and TMZ groups at the same time point. n=3, x±s |
3 讨论
为深入研究CCND1表达水平异常与脑胶质瘤化学治疗敏感性之间的关系,本研究构建了CCND1表达沉默和过表达胶质母细胞瘤细胞株模型。蛋白质印迹法检测结果发现CCND1表达沉默可以下调MDR1表达产物P-gp的表达,而CCND1过表达则上调P-gp的表达。表明CCND1表达水平异常可能参与胶质母细胞瘤细胞株化学治疗耐药的相关机制。由于不同化学治疗药物作用的分子机制不同,本研究选用脑胶质瘤治疗中常用的3种化学治疗药物,筛选可与CCND1表达沉默协同促进肿瘤细胞化学治疗敏感性的药物。
通过MTT实验并绘制细胞生长曲线发现,在不同浓度BCNU和CCNU的作用下,SHG-44亲代细胞株与CCND1沉默表达细胞株的生长无明显差别。而与上述BCNU、CCNU不同,TMZ则能有效抑制SHG-44细胞的增殖。
为进一步研究在其他胶质母细胞瘤细胞株中,CCND1表达沉默能否促进TMZ化学治疗的敏感性,本研究以U251细胞株IC50浓度的TMZ处理CCND1过表达或表达沉默的U251细胞,并绘制细胞生长曲线,结果表明CCND1表达沉默联合TMZ作用比CCND1表达沉默或者TMZ单独对U251细胞增殖的抑制作用更加明显。
综上所述,CCND1表达沉默可以促进胶质母细胞瘤对TMZ的化学治疗敏感性。其可能机制:(1)通过调节P-gp的表达水平促进肿瘤细胞对TMZ的化学治疗敏感性。研究表明TMZ是P-gp的作用底物之一[13]。CCND1表达沉默使SHG-44细胞中P-gp的表达下调,从而增加了细胞内TMZ的有效浓度,加强了TMZ对肿瘤细胞的杀伤作用。(2)通过调节凋亡因子的表达水平促进肿瘤细胞对TMZ的化学治疗敏感性。CCND1表达沉默通过下调Bcl-2、上调Caspase-3表达水平促进肿瘤细胞凋亡。此外,TMZ也能够通过调控Bcl-2和Caspase-3等的表达水平诱导肿瘤细胞凋亡[14-16]。因此,CCND1表达沉默可能通过改变Bcl-2、Caspase-3等的表达水平促进肿瘤细胞对TMZ的化学治疗敏感性。
| [1] | ZHAO Z, LIU Y, HE H, CHEN X, CHEN J, LU Y C. Candidate genes influencing sensitivity and resistance of human glioblastoma to Semustine[J]. Brain Res Bull, 2011, 86(3/4): 189–194. |
| [2] | MOTOKURA T, BLOOM T, KIM H G, JÜPPNER H, RUDERMAN J V, KRONENBERG H M, et al. A novel cyclin encoded by a bcl1-linked candidate oncogene[J]. Nature, 1991, 350: 512–515. DOI: 10.1038/350512a0 |
| [3] | LIU X, WANG F, LIN T, WANG T, ZHANG W, LI B, et al. MicroRNA-520b affects the proliferation of human glioblastoma cells by directly targeting cyclin D1[J]. Tumour Biol, 2016, 37: 7921–7928. DOI: 10.1007/s13277-015-4666-6 |
| [4] | ZHANG K, PANG B, XIN T, HOU X, JIA J, FENG B, et al. Increased signal transducer and activator of transcription 3(STAT3) and decreased cyclin D1 in recurrent astrocytic tumours compared with paired primary astrocytic tumours[J]. J Int Med Res, 2011, 39: 2103–2109. DOI: 10.1177/147323001103900606 |
| [5] | YOON D K, JEONG C H, JUN H O, CHUN K H, CHA J H, SEO J H, et al. AKAP12 induces apoptotic cell death in human fibrosarcoma cells by regulating CDKI-cyclin D1 and caspase-3 activity[J]. Cancer Lett, 2007, 254: 111–118. DOI: 10.1016/j.canlet.2007.02.017 |
| [6] | DEHARVENGT S J, GUNN J R, PICKETT S B, KORC M. Intratumoral delivery of shRNA targeting cyclin D1 attenuates pancreatic cancer growth[J]. Cancer Gene Ther, 2010, 17: 325–333. DOI: 10.1038/cgt.2009.75 |
| [7] | YUAN C, ZHU X, HAN Y, SONG C, LIU C, LU S, et al. Elevated HOXA1 expression correlates with accelerated tumor cell proliferation and poor prognosis in gastric cancer partly via cyclin D1[J/OL]. J Exp Clin Cancer Res, 2016, 35:15. doi:10.1186/s13046-016-0294-2. |
| [8] | MENG Y, ZHANG C, ZHOU X. Association between the Cyclin D1 G870A polymorphism and the susceptibility to and prognosis of upper aerodigestive tract squamous cell carcinomas:an updated meta-analysis[J]. Onco Targets Ther, 2016, 9: 367–376. |
| [9] | GUO L, LIU S, JAKULIN A, YILAMU D, WANG B, YAN J. Positive expression of cyclin D1 is an indicator for the evaluation of the prognosis of breast cancer[J]. Int J Clin Exp Med, 2015, 8: 18656–18664. |
| [10] | QIE S, DIEHL J A. Cyclin D1, cancer progression, and opportunities in cancer treatment[J]. J Mol Med (Berl), 2016, 94: 1313–1326. DOI: 10.1007/s00109-016-1475-3 |
| [11] | WANG J, WANG Q, CUI Y, LIU Z Y, ZHAO W, WANG C L, et al. Knockdown of cyclin D1 inhibits proliferation, induces apoptosis, and attenuates the invasive capacity of human glioblastoma cells[J]. J Neurooncol, 2012, 106: 473–484. DOI: 10.1007/s11060-011-0692-4 |
| [12] | 崔勇, 陈静, 王君玉, 王麒, 胡国汉, 骆纯, 等. AKT2基因短发夹结构RNA慢病毒载体的构建及鉴定[J]. 现代生物医学进展, 2011, 11: 1413–1416. |
| [13] | ALBRECHT C, HOSINER S, TICHY B, ALDRIAN S, HAJDU S, NÜRNBERGER S. Comparison of lentiviral packaging mixes and producer cell lines for RNAi applications[J]. Mol Biotechnol, 2015, 57: 499–505. DOI: 10.1007/s12033-015-9843-8 |
| [14] | SCHAICH M, KESTEL L, PFIRRMANN M, ROBEL K, ILLMER T, KRAMER M, et al. A MDR1 (ABCB1) gene single nucleotide polymorphism predicts outcome of temozolomide treatment in glioblastoma patients[J]. Ann Oncol, 2009, 20: 175–181. DOI: 10.1093/annonc/mdn548 |
| [15] | OCHS K, KAINA B. Apoptosis induced by DNA damage O6-methylguanine is Bcl-2 and caspase-9/3 regulated and Fas/caspase-8 independent[J]. Cancer Res, 2000, 60: 5815–5824. |
| [16] | ROOS W P, BATISTA L F, NAUMANN S C, WICK W, WELLER M, MENCK C F, et al. Apoptosis in malignant glioma cells triggered by the temozolomide-induced DNA lesion O6-methylguanine[J]. Oncogene, 2007, 26: 186–197. DOI: 10.1038/sj.onc.1209785 |
 2017, Vol. 38
2017, Vol. 38


