牙髓根尖周病是一种常见的口腔细菌感染性疾病。根管治疗是牙髓根尖周病的最佳治疗方法,旨在清除细菌、控制感染、促进根尖病变的愈合[1-2]。由于根管系统本身的复杂性、根管预备和冲洗的局限性,以及人为技术等因素导致感染的细菌无法有效彻底清除,从而影响了根管治疗的成功率[3]。有研究显示根管治疗的失败率约为2%~14%[4]。粪肠球菌在失败病例中呈现高检出率,Rocas等[5]研究发现在根管治疗失败病例中粪肠球菌的检出率高达77%。粪肠球菌在感染根管中不易被机械、物理和化学等方法彻底清除,因此寻找一种有效针对粪肠球菌的根管消毒方法成为近年来的研究热点。本实验通过建立离体人牙粪肠球菌感染根管模型,观察新型三重抗生素(奥硝唑、米诺环素和环丙沙星)单独及联合氢氧化钙应用对粪肠球菌的抗菌效果,为临床应用新型根管抗菌药物以提高根管再治疗成功率提供一定的理论及实验依据。
1 材料和方法 1.1 材料与仪器米诺环素(惠氏制药有限公司),甲硝唑、奥硝唑[华东医药(西安)博华制药有限责任公司],环丙沙星(江苏润邦药业有限公司),氢氧化钙(上海二医张江生物材料有限公司),脑心浸液(BHI)/脑心浸液琼脂(BHIA)培养基(青岛海博生物技术有限公司),粪肠球菌ATCC29212(广东环凯微生物科技有限公司),S-3400N扫描电子显微镜(日本日立公司)。
1.2 实验对象门诊收集因正畸原因拔除的单根管前磨牙81颗,要求牙根发育完全,牙根表面无裂纹,无牙髓治疗史。去除牙根表面软组织及牙结石,将81颗离体牙浸泡于0.9%生理盐水中,于4 ℃保存。
1.3 粪肠球菌感染根管模型[6]的建立用金刚砂车针去除牙冠,拔髓,截取牙根长度为12 mm,手用镍钛扩大针逐号扩至F3,17%乙二胺四乙酸(EDTA)和5.25%次氯酸钠溶液交替冲洗根管。将样本牙置于盛有5 mL BHI肉汤的试管中,于121 ℃高温高压灭菌20 min,以灭菌完全。用BHI液体培养基溶解粪肠球菌冻干菌粉进行细菌复苏,对细菌进行革兰染色后在显微镜下观察并鉴定。采用麦氏比浊法用BHI液体培养基配成0.5 Mc细菌悬液(1.5×108 CFU/mL)备用。将所有已消毒灭菌的样本牙置于37 ℃、5% CO2、95% N2条件下培养28 d,每隔1 d更换1次BHI液体培养基,建立粪肠球菌感染根管模型。28 d后,随机取1个样本牙纵向劈开牙根,置于2.5%戊二醛固定液中4 ℃固定48 h,然后进行梯度脱水、干燥、离子溅射仪喷金,扫描电子显微镜下观察粪肠球菌在根管内的定植情况。
1.4 分组封药将剩余80颗成功建立感染根管模型的样本牙分别置于2个48孔板中,每个孔板40颗,用蜡将牙根固定,分别用于观察封药后第3天和第7天的效果。每个孔板中根据封入药物分为5组:生理盐水组(NS组)、氢氧化钙组(CH组)、传统三重抗生素组(甲硝唑、米诺环素和环丙沙星,TAP组)、新型三重抗生素组(奥硝唑、米诺环素和环丙沙星,NTAP组)和新型三重抗生素联合氢氧化钙组(NTAP+CH组)。每组8颗样本牙。取新型三重抗生素糊剂(奥硝唑、米诺环素和环丙沙星等比例混合,加入无菌生理盐水配成浓度为1 000 mg/mL的糊剂[7])、传统三重抗生素糊剂(甲硝唑、米诺环素和环丙沙星,配比同新型三重抗生素糊剂)、氢氧化钙(与无菌生理盐水等比例调成糊剂,pH=10)、新型三重抗生素联合氢氧化钙(新型三重抗生素和氢氧化钙等比例混合)分别封入各实验组样本牙的根管内,NS组牙根管内封入等量生理盐水。用同等长度的无菌纸捻置于根管内取细菌样本,置于无菌生理盐水中,以10倍梯度稀释后在BHIA上培养24 h,进行细菌菌落计数。同时每小组中随机选取1个样本牙进行扫描电镜观察。
1.5 统计学处理应用SPSS 12.0软件进行数据分析,计量资料用x±s表示[细菌菌落数取lg(CFU/mL)],组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 粪肠球菌感染根管模型成功建立37 ℃ BHI液体培养基孵育28 d后,扫描电镜下可见根管内大量粪肠球菌定植在根管壁和牙本质小管内(图 1),提示粪肠球菌感染根管模型成功建立。
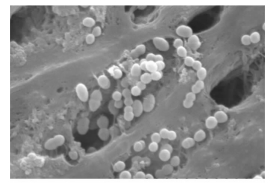
|
图 1 培养28 d后粪肠球菌在根管内的定植情况 Original magnification: ×5 000 |
2.2 细菌菌落数及扫描电镜结果
根管封药后第3、7天,4个实验组的细菌菌落数与NS组相比均减少(P<0.05),NTAP+CH组、NTAP组的细菌菌落数较CH组和TAP组减少(P<0.05)。根管封药后的第3天,NTAP+CH组的细菌菌落数少于NTAP组(P<0.05);而在根管封药后第7天,两组间差异无统计学意义(P>0.05)。4个实验组根管封药后第7天的细菌菌落数均较第3天降低(P<0.05)。表明4种药物对粪肠球菌均有一定的抗菌活性。见表 1。
|
|
表 1 根管封药后第3、7天各组细菌菌落数的比较 |
扫描电镜下(图 2)可见,在根管封药后的第3、7天,NTAP+CH组和NTAP组根管壁上粪肠球菌的菌落数较其余3组减少,TAP组、CH组根管壁上粪肠球菌的菌落数较NS组减少,NS组根管壁上可见大量粪肠球菌附着。
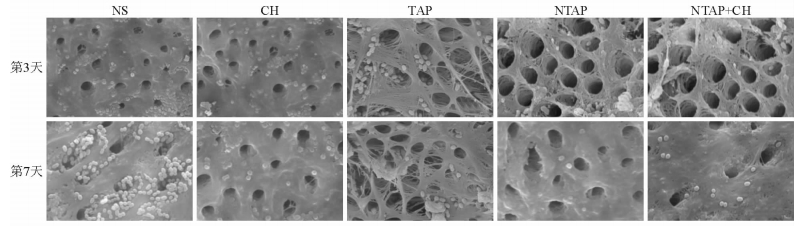
|
图 2 不同药物作用后各组扫描电镜结果 NS:生理盐水; CH:氢氧化钙; TAP:传统三重抗生素(甲硝唑、米诺环素和环丙沙星); NTAP:新型三重抗生素(奥硝唑、米诺环素和环丙沙星); NTAP+CH:新型三重抗生素联合氢氧化钙.Original magnification: ×3 000 |
3 讨论
根管内多种微生物混合感染是导致牙髓根尖周病最主要的原因之一。在未经治疗的感染根管中,主要是以专性厌氧菌为主的多种细菌混合感染;而在根管治疗失败和顽固性难治性根尖周炎的根管中,细菌感染主要是以兼性厌氧菌和专性厌氧菌为主[1-3]。其中粪肠球菌在根管治疗失败的根管中检出率较高,它可在根管中单独存在,也可以和其他细菌混合感染,在难治性根尖周炎的发生、发展过程中起着重要作用[3, 8]。由于粪肠球菌在持续性根尖周感染中的可能致病作用,许多实验研究通过建立粪肠球菌离体牙感染根管模型来评价根管消毒药物的作用[6, 9-10]。本研究将离体人恒牙放置于粪肠球菌BHI液体培养基中37 ℃培养28 d,成功建立了粪肠球菌感染根管模型。粪肠球菌是肠球菌属的一种,是人体上呼吸道、肠道的常居正常菌群,为条件致病菌。在经过严密充填的根管内,粪肠球菌处在缺乏营养的恶劣环境中,一度处于饥饿状态,少数粪肠球菌存活下来保持活的非可培养状态(variable but non culturable,VBNC),一旦有营养供应则复苏,恢复其致病性[11]。有研究发现粪肠球菌有2个重要的细胞膜机制使其内部的pH值保持在一个正常水平,从而能在牙本质小管中长时间生存[12]。在粪肠球菌感染根管中,其形成的生物膜有着重要的致病作用,不仅能增强粪肠球菌对外界刺激的抵抗力,并且能通过释放一系列毒力因子来增强其毒力。研究发现根尖来源的血清有助于牙本质小管内粪肠球菌生物膜的形成[13]。因此,粪肠球菌能在长期饥饿状态下保持生存能力,形成生物膜,并能释放各种毒力因子,致使粪肠球菌能在根管治疗完成的根管中存活,并具有较强的致病性。
如何有效清除根管内感染微生物、控制感染并防止再感染一直是根管治疗的重点和难点。根管治疗是临床上治疗牙髓根尖周病的最有效和最常用的方法,主要通过机械预备、化学冲洗根管清除根管内感染的牙髓组织、细菌及其产物等,再进一步进行药物消毒,最后严密充填防止再感染。虽然在经过根管机械预备和冲洗后感染细菌的数量已经明显减少,但是仍有细菌及毒素残留于根管内。根管消毒可进一步控制残留的微生物和毒素,其中根管内封药是最为常用的消毒方法。目前根管消毒药物主要有氢氧化钙、氯己定、酚醛类制剂、抗生素和各种中药制剂等,它们有各自的作用特点,但也有一定的局限性[14-15]。由于粪肠球菌在持续性牙髓根尖周感染和根管治疗失败中的致病作用逐渐受到重视,目前针对粪肠球菌的抗菌药物研究越来越多,寻找合适的有效针对粪肠球菌的根管消毒药物对于提高根管治疗成功率至关重要[6, 9, 16]。
氢氧化钙是目前根管治疗中应用最广泛的消毒药物,本实验应用氢氧化钙作为阳性对照。传统的三重抗生素由甲硝唑、米诺环素和环丙沙星组成,可以有效地用于根管消毒和促进年轻恒牙根尖周的愈合[17]。奥硝唑作为第3代硝基咪唑类药物,具有很强的渗透性,可以深入渗透根管系统,促进渗出物的吸收,保持根管长期的无菌状态;且同剂量的奥硝唑较甲硝唑抗菌效果更强[6, 9-10]。本实验采用奥硝唑替代传统三重抗生素中的甲硝唑,形成新型三重抗生素方案。在此三重抗生素组分中,奥硝唑具有对厌氧菌和原核生物的广谱杀菌作用,其作用较甲硝唑强,且不良反应小;米诺环素抗菌谱与四环素类似;环丙沙星可以抑制细菌的DNA旋转酶,促进成纤维细胞的形成[18-19];这3种药物联合使用能提高其抗菌效果。氢氧化钙单独使用不能完全发挥其抗菌效能,和其他药物配伍使用后常常能发挥更好的抗菌消炎作用,但目前氢氧化钙与三重抗生素联合使用尚未见报道,因此本实验使用氢氧化钙与新型三重抗生素联合应用作用于粪肠球菌,观察其抗菌效果。
本实验采用常用的琼脂培养细菌计数方法来评价消毒药物的作用效果。实验结果表明在封药后第3、7天,新型三重抗生素单独或联合应用氢氧化钙的抗菌效果均优于氢氧化钙和传统三重抗生素。氢氧化钙主要靠其释放的羟基离子来达到抗菌的效果;它不仅能破坏细菌细胞质膜和蛋白质结构,而且能水解细菌脂多糖脂质,改变内毒素的生物学特性,阻碍细胞膜传输机制[20-21]。但由于氢氧化钙溶解度和扩散率均较低,牙本质具有缓冲能力,使pH值很难保持,且粪肠球菌的质子泵特性能够抵抗氢氧化钙的高pH值,因此氢氧化钙对粪肠球菌的抗菌效果较差[12]。Madhubala等[6]研究发现传统三重抗生素和蜂胶对粪肠球菌的抗菌效果明显强于氢氧化钙,这与本实验结果相似。奥硝唑与甲硝唑同为硝基咪唑类药物,前者作用较后者强,本研究结果也表明,奥硝唑替代甲硝唑后,三重抗生素的抗菌效果明显提高。此外,本实验发现,在根管封药后第3天新型三重抗生素联合氢氧化钙的抗菌效果强于新型三重抗生素,而在根管封药后第7天两组差异无统计学意义。分析其原因可能是新型三重抗生素与氢氧化钙联合使用同时具备了两者的作用机制,对粪肠球菌的作用较单独应用新型三重抗生素更迅速;而随着时间延长,氢氧化钙的羟基离子减少,其作用降低,此时发挥作用的主要是新型三重抗生素。
综上所述,新型三重抗生素单独应用或联合氢氧化钙应用对粪肠球菌的抗菌效果均优于传统三重抗生素和氢氧化钙,为根管再治疗的根管消毒提供了一定的理论及实验依据,未来我们将进一步研究新型三重抗生素联合氢氧化钙用于根管治疗失败病例的临床疗效。
| [1] | SIQUEIRA J F Jr. Endodontic infections:concepts, paradigms, and perspectives[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2002, 94: 281–293. DOI: 10.1067/moe.2002.126163 |
| [2] | ZHANG C, DU J, PENG Z. Correlation between Enterococcus faecalis and persistent intraradicular infection compared with primary intraradicular infection:a systematic review[J]. J Endod, 2015, 41: 1207–1213. DOI: 10.1016/j.joen.2015.04.008 |
| [3] | SIQUEIRA J F Jr, ROÇAS I N. Polymerase chain reaction-based analysis of microorganisms associated with failed endodontic treatment[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2004, 97: 85–94. DOI: 10.1016/S1079-2104(03)00353-6 |
| [4] | SONG M, KIM H C, LEE W, KIM E. Analysis of the cause of failure in nonsurgical endodontic treatment by microscopic inspection during endodontic microsurgery[J]. J Endod, 2011, 37: 1516–1519. DOI: 10.1016/j.joen.2011.06.032 |
| [5] | ROCAS I N, LEE C Y, JUNG I Y. Polymerase chain reaction identification of microorganisms in previously root-filled teeth in a South Korean population[J]. J Endod, 2004, 30: 504–508. DOI: 10.1097/00004770-200407000-00011 |
| [6] | MADHUBALA M M, SRINIVASAN N, AHAMED S. Comparative evaluation of propolis and triantibiotic mixture as an intracanal medicament against Enterococcus faecalis[J]. J Endod, 2011, 37: 1287–1289. DOI: 10.1016/j.joen.2011.05.028 |
| [7] | DIOGENES A R, RUPAREL N B, TEIXEIRA F B, HARGREAVES K M. Translational science in disinfection for regenerative endodontics[J]. J Endod, 2014, 40: 52–57. DOI: 10.1016/j.joen.2014.01.015 |
| [8] | LI Y, SUN K, YE G, LIANG Y, PAN H, WANG G, et al. Evaluation of cold plasma treatment and safety in disinfecting 3-week root canal Enterococcus faecalis biofilm in vitro[J]. J Endod, 2015, 41: 1325–1330. DOI: 10.1016/j.joen.2014.10.020 |
| [9] | CHEN X, LI P, WANG X, GU M, ZHAO C, SLOAN A J, et al. Ex vivo antimicrobial efficacy of strong acid electrolytic water against Enterococcus faecalis biofilm[J]. Int Endod J, 2013, 46: 938–946. DOI: 10.1111/iej.2013.46.issue-10 |
| [10] | ADL A, HAMEDI S, SEDIGH SHAMS M, MOTAMEDIFAR M, SOBHNAMAYAN F. The ability of triple antibiotic paste and calcium hydroxide in disinfection of dentinal tubules[J]. Iran Endod J, 2014, 9: 123–126. |
| [11] | HE Z, LIANG J, ZHOU W, XIE Q, TANG Z, MA R, et al. Effect of the quorum-sensing luxS gene on biofilm formation by Enterococcus faecalis[J]. Eur J Oral Sci, 2016, 124: 234–240. DOI: 10.1111/eos.2016.124.issue-3 |
| [12] | EVANS M, DAVIES J K, SUNDQVIST G, FIGDOR D. Mechanisms involved in the resistance of Enterococcus faecalis to calcium hydroxide[J]. Int Endod J, 2002, 35: 221–228. DOI: 10.1046/j.1365-2591.2002.00504.x |
| [13] | LOVE R M. Enterococcus faecalis-a mechanism for its role in endodontic failure[J]. Int Endod J, 2001, 34: 399–405. DOI: 10.1046/j.1365-2591.2001.00437.x |
| [14] | KAYALVIZHI G, SUBRAMANIYAN B, SUGANYA G. Topical application of antibiotics in primary teeth:an overview[J]. J Dent Child (Chic), 2013, 80: 71–79. |
| [15] | BAZVAND L, AMINOZARBIAN M G, FARHAD A, NOORMOHAMMADI H, HASHEMINIA S M, MOBASHERIZADEH S. Antibacterial effect of triantibiotic mixture, chlorhexidine gel, and two natural materials Propolis and Aloe vera against Enterococcus faecalis:an ex vivo study[J]. Dent Res J (Isfahan), 2014, 11: 469–474. |
| [16] | ATILA-PEKTAS B, YURDAKUL P, GULMEZ D, GÖRDUYSUS O. Antimicrobial effects of root canal medicaments against Enterococcus faecalis and Streptococcus mutans[J]. Int Endod J, 2013, 46: 413–418. DOI: 10.1111/iej.2013.46.issue-5 |
| [17] | REYNOLDS K, JOHNSON J D, COHENCA N. Pulp revascularization of necrotic bilateral bicuspids using a modified novel technique to eliminate potential coronal discolouration:a case report[J]. Int Endod J, 2009, 42: 84–92. DOI: 10.1111/iej.2008.42.issue-1 |
| [18] | ALYAS S M, FISCHER B I, EHRLICH Y, SPOLNIK K, GREGORY R L, YASSEN G H. Direct and indirect antibacterial effects of various concentrations of triple antibiotic pastes loaded in a methylcellulose system[J]. J Oral Sci, 2016, 58: 575–582. DOI: 10.2334/josnusd.16-0384 |
| [19] | GOMES-FILHO J E, DUARTE P C, DE OLIVEIRA C B, WATANABE S, LODI C S, CINTRA L T, et al. Tissue reaction to a triantibiotic paste used for endodontic tissue self-regeneration of nonvital immature permanent teeth[J]. J Endod, 2012, 38: 91–94. |
| [20] | KHAN A A, SUN X, HARGREAVES K M. Effect of calcium hydroxide on proinflammatory cytokines and neuropeptides[J]. J Endod, 2008, 34: 1360–1363. DOI: 10.1016/j.joen.2008.08.020 |
| [21] | MOHAMMADI Z, DUMMER P M. Properties and applications of calcium hydroxide in endodontics and dental traumatology[J]. Int Endod J, 2011, 44: 697–730. DOI: 10.1111/iej.2011.44.issue-8 |
 2017, Vol. 38
2017, Vol. 38


