随着消化内镜技术的快速发展及相关内镜辅助器械的改进,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)应用于治疗上消化道黏膜浅表病变的技术更加成熟[1-3]。应用ESD治疗胃黏膜病变,尤其是早期癌症和癌前病变,不但治疗效果与外科手术相似,而且能降低大部分患者传统外科手术的治疗风险,具有微创、术后恢复快等特点,不影响患者的生活质量[4-6]。本研究回顾性分析了我院内镜中心2014年1月至2015年10月应用ESD治疗胃黏膜浅表病变的病例资料,评价了该技术的临床应用安全性和有效性,并对其并发症发生的相关因素及处理情况进行了分析,现报告如下。
1 材料和方法 1.1 一般资料2014年1月至2015年10月间经胃镜检查发现胃黏膜异常患者116例,男57例、女59例,平均年龄(59.1±9.0)岁。病变位于贲门13例(11.2%),胃角8例(6.9%),胃体10例(8.6%),胃窦85例(73.3%)。所有患者在行ESD术前均行心电图检查、胸部X线片检查和凝血功能及肝功能检查,评估手术风险。术前实验室检查均无手术禁忌与凝血异常。所有患者术前均被告知手术的益处和风险,并签署知情同意书。
1.2 ESD手术方法 1.2.1 手术器械和药品奥林巴斯GIF-Q260或XQ240型胃镜,奥林巴斯高频电刀Dua刀(KD-650L),奥林巴斯高频电刀IT-2刀(KD-611L),奥林巴斯透明帽(D-201-10704),Coagrasper电止血钳(FD-410LR);奥林巴斯注射针,富士高清治疗内镜(EG-580RD),富士高频电刀Flush刀(DK2168JB-20),爱尔博ICC-200或VIO 300D型内镜治疗电子系统。黏膜下注射液:甘油果糖氯化钠注射液250 mL(丙三醇25 g、果糖12.5 g、氯化钠2.25 g)、亚甲蓝3 mL与肾上腺素2 mL混合,奥林巴斯止血夹释放装置、奥林巴斯止血夹、二氧化碳气泵等。ESD治疗过程中胃镜头端附加透明帽。
1.2.2 ESD操作流程所有患者均采用静脉麻醉。术前对胃镜检查发现的病变行内镜窄带成像术(NBI)、内镜染色明确病变范围和性质。结合放大内镜观察病灶的大小、形态,确定病灶的浸润深度,术前行超声内镜或CT检查以确诊病变局限于黏膜层和黏膜下层,排除肿瘤的淋巴结转移。ESD操作具体流程如下(图 1)。
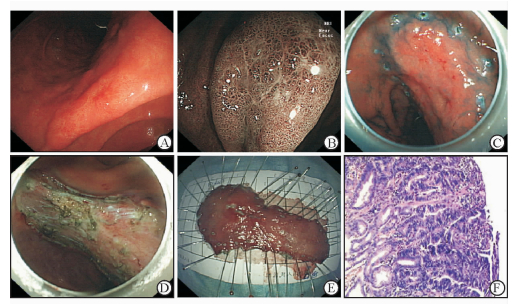
|
图 1 内镜黏膜下剥离术(ESD)操作流程 A:胃角早期胃癌病变; B:内镜窄带成像(NBI)下观察病变; C:染色后完成标记; D:完成病变的黏膜下剥离; E:将完整切除后的组织标本固定; F:病理(H-E染色)示病变局限于黏膜层,水平切缘和垂直切缘均阴性. Original magnification: ×100 (F) |
(1) 标记:在NBI和放大内镜下确定病变范围,并应用Dua刀或Flush刀沿病变外侧5 mm处进行标记,对于病变范围不清的,联合应用0.1%~0.4%靛胭脂染色显示肿瘤边界,然后应用Dua刀等在肿瘤边界外侧约5 mm处作标记。(2)黏膜下注射:使用黏膜下注射液进行黏膜下注射,沿着病变标记处进行注射,每个标记点约注射2 mL,对于注射后黏膜抬举效果不佳者可追加黏膜下注射。(3)四周黏膜预切开:当病变充分抬举后,用Dua刀或Flush刀沿着病变标记外侧黏膜做环形的四周预切开,注意切开的层次在黏膜下层,四周切开时应保持连续。(4)黏膜下剥离:应用Dua刀和IT-2刀进行黏膜下剥离,为保持内镜下视野清楚,在内镜头端附加使用透明帽,IT-2刀置于病灶下方水平方向进行黏膜下层剥离,剥离过程中应始终保持剥离的层次在病变黏膜下层,剥离过程中可以通过牵拉或旋转镜身等方法,沿着病变的基底切线方向进行有效剥离。在整个剥离的手术过程中应及时追加黏膜下注射,以维持被剥离病灶处的充分抬举,并且保持剥离视野清楚,直至将整个病灶完整地剥离下来。(5)创面处理:应用止血钳、氩离子凝固等对剥离术后创面的所有可见的血管行预防性止血,对于较大裸露的血管可用止血夹将其夹闭,以预防出血等并发症的发生。(6)术后组织标本处理:用大头针将完整切除的组织标本在平板上平铺固定,记录病变大小并留图。将固定好的组织标本置于溶液中保存,并进行病理组织学检查。
1.3 术后组织学评价组织学评价标准:术后一次性完整切除的病变四周切缘和基底部均无癌细胞及良性肿瘤组织,视为完全治愈性切除;若四周切缘可能存在癌细胞或良性肿瘤组织,视为可能治愈性切除;以上两种情况之外的情况,视为组织学非治愈性切除;对于分片切除的病变,由于无法进行进一步的组织学评价,视为非治愈性切除[7-8]。术后病理学检查若发现病变的黏膜下层淋巴管或血管浸润,建议患者进行胃根治性切除手术治疗。
1.4 ESD手术并发症的判定标准胃黏膜浅表病变ESD治疗的常见并发症主要有出血、穿孔、狭窄等[9-11],其中出血包括术中出血和术后延迟性出血。急性术中少量出血是指在ESD手术过程中创面出现渗血或喷射性出血,持续1 min以上,在内镜下能完成止血;急性术中大量出血是指在ESD手术过程中出现活动性的渗血或喷射性出血,但内镜下止血困难,需中止手术和(或)需要输血治疗;延迟性出血是指患者术后出现出血的临床症状和(或)血红蛋白下降>20 g/L。术中出现穿孔为内镜下可以看见的组织缺损或见到胃腔外游离网膜的出现,要及时发现并处理。狭窄主要在贲门或胃窦近幽门管的环周病变切除后,发生狭窄、进食不畅、内镜检查时内镜不能通过等表现。
1.5 ESD术后处理及随访指标ESD术后处理:患者手术后第1天禁饮食、禁饮水,密切观察患者血压、呼吸、脉搏、心电图等变化;如患者临床表现和相关检查无异常,术后第2天可以进冷流汁,若患者无不适症状,术后第3天可进软食。患者术后1周无异常可出院。患者出院后口服质子泵抑制剂和胃黏膜保护剂,每日2次,约2个月,直至术后黏膜缺损创面愈合。术后第2、6、12个月各复查胃镜1次,后每年复查1次内镜。随访指标:(1)残留,是指术后6个月内在原切除病变部位和(或)周围区域1 cm以内病理活组织检查发现肿瘤生长;(2)局部复发,是指手术6个月以后在原病变切除部位和(或)周围区域1 cm以内发现肿瘤生长;(3)异时病灶(在以上两者范围以外处发现的病灶)发生。
1.6 统计学处理应用SPSS 17.0软件对手术结果进行分析。计数资料以百分比表示,数据比较应用χ2检验或Fisher确切概率法;计量资料以x±s表示。检验水准(α)为0.05。
2 结果 2.1 一般情况2014年1月至2015年10月间共有116例胃黏膜浅表病变患者完成ESD治疗,患者平均肿瘤最大径(25.0±11.6) mm;平均手术时间(56.6±20.5) min。一次性整块切除率为99.1%(115/116),组织学完全治愈性切除率为95.7%(111/116)。ESD术后病理结果示早期胃癌13例(11.2%),高级别上皮内瘤变9例(7.8%),低级别上皮内瘤变57例(49.1%),腺瘤7例(6.0%),炎症18例(15.5%),肠上皮化生10例(8.6%),异位胰腺2例(1.7%)。
2.2 并发症及相关危险因素本组ESD手术患者出血的发生率为4.3%(5/116),其中术中急性少量出血的发生率为3.4%(4/116),延迟性出血发生率为0.9%(1/116),无急性大量出血;5例ESD术中出现出血的患者均应用电凝止血和止血夹联合内镜下止血成功。术中穿孔发生率为2.6%(3/116),3例均为术中发现的小穿孔,均在术中应用钛夹夹闭穿孔部位,无气腹等并发症发生,均保守治疗成功。本组病例无迟发性穿孔发生。本组ESD治疗患者无狭窄及其他严重并发症发生。
将ESD术中出血和穿孔进行合并分析,并发症发生部位为胃体3例、胃角3例、胃窦2例;8例出现并发症的病例术后病理结果为4例早期胃癌、2例高级别上皮内瘤变、1例低级别上皮内瘤变、1例腺瘤;8例发生并发症的病例中有5例ESD术中黏膜下注射抬举征为阴性,3例为阳性。对ESD出血和穿孔两种并发症发生的危险因素进行单因素分析,结果示病变的发病部位(χ2=16.456,P=0.000)、术后病理结果(χ2= 15.848,P=0.004)和黏膜下注射抬举征(χ2=32.596,P=0.000)为影响ESD术中出血和穿孔发生的危险因素。胃角部位及术后病理结果为早期胃癌病例并发症的发生率高于其他亚组,故将这两个变量进行二分类后重新统计,结果(表 1)示胃角部位和病理结果为早期胃癌是ESD术中出血和穿孔发生的危险因素(P<0.05)。
|
|
表 1 肿瘤部位和病理类型对ESD术中并发症的影响 |
2.3 随访
所有完成ESD治疗患者术后均服用质子泵抑制剂2个月,术后2个月随访复查胃镜示术后创面溃疡愈合率为100%。ESD术后随访13~34个月,平均随访时间为(20.3±5.1)个月,5例ESD术后可能治愈性切除患者中,2例ESD术后病理示黏膜下癌浸润到黏膜下中层(SM2),其中1例为中分化腺癌、1例为低分化腺癌,均追加外科开腹手术治疗,术后外科手术治愈,腹腔未见淋巴结转移;另外3例术后病理为低级别病变,随访至今无复发。本组病例术后严密随访,至今均无残留、复发及异时病灶发生。
3 讨论外科根治性切除术后患者经常会并发早饱、吞咽困难、烧心反酸、腹部不适等一系列症状,生活质量明显下降[12-13]。ESD治疗胃黏膜浅表病变为微创治疗,既能达到外科手术的治疗效果,又不影响患者生活质量。ESD与内镜下黏膜切除术相比具有明显的优势,其能将大面积、形态不规则的或合并溃疡、瘢痕等病变一次性完整地从固有肌层表面剥离,明显减少了肿瘤残留和复发发生[14-15]。胃黏膜浅表病变的ESD可以在不开腹手术的情况下获得完整的组织标本,通过病理检查进一步明确病变性质、浸润深度、组织分化程度,以及明确是否存在淋巴和血管浸润,预测是否存在淋巴结转移的危险因素,帮助临床医师选择后续辅助的治疗方法[16-17]。
本组中,ESD一次性整块切除率为99.1%(115/116),组织学完全治愈性切除率为95.7%(111/116),5例可能治愈性切除患者中有2例ESD术后病理示黏膜下癌,其中1例为分片切除;2例黏膜下癌的病理结果中1例为中分化腺癌,1例为低分化腺癌;此2例患者ESD术后均选择追加外科开腹手术治疗。本组中所有ESD组织学完全治愈性切除患者随访至今均无残留、复发及异时病灶发生。可认为整块切除与否是影响ESD治愈性切除的因素,而病变整块切除的难度与病变大小、浸润深度及病理分型有关。
出血是胃黏膜浅表病变ESD治疗的常见并发症之一[18-19],大多经内镜治疗能有效止血,为避免或减少出血并发症的发生,术中应在黏膜层和黏膜下层之间进行准确的预切开,有效行黏膜下剥离;而针对大血管的解剖位置,可以采取预防性止血,即应用电凝或氩离子凝固止血,对于裸露的大血管也可用止血夹夹闭;ESD术中一旦发生大出血,则耗时耗力并影响手术视野,我们强调术中不应盲目止血,否则容易造成创面穿孔,故认为预防性止血很关键。本组病例的术中和术后出血率为4.3%(5/116),其中术中急性少量出血率为3.4%(4/116),术后延迟性出血发生率为0.9%(1/116);4例术中急性出血部位分别为胃体2例、胃角1例、胃窦1例;1例延迟性出血部位为胃窦,是术后1 d发现的延迟性出血;5例出血病例均应用止血夹联合电凝止血成功,无转外科急诊手术病例。文献报道认为延迟性出血与病变位置、病变大小和回收标本的组织学类型有关[20-22]。延迟出血发生于术后24 h内,病变大多位于胃体中、下部,建议ESD术后对高血压患者应严格控制血压,对胃体中、下部的病变必要时应早期内镜随访,了解创面愈合情况。质子泵抑制剂对ESD术后迟发性出血有较好的预防作用,术后应常规给予口服质子泵抑制剂促进溃疡面的愈合,减少延迟性出血的发生。
穿孔也是ESD治疗胃黏膜浅表病变常见并发症之一[23-24],本组病例ESD术中穿孔发生率为2.6%(3/116),3例穿孔发生部位为胃体1例、胃角2例,均用止血夹夹闭穿孔部位,保守治疗成功。无延迟性穿孔的发生。随着内镜技术的发展、操作水平的提高和ESD治疗经验的积累,穿孔的发生率较ESD刚开展时有所下降。但对于浸润较深、剥离困难的病变,穿孔的发生率仍较高。ESD操作时吸净胃内液体,剥离过程中保持视野清晰,可有效预防穿孔的发生[25]。ESD所致的穿孔一般较小,且患者在空腹状态下,腹膜炎体征较轻,但是强调要早期发现,小的穿孔可应用止血夹夹闭;当穿孔较大时可用大网膜封闭穿孔,术后禁饮食、半卧位、胃肠减压置管、静脉使用抗生素等保守治疗,一般可以避免外科手术。狭窄也是ESD术后并发症,但发生率较低,主要发生于贲门、胃窦及幽门部位较大面积ESD,扩张可作为一种处理狭窄的方法,本组病例中无狭窄并发症发生。
本组病例中,单因素与多因素分析发现病变部位(胃角)、术后病理结果(早期胃癌)和黏膜下注射抬举征阴性与ESD术中出血和穿孔的发生有关,考虑原因可能是早期胃癌病例由于病变浸润导致黏膜下粘连,使得黏膜下注射抬举不好,影响ESD的黏膜下剥离操作;此外,早期胃癌的黏膜下血管比较丰富,影响ESD的操作进程,容易发生出血等并发症;而出血的发生需内镜下止血,同时对视野产生一定的影响,使得穿孔的发生率较良性病变增高。
总之,ESD是一项操作难度较高的微创手术,初学者需要正确掌握该项技术,不断积累和完善经验,提高ESD操作水平。随着ESD技术的日益成熟,ESD已成为消化道浅表病变首选治疗方法之一,根据我院ESD治疗胃黏膜浅表病变患者随访资料可发现,ESD治疗胃黏膜病变安全有效。胃角部位和术后病理结果为早期胃癌的病变是胃黏膜ESD发生出血和穿孔并发症的危险因素,对于此类病例在ESD术中应注意预防并发症的发生,随着内镜技术和相关设备的不断发展及应用[26],ESD完全切除率会越来越高,ESD相关并发症也将通过内镜和其他辅助方法得到有效的治疗及预防。
| [1] | GOTO O, TAKEUCHI H, KITAGAWA Y, YAHAGI N. Endoscopic submucosal dissection (ESD) and related techniques as precursors of "new notes" resection methods for gastric neoplasms[J]. Gastrointest Endosc Clin N Am, 2016, 26: 313–322. DOI: 10.1016/j.giec.2015.12.006 |
| [2] | CHIU P W. Novel endoscopic therapeutics for early gastric cancer[J]. Clin Gastroenterol Hepatol, 2014, 12: 120–125. DOI: 10.1016/j.cgh.2013.07.037 |
| [3] | AKAHOSHI K, MOTOMURA Y, KUBOKAWA M, GIBO J, KINOSHITA N, OSADA S, et al. Endoscopic submucosal dissection for early gastric cancer using the clutch cutter:a large single-center experience[J/OL]. Endosc Int Open, 2015, 3:E432-E438. doi:10.1055/s-0034-1392509. |
| [4] | KOSAKA T, ENDO M, TOYA Y, ABIKO Y, KUDARA N, INOMATA M, et al. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer:a single-center retrospective study[J]. Dig Endosc, 2014, 26: 183–191. DOI: 10.1111/den.2014.26.issue-2 |
| [5] | PIMENTEL-NUNES P, MOURÃO F, VELOSO N, AFONSO L P, JÁCOME M, MOREIRA-DIAS L, et al. Long-term follow-up after endoscopic resection of gastric superficial neoplastic lesions in Portugal[J]. Endoscopy, 2014, 46: 933–940. DOI: 10.1055/s-00000012 |
| [6] | CHOI M K, KIM G H, PARK D Y, SONG G A, KIM D U, RYU D Y, et al. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer:a single-center experience[J]. Surg Endosc, 2013, 27: 4250–4258. DOI: 10.1007/s00464-013-3030-4 |
| [7] | SHIN N, JEON T Y, KIM G H, PARK D Y. Unveiling lymph node metastasis in early gastric cancer[J]. World J Gastroenterol, 2014, 20: 5389–5395. DOI: 10.3748/wjg.v20.i18.5389 |
| [8] | TANAKA M, ONO H, HASUIKE N, TAKIZAWA K. Endoscopic submucosal dissection of early gastric cancer[J]. Digestion, 2008, 77(Suppl 1): 23–28. |
| [9] | ODA I, SUZUKI H, NONAKA S, YOSHINAGA S. Complications of gastric endoscopic submucosal dissection[J]. Dig Endosc, 2013, 25(Suppl 1): 71–78. |
| [10] | SUZUKI H, ODA I, SEKIGUCHI M, ABE S, NONAKA S, YOSHINAGA S, et al. Management and associated factors of delayed perforation after gastric endoscopic submucosal dissection[J]. World J Gastroenterol, 2015, 21: 12635–12643. DOI: 10.3748/wjg.v21.i44.12635 |
| [11] | HIGASHIYAMA M, OKA S, TANAKA S, SANOMURA Y, IMAGAWA H, SHISHIDO T, et al. Risk factors for bleeding after endoscopic submucosal dissection of gastric epithelial neoplasm[J]. Dig Endosc, 2011, 23: 290–295. DOI: 10.1111/den.2011.23.issue-4 |
| [12] | KIM A R, CHO J, HSU Y J, CHOI M G, NOH J H, SOHN T S, et al. Changes of quality of life in gastric cancer patients after curative resection:a longitudinal cohort study in Korea[J]. Ann Surg, 2012, 256: 1008–1013. DOI: 10.1097/SLA.0b013e31827661c9 |
| [13] | KARANICOLAS P J, GRAHAM D, GÖNEN M, STRONG V E, BRENNAN M F, COIT D G. Quality of life after gastrectomy for adenocarcinoma:a prospective cohort study[J]. Ann Surg, 2013, 257: 1039–1046. DOI: 10.1097/SLA.0b013e31828c4a19 |
| [14] | TERASAKI M, TANAKA S, OKA S, NAKADOI K, TAKATA S, KANAO H, et al. Clinical outcomes of endoscopic submucosal dissection and endoscopic mucosal resection for laterally spreading tumors larger than 20 mm[J]. J Gastroenterol Hepatol, 2012, 27: 734–740. DOI: 10.1111/jgh.2012.27.issue-4 |
| [15] | CHEN W C, WALLACE M B. Endoscopic management of mucosal lesions in the gastrointestinal tract[J]. Expert Rev Gastroenterol Hepatol, 2016, 10: 481–495. DOI: 10.1586/17474124.2016.1122520 |
| [16] | KIM M Y, CHO J H, JAIN P, CHO G Y. ESD around the world:Asia[J]. Gastrointest Endosc Clin N Am, 2014, 24: 283–293. DOI: 10.1016/j.giec.2013.11.001 |
| [17] | JUNG H Y. Endoscopic resection for early gastric cancer:current status in Korea[J]. Dig Endosc, 2012, 24(Suppl 1): 159–165. |
| [18] | SHINDO Y, MATSUMOTO S, MIYATANI H, YOSHIDA Y, MASHIMA H. Risk factors for postoperative bleeding after gastric endoscopic submucosal dissection in patients under antithrombotics[J]. World J Gastrointest Endosc, 2016, 8: 349–356. DOI: 10.4253/wjge.v8.i7.349 |
| [19] | EBI M, SHIMURA T, NISHIWAKI H, TANAKA M, TSUKAMOTO H, OZEKI K, et al. Management of systolic blood pressure after endoscopic submucosal dissection is crucial for prevention of post-ESD gastric bleeding[J]. Eur J Gastroenterol Hepatol, 2014, 26: 504–509. DOI: 10.1097/MEG.0000000000000072 |
| [20] | RYU H Y, KIM J W, KIM H S, PARK H J, JEON H K, PARK S Y, et al. Second-look endoscopy is not associated with better clinical outcomes after gastric endoscopic submucosal dissection:a prospective, randomized, clinical trial analyzed on an as-treated basis[J]. Gastrointest Endosc, 2013, 78: 285–294. DOI: 10.1016/j.gie.2013.02.008 |
| [21] | GOTO O, FUJISHIRO M, ODA I, KAKUSHIMA N, YAMAMOTO Y, TSUJI Y, et al. A multicenter survey of the management after gastric endoscopic submucosal dissection related to postoperative bleeding[J]. Dig Dis Sci, 2012, 57: 435–439. DOI: 10.1007/s10620-011-1886-5 |
| [22] | CHOI C W, KANG D H, KIM H W, HONG J B, PARK S B, KIM S J, et al. High dose proton pump inhibitor infusion versus bolus injection for the prevention of bleeding after endoscopic submucosal dissection:prospective randomized controlled study[J]. Dig Dis Sci, 2015, 60: 2088–2096. DOI: 10.1007/s10620-015-3560-9 |
| [23] | KANG S H, LEE K, LEE H W, PARK G E, HONG Y S, MIN B H. Delayed perforation occurring after endoscopic submucosal dissection for early gastric cancer[J]. Clin Endosc, 2015, 48: 251–255. DOI: 10.5946/ce.2015.48.3.251 |
| [24] | KIM M, JEON S W, CHO K B, PARK K S, KIM E S, PARK C K, et al. Predictive risk factors of perforation in gastric endoscopic submucosal dissection for early gastric cancer:a large, multicenter study[J]. Surg Endosc, 2013, 27: 1372–1378. DOI: 10.1007/s00464-012-2618-4 |
| [25] | FUJISHIRO M, YAHAGI N, KAKUSHIMA N, KODASHIMA S, MURAKI Y, ONO S, et al. Successful nonsurgical management of perforation complicating endoscopic submucosal dissection of gastrointestinal epithelial neoplasms[J]. Endoscopy, 2006, 38: 1001–1006. DOI: 10.1055/s-2006-944775 |
| [26] | LEBLANC S, BARRET M, BREHM A, ROUQUETTE A, CAMUS M, WINTERMANTEL E, et al. A new device to expedite endoscopic submucosal dissection procedures:a randomized animal study of efficacy and safety(with videos)[J]. Endosc Int Open, 2015, 3: E443–E449. DOI: 10.1055/s-0034-1392216 |
 2017, Vol. 38
2017, Vol. 38


