2. 第二军医大学东方肝胆外科医院病理科, 上海 200438
2. Department of Pathology, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)是肝脏第二大常见恶性肿瘤,占原发性肝癌的10%~20%[1]。近年来ICC的发病率在全球范围内呈上升趋势[2]。目前根治性切除术是ICC唯一有效的治疗方法。然而,大多数患者明确诊断时已是晚期,根治性切除率低于30%[3]。由于ICC具有很强的转移性,其术后复发率约为50%~80%[4]。因此,手术结合其他治疗可能对改善预后至关重要。研究发现未行根治性切除术的ICC患者中位生存期只有3~6个月,而经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)已被证实可将ICC患者的存活率提高至12.2个月[5]。但对于接受根治性手术的患者,术后TACE(pTACE)的作用和接受这种治疗的选择标准尚有争议。本研究回顾性分析了2010年1月至2011年12月在第二军医大学东方肝胆外科医院进行根治性手术治疗后的114例ICC患者的临床资料,并分析总生存期(overall survival,OS)和无复发生存期(recurrence-free survival,RFS)的独立危险因素。另外,对患者进行复发风险因素分层以评估pCACE对ICC患者远期预后的影响。
1 资料和方法 1.1 病例来源选取2010年1月至2011年12月在第二军医大学东方肝胆外科医院接受手术治疗的组织病理学诊断为ICC的123例患者,其中119例行根治性切除术,其余因腹膜转移而进行了剖腹探查术和活组织检查术。在接受根治性切除术的患者中,5例患者失访,其余114例患者纳入本研究。纳入标准:无远处转移;完全切除肿瘤;术后病理诊断为ICC。排除标准:接受术前辅助治疗(如TACE、射频消融、放射治疗和生物治疗);肝门部胆管癌;组织病理学为ICC混合肝细胞肝癌(hepatocellular carcinoma,HCC);术后1个月内复发或死亡。纳入研究的患者均签署知情同意书,本研究已获得第二军医大学东方肝胆外科医院医学伦理委员会审批通过。
1.2 pTACEpTACE的治疗是结合外科医师的评估和患者的意愿决定的。纳入治疗标准:美国东部肿瘤协作组评分为0或1;Child-Pugh A级或B级;肾功能正常;白细胞计数≥3.0×109 L;血小板计数≥50×109/L;患者同意并签署治疗同意书。排除标准:血管造影或内脏导管插入禁忌证;肝外疾病;炎症;复发性感染;妊娠或哺乳[6]。肝脏切除后采用数字减影血管造影术(digital subtraction angiography,DSA)进行辅助TACE治疗[7]。同意行pTACE的患者,在切除术后2个月时进行第1次预防性TACE。术中使用DSA,如果常规腹腔或肝动脉DSA显示没有复发迹象,常规使用5-氟尿嘧啶500 mg或卡铂100 mg、表柔比星20 mg、羟基喜树碱10 mg、碘油35 mL;第2次TACE在第1次TACE后3~5个月进行。如果检测到复发灶,则通过血供情况、肿瘤大小、肿瘤数量或复发以及肝功能确定抗肿瘤药物和碘油的剂量。患者再次重复TACE的间隔时间取决于患者的反应和复查时影像学检查的结果。
1.3 随访患者出院后接受常规血液检查,每3个月检测甲胎蛋白(α-fetoprotein,AFP)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)和癌胚抗原(carcino-embryonic antigen,CEA)的血清水平。此外进行腹部超声检查,疑似复发患者再行CT或MRI确诊,并记录肿瘤复发的时间。疑似远处转移时行胸部CT、骨扫描。
1.4 临床资料分析患者的性别、年龄、乙型肝炎病毒(hepatitis B virus,HBV)感染、血清γ-谷氨酰转肽酶(γ-glutamyl transferase,GGT)、总胆红素(total bilirubin,TB)、AFP、CEA、CA19-9、肿瘤个数、肿瘤最大径、组织学分化程度、淋巴结转移(lymph node metastasis,LNM)、血管侵犯和手术切缘状态,以确定与OS和RFS相关的预后因素。HBV感染被定义为HBsAg(+)或抗HBc(+)。GGT和TB的截止值分别为50 U/L和17.1 μmol/L。AFP、CEA和CA19-9的截止值分别为20 ng/mL、10 μg/L和37 U/mL。LNM由术前影像检查、术中探查和术后组织病理学报告确定。手术切除边缘情况由显微镜观察证实。
1.5 统计学处理使用SPSS 22.0软件进行统计学分析。计量资料以中位数(最小值~最大值)表示,计数资料以例数表示,组间比较采用χ2检验或Fisher精切概率法。通过Cox回归风险模型行单因素和多因素分析确定预后因素。通过Kaplan-Meier方法绘制生存曲线,并通过对数秩检验进行差异分析。检验水准(α)为0.05。
2 结果 2.1 OS的预测因素本研究纳入了114例患者,中位随访时间为17.8个月(1.4~70.0个月),1年、3年和5年OS累积率分别为60%、25%和15%,手术切除后中位生存时间为16.7个月(1.3~66.0个月)。单因素分析结果显示,肿瘤最大径>5 cm、多发肿瘤、卫星灶、大血管侵犯、微血管侵犯、LNM、TNM分期、肿瘤切缘状态及GGT、CEA和CA19-9血清水平升高与ICC患者的OS密切相关(P < 0.05)。多因素分析进一步表明,肿瘤最大径>5 cm、多发肿瘤、微血管侵犯、LNM和手术切缘阳性是生存不良的独立预测因素(P < 0.05)。然而,有和没有接受pTACE的ICC患者的OS累积率差异无统计学意义(P=0.062)。见表 1。
|
|
表 1 肝内胆管细胞癌患者总生存期的单因素分析和多因素分析 Tab 1 Univariate and multivariate analyses of overall survival in patients with intrahepatic cholangiocarcinoma |
2.2 RFS的预测因素
114例ICC患者中93例于2016年12月31日前复发。RFS的中位时间为10.2个月(0.7~66.0个月),1年、2年和3年的RFS累积率分别为41%、29%和17%。肝内复发77例(82.8%),肝外复发10例(10.8%),其余6例(6.4%)同时发生肝内和肝外复发。单因素分析显示,肿瘤最大径>5 cm、多发肿瘤、卫星灶、大血管侵犯、微血管侵犯、TNM分期、血清GGT水平、手术切缘>1 cm均为复发的重要预测因素(P < 0.05)。多因素分析显示肿瘤最大径>5 cm、多发肿瘤和微血管侵犯是RFS的独立危险因素(P < 0.05)。然而,pTACE无法延长ICC患者的RFS(P=0.627)。见表 2。
|
|
表 2 肝内胆管细胞癌患者无复发生存期的单因素分析和多因素分析 Tab 2 Univariate and multivariate analysis of recurrence-free survival in patients with intrahepatic cholangiocarcinoma |
2.3 pTACE对高风险组患者的影响
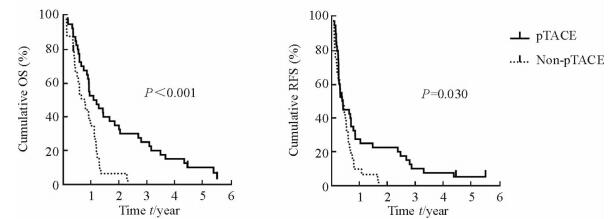
多因素分析显示肿瘤最大径>5 cm、多发肿瘤、微血管侵犯是OS和RFS的独立危险因素,根据这3个因素对ICC患者进行分层分析,有其中1项及以上复发危险因素的患者被定义为高风险组(n=73),没有复发风险因素被定义为低风险组(n=41)。再根据是否行pTACE将每组患者分为2个亚组。在高风险组中,40例患者接受了pTACE,33例患者没有接受pTACE。高风险组患者的临床病理资料如表 3所示,接受pTACE组与未接受pTACE组临床病理资料(性别、年龄、肿瘤最大径、肿瘤个数、卫星灶、微血管侵犯、LNM、TNM分期、肿瘤切缘状态,以及GGT、CEA和CA19-9血清水平)的差异均无统计学意义(P均>0.05)。如图 1所示,高风险组中接受pTACE的患者的中位生存时间为13.5个月(2.0~66.0个月),没有接受pTACE的为9.0个月(1.4~27.3个月),接受pTACE患者的OS累积率高于未接受pTACE的患者(P < 0.001);接受pTACE的患者中位复发时间为8.7个月(0.4~66.0个月),没有接受pTACE的为7.3个月(1.1~27.2个月),两组RFS累积率差异也有统计学意义(P=0.030)。
|
|
表 3 高风险组与低风险组患者的临床病理资料 Tab 3 Characteristics of patients in high-risk and low-risk groups |
|
图 1 高风险组中两组患者生存曲线比较 Fig 1 Comparison of survival time of patients between pTACE and non-pTACE subgroups in high-risk group OS: Overall survival; RFS: Recurrence-free survival; pTACE: Post-operative transcatheter hepatic arterial chemoembolization |
2.4 pTACE对低风险组患者的影响
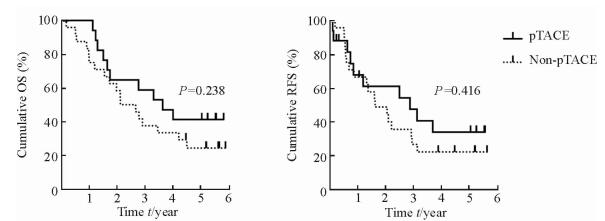
低风险组中17例患者接受了pTACE,24例未接受pTACE。低风险组患者的临床病理资料如表 3所示,接受pTACE组与未接受pTACE组之间的临床病理资料差异均无统计学意义(P均>0.05)。接受pTACE的患者1、3、5年OS累积率分别为100%、59%和41%,未接受pTACE的患者分别为79%、38%、24%,两组间差异无统计学意义(P=0.238)。接受pTACE的患者1、2、3年RFS累积率分别为59%、53%、41%,未接受pTACE的患者RFS累积率分别为78%、53%、29%,两组RFS累积率差异无统计学意义(P=0.416)。见图 2。
|
图 2 低风险组中两组患者生存曲线比较 Fig 2 Comparison of survival time of patients between pTACE and non-pTACE subgroups in low-risk group OS: Overall survival; RFS: Recurrence-free survival; pTACE: Post-operative transcatheter hepatic arterial chemoembolization |
3 讨论
ICC是一种高度恶性肿瘤,预后极差,接受根治性切除术预后也不佳,其中一半以上2年内复发[8]。一项国际多中心研究报道了301例ICC患者,术后复发患者中肝内复发最常见(60.9%),其次是肝内和肝外复发(18.6%),33例(21.0%)患者仅肝外复发[9]。本研究结果也有类似的趋势,114例ICC患者中有93例(81.6%)发生肿瘤复发,肝内复发是最常见的复发部位(n=77, 82.8%),肝外复发(n=10,10.8%)多于同时肝内和肝外复发(n= 6, 6.4%)。
研究报道与肝内复发相关的危险因素包括肿瘤大小、肿瘤个数、微血管侵犯、血清GGT及CA19-9水平、术前黄疸和LNM[10]。微血管侵犯是ICC预后不良的强烈预测指标,研究报道微血管侵犯不仅是OS的阴性预测因子,也是门静脉LNM的独立危险因素[11]。在Hyder等[9]的研究中,微血管侵犯是RFS和OS的不良预测因素。这些结果表明微血管侵犯可能导致肝内转移和术后早期复发。因此,可通过辅助治疗来杀死剩余的肿瘤细胞以获得更好的OS和RFS。据报道,LNM阳性是ICC患者OS的阴性预测因子[12]。本研究中,LNM也被确认为OS的独立危险因素。
TACE已经被用作原发性肝癌的重要的辅助治疗方法。与全身化疗不同,TACE可以将化学药物通过肝脏内动脉系统直接作用于肿瘤,以减少化疗药物对正常肝组织和其他器官的损伤。既往研究表明,pTACE可以延长HCC[13]和晚期ICC患者[14]的OS和RFS。有学者建议无法手术的ICC患者可以考虑TACE,可以手术但有LNM或R1切除的ICC患者也可以行辅助TACE[15]。然而,pTACE在ICC中的作用仍然难以捉摸。有研究人员提出当癌细胞不能通过手术被完全切除时,pTACE可以清除剩余的癌细胞[16]。TACE治疗时在动脉内输注的细胞毒性化疗药物和血供栓塞可能会引发复发肿瘤细胞毒性作用和缺血作用,从而起到治疗作用[17]。也有研究报道TACE通过低氧诱导因子1α激活刺激局部血管生成因子,从而导致肿瘤转移[18]。因此,在特定情况下行pTACE是合理的。本研究发现,虽然pTACE对ICC患者的OS和RFS无明显影响,但是当患者按是否具有复发的危险因素(肿瘤最大径>5 cm、多发肿瘤、微血管侵犯)分组时,pTACE可以显著延长高风险组患者的OS和RFS,而对低风险组患者无效。可能是因为有危险因素的患者有可能保留最小的剩余肿瘤,这可能导致早期复发,pTACE可以根除或控制这些残留灶。2016年有研究指出,动脉化疗栓塞和射频消融等局部治疗在ICC患者术后局部肝内和肝外复发的治疗中有效,即pTACE和射频消融可改善ICC复发患者的生存期[19]。
本研究对不同风险级别的ICC患者行pTACE的效果进行了分析,得至少出有肿瘤最大径>5 cm、多发肿瘤、微血管侵犯其中1项风险因素的高危险ICC患者术后可以从pTACE治疗中获益,应该建议接受pTACE治疗。但本研究有局限性,本研究为回顾性研究,且患者行辅助pTACE的决定不是随机的,患者行TACE首次和无复发患者的TACE治疗方案是一致的,复发患者行TACE时会根据复发肿瘤的大小、个数及血供的不同而采用不同的用药及药量,从而在一定程度上影响了研究的客观性。pTACE对预后的影响需要进一步分层分析和前瞻性的研究证实。
| [1] | GUPTA A, DIXON E. Epidemiology and risk factors:intrahepatic cholangiocarcinoma[J]. Hepatobiliary Surg Nutr, 2017, 6: 101–104. DOI: 10.21037/hbsn |
| [2] | RAZUMILAVA N, GORES G J. Cholangiocarcinoma[J]. Lancet, 2014, 383: 2168–2179. DOI: 10.1016/S0140-6736(13)61903-0 |
| [3] | TAN J C, COBURN N G, BAXTER N N, KISS A, LAW C H. Surgical management of intrahepatic cholangiocarcinoma-a population-based study[J]. Ann Surg Oncol, 2008, 15: 600–608. DOI: 10.1245/s10434-007-9627-x |
| [4] | SAIURA A, YAMAMOTO J, KOKUDO N, KOGA R, SEKI M, HIKI N, et al. Intrahepatic cholangiocarcinoma:analysis of 44 consecutive resected cases including 5 cases with repeat resections[J]. Am J Surg, 2011, 201: 203–208. DOI: 10.1016/j.amjsurg.2008.12.035 |
| [5] | PARK S Y, KIM J H, YOON H J, LEE I S, YOON H K, KIM K P. Transarterial chemoembolization versus supportive therapy in the palliative treatment of unresectable intrahepatic cholangiocarcinoma[J]. Clin Radiol, 2011, 66: 322–328. DOI: 10.1016/j.crad.2010.11.002 |
| [6] | ALIBERTI C, CARANDINA R, SARTI D, PIZZIRANI E, RAMONDO G, MULAZZANI L, et al. Chemoembolization with drug-eluting microspheres loaded with doxorubicin for the treatment of cholangiocarcinoma[J]. Anticancer Res, 2017, 37: 1859–1863. DOI: 10.21873/anticanres |
| [7] | WU Z F, ZHANG H B, YANG N, ZHAO W C, FU Y, YANG G S. Postoperative adjuvant transcatheter arterial chemoembolisation improves survival of intrahepatic cholangiocarcinoma patients with poor prognostic factors:results of a large monocentric series[J]. Eur J Surg Oncol, 2012, 38: 602–610. DOI: 10.1016/j.ejso.2012.02.185 |
| [8] | DE JONG M C, NATHAN H, SOTIROPOULOS G C, PAUL A, ALEXANDRESCU S, MARQUES H, et al. Intrahepatic cholangiocarcinoma:an international multi-institutional analysis of prognostic factors and lymph node assessment[J]. J Clin Oncol, 2011, 29: 3140–3145. DOI: 10.1200/JCO.2011.35.6519 |
| [9] | HYDER O, HATZARAS I, SOTIROPOULOS G C, PAUL A, ALEXANDRESCU S, MARQUES H, et al. Recurrence after operative management of intrahepatic cholangiocarcinoma[J]. Surgery, 2013, 153: 811–818. DOI: 10.1016/j.surg.2012.12.005 |
| [10] | YIN X, ZHENG S S, ZHANG B H, ZHOU Y, CHEN X H, REN Z G, et al. Elevation of serum gamma-glutamyltransferase as a predictor of aggressive tumor behaviors and unfavorable prognosis in patients with intrahepatic cholangiocarcinoma:analysis of a large monocenter study[J]. Eur J Gastroenterol Hepatol, 2013, 25: 1408–1614. DOI: 10.1097/MEG.0b013e328364130f |
| [11] | SHIMADA K, SANO T, NARA S, ESAKI M, SAKAMOTO Y, KOSUGE T, et al. Therapeutic value of lymph node dissection during hepatectomy in patients with intrahepatic cholangiocellular carcinoma with negative lymph node involvement[J]. Surgery, 2009, 145: 411–416. DOI: 10.1016/j.surg.2008.11.010 |
| [12] | ERCOLANI G, VETRONE G, GRAZI G L, ARAMAKI O, CESCON M, RAVAIOLI M, et al. Intrahepatic cholangiocarcinoma:primary liver resection and aggressive multimodal treatment of recurrence significantly prolong survival[J]. Ann Surg, 2010, 252: 107–114. DOI: 10.1097/SLA.0b013e3181e462e6 |
| [13] | ZHONG C, GUO R P, LI J Q, SHI M, WEI W, CHEN M S, et al. A randomized controlled trial of hepatectomy with adjuvant transcatheter arterial chemoembolization versus hepatectomy alone for Stage Ⅲ A hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2009, 135: 1437–1445. DOI: 10.1007/s00432-009-0588-2 |
| [14] | KIM J H, YOON H K, SUNG K B, KO G Y, GWON D I, SHIN J H, et al. Transcatheter arterial chemoembolization or chemoinfusion for unresectable intrahepatic cholangiocarcinoma:clinical efficacy and factors influencing outcomes[J]. Cancer, 2008, 113: 1614–1622. DOI: 10.1002/cncr.v113:7 |
| [15] | POULTSIDES G A, ZHU A X, CHOTI M A, PAWLIK T M. Intrahepatic cholangiocarcinoma[J]. Surg Clin North Am, 2010, 90: 817–837. DOI: 10.1016/j.suc.2010.04.011 |
| [16] | FORNER A, LLOVET J M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2012, 379: 1245–1255. DOI: 10.1016/S0140-6736(11)61347-0 |
| [17] | FITZMORRIS P, SHOREIBAH M, ANAND B S, SINGAL A K. Management of hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2015, 141: 861–876. DOI: 10.1007/s00432-014-1806-0 |
| [18] | LIU L, REN Z G, SHEN Y, ZHU X D, ZHANG W, XIONG W, et al. Influence of hepatic artery occlusion on tumor growth and metastatic potential in a human orthotopic hepatoma nude mouse model:relevance of epithelial-mesenchymal transition[J]. Cancer Sci, 2010, 101: 120–128. DOI: 10.1111/cas.2009.101.issue-1 |
| [19] | PARK H M, YUN S P, LEE E C, LEE S D, HAN S S, KIM S H, et al. Outcomes for patients with recurrent intrahepatic cholangiocarcinoma after surgery[J]. Ann Surg Oncol, 2016, 23: 4392–4400. DOI: 10.1245/s10434-016-5454-2 |
 2017, Vol. 38
2017, Vol. 38


