肺癌是全球范围内发病率及死亡率最高的恶性肿瘤之一,其中80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1-2]。近年来,虽然肺癌的诊断和治疗方法不断改进,但肺癌患者的长期存活率并无明显提高。目前已公认肺癌的发生、发展与多种因素相关,但其具体机制还未完全阐明。因此,寻找新的与肺癌密切相关的基因,对于肺癌的诊断与治疗具有重要的意义。
微RNA(microRNA,miRNA)是一类长度为18~25 nt的非编码小单链RNA,参与调控转录后基因表达[3]。MiRNA与多种肿瘤相关[4],并且在肿瘤的发生、诊断、治疗和预后中起着重要作用。MiR-30e-5p为肿瘤抑制基因,其靶基因主要是致癌基因[5-8],且其在NSCLC中的表达下调[9-11],表明其可能在NSCLC中发挥着重要作用。泛素特异性蛋白酶22(ubiquitin-specific protease 22,USP22)是近年来发现的泛素水解酶家族的一个新成员,参与肿瘤细胞周期相关基因的调控,并与肿瘤细胞增殖密切相关[12-13]。USP22可促进肿瘤的形成并在不同的肿瘤中表达上调[14-19]。我们前期工作已经证实USP22在NSCLC的发展中具有关键作用[20]。通过在线TargetScan(www.targetscan.org)预测发现,USP22是miR-30e-5p的靶基因之一。基于此,本研究通过使用miR-30e-5p模拟物或miR-30e-5p抑制物转染H460细胞来过表达或抑制miR-30e-5p,验证miR-30e-5p与USP22的关系及其在NSCLC发生、发展中的作用机制。
1 材料和方法 1.1 材料、试剂与仪器收集2014年1月至2016年7月在上海交通大学医学院附属新华医院就诊的23例NSCLC患者的肿瘤组织和癌旁组织(距离肿瘤边缘>2 cm)。所有患者均获知情同意,研究经上海交通大学医学院附属新华医院医学伦理委员会批准。将组织样本一部分置于-80 ℃冰箱中保存,用于mRNA和蛋白测定;另一部分用4%多聚甲醛溶液固定,石蜡包埋,制作切片,用于H-E染色和免疫组化分析。TRIzol试剂、Lipofectamine 2000(美国Invitrogen公司),反转录试剂盒、双荧光素酶系统、荧光素酶报告基因pmirGlo载体、甘氨酸(美国Promega公司),焦碳酸乙二酯(diethy pyrocarbonate, DEPC)、HEPES缓冲液、RNaseA(美国Sigma公司),RIPA细胞裂解液(美国Millipore公司),BCA蛋白质定量试剂盒(上海碧云天生物技术有限公司)。抗USP22抗体(美国Novus Biologicals公司);抗PCNA一抗、抗SIRT1一抗、HRP山羊抗兔IgG二抗(英国Abcam公司);KOD-plus定点突变试剂盒(日本Toyobo公司);异硫氰酸荧光素(flurescein isothiocynate, FITC)-Annexin Ⅴ试剂盒(美国Roche公司)。H460细胞株、HEK293T细胞株购自中国科学院上海细胞库。胎牛血清、0.25%胰酶、RPMI 1640培养液均购自美国Gibco公司,pWPXL慢病毒载体及其包装系统购自美国Addgene公司。680T型酶联免疫检测仪(美国Bio-Rad公司);3111型CO2细胞培养箱(美国Thermo Forma公司);FACSCalibur流式细胞仪(美国BD公司);GHP-9050型细胞培养箱(上海一恒科学仪器有限公司)。
1.2 免疫组织化学染色检测组织中USP22蛋白的表达取NSCLC组织与癌旁组织切片,按照即用型SP免疫组织化学超敏试剂盒说明书,将切片依次经组织脱蜡、水化、PBS浸泡5 min、滴加阻断剂、抗原修复、非免疫血清封闭、标记一抗和二抗、DAB显色、蒸馏水浸泡等处理。苏木精复染2 min,1%盐酸乙醇分化、脱水、透明,后使用ECL试剂盒封片和成像。
1.3 细胞培养与转染NSCLC细胞株H460接种于含10%胎牛血清、100 IU/mL青霉素和100 μg/mL链霉素(美国Hyclone公司)的RPMI 1640培养液中,置于37 ℃、5% CO2、饱和湿度环境下培养。当细胞达到约80%融合时使用0.25%胰蛋白酶溶液(美国Hyclone公司)消化、传代。取对数期生长细胞,用胰酶消化细胞并计数,以2×103/孔的密度铺于96孔板,在37 ℃、5% CO2培养箱中培养。用100 μL不含血清的培养液漂洗2次,再加入新的不含血清和抗生素的培养液。使用25 μL无血清培养液稀释miR-30e-5p模拟物、miR-30e-5p抑制物(广州锐博生物科技公司)或siRNA/pCMV-USP22存储液,制成A液;另使用25 μL无血清培养液稀释0.5 μL Lipofectamine 2000试剂,制成B液,轻轻混合A、B液(体积比1:1),后转染细胞,37 ℃、5% CO2培养箱中培养48 h后,收集细胞。
1.4 qPCR检测miR-30e-5p、USP22 mRNA的表达根据美国Promega公司的M-MLV操作说明书合成引物。引物序列:miR-30e-5p正向5′-GGC GTG TAA ACA TCC TTG ACT G-3′,反向5′-GTG CAG GGT CCG AGG T-3′;U6正向5′-CTC GCT TCG GCA GCA CA-3′,反向5′-AAC GCT TCA CGA ATT TGC GT-3′;USP22正向5′-GGA CAA CTG GAA GCA GAA CC-3′,反向5′-TGA AAC AGC CGA AGA AGA CA-3′;β-actin正向5′-GAG CAC AGA GCC TCG CCT TT-3′,反向5′-AGA GGC GTA CAG GGA TAG CA-3′。利用TRIzol试剂提取各组织和细胞的总RNA,反转录为cDNA后行qPCR。qPCR反应条件为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 15 s,循环40次。使用2-ΔΔCt法计算mRNA的相对表达量。
1.5 蛋白质印迹法检测USP22蛋白的表达使用RIPA裂解缓冲液提取H460细胞总蛋白。按BCA试剂盒说明书测定蛋白浓度。取总蛋白行SDS-PAGE分离并转移到PVDF膜上,室温下浸入5%非脂肪乳封闭1 h。4 ℃条件下分别使用抗USP22一抗(1:200)、抗SIRT1一抗(1:500)、抗p53一抗(1:1 000)、抗磷酸化STAT3一抗(1:1 000)孵育过夜。加入辣根过氧化物酶标记的二抗(1:1 000)室温孵育2 h,运用ECL法观察蛋白条带。
1.6 MTT法检测细胞增殖能力取对数生长期细胞,以2×103/孔的密度接种到96孔板。于培养后24、48、72、96、120 h时加入0.5 mg/mL MTT溶液20 μL,37 ℃孵育4 h。加150 μL DMSO终止反应,在酶联免疫检测仪上检测570 nm处各孔的光密度(D)值。重复实验3次。
1.7 流式细胞术检测细胞周期与凋亡细胞凋亡分析:转染细胞48 h后,用胰蛋白酶处理细胞,并使用结合缓冲液再悬浮细胞使细胞密度为1×106 /mL。用100 μL的标记溶液[(含FITC-Annexin Ⅴ和碘化乙啶(propidium iodide, PI)的孵育缓冲液,终浓度均为1 μg/mL]重悬细胞,室温下避光孵育10~15 min,上流式细胞仪检测凋亡细胞比例。所有实验均重复3次。细胞周期分析:转染细胞48 h后常规胰酶消化,固定在70%乙醇中,PBS洗1次,然后加入150 μL RNaseA(250~500 μg/mL PBS稀释)重悬细胞,37 ℃消化30 min。加入150 μL PI工作液,4 ℃避光染色30 min。上流式细胞仪测定PI染色情况,用Cell Quest软件计算细胞周期各时相细胞的百分比。
1.8 荧光素酶报告分析验证miR-30e-5p在USP22的结合位点提取细胞总RNA,按反转录试剂盒操作说明反转录成cDNA。以cDNA为模板行PCR扩增,具体条件为:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共25个循环。将纯化后的PCR产物行Sac Ⅰ与Xho Ⅰ双酶切后连接入pmirGlo载体并转化大肠杆菌DH5α,挑取单克隆并用Sac Ⅰ与Xho Ⅰ行双酶切鉴定。获取酶切鉴定正确的克隆序列,得重组质粒USP22-WT。取上述序列与miR-30e-5p中的结合位点按KOD-plus定点突变试剂盒说明书进行点突变并人工合成之后连接入pmirGlo载体,得重组载体USP22-MUT。将构建好的靶分子真核表达载体USP22-WT、USP22-MUT与miR-30e-5p模拟物或miR-30e-5p抑制物共转染H460细胞,每孔分别转染重组质粒100 ng、miRNA 1 μL和脂质体1 μL,分别以转染相应的对照序列为对照(NC)。转染48 h后吸出培养液并用PBS洗涤2次,37 ℃用50 μL细胞裂解缓冲液裂解细胞20 min;收集裂解后的细胞样品, 10 000×g离心10 min。使用TD 20/20荧光照度计检测不同报告基因间的相对活性。
1.9 裸鼠移植瘤实验将miR-30e-5p模拟物及其对照序列亚克隆到慢病毒表达载体,与psPAX2、PMD2G共转染HEK293T细胞,包装生产慢病毒,然后再以后者感染H460细胞。取雄性BALB/c裸鼠12只,4~6周龄,购自中国科学院上海药物研究所[生产许可证号SCXK(沪)2013-0016,使用许可证号SYXK(沪)2015-0027]。将裸鼠随机分为两组(n=6),消毒皮肤,无菌条件下在双侧下肢髋关节上方皮下分别注射miR-30e-5p过表达或对照空白载体转染的H460细胞悬液(2.5×106/0.2 mL)。恒温、通风、无菌条件下饲养,观察皮下肿瘤生长情况,3周后颈椎脱臼处死裸鼠取瘤测量体积。所有动物维护和实验程序均按照上海交通大学实验动物伦理委员会批准的实验动物健康指南实施。
1.10 统计学处理应用SPSS 13.0软件行数据分析。实验数据以x±s表示,两组间比较采用t检验。相关性分析采用Spearman相关分析。检验水准(α)为0.05。
2 结果 2.1 NSCLC组织中miR-30e-5p和USP22的表达qPCR检测结果(图 1A、1B)显示,miR-30e-5p在肿瘤组织中的表达低于癌旁组织(P < 0.01),而USP22在肿瘤组织中的表达高于癌旁组织(P < 0.01)。蛋白质印迹结果(图 1C)显示,USP22在肿瘤组织中高表达。进一步免疫组化法结果(图 1D)显示增殖细胞核抗原、USP22和SIRT1在NSCLC组织中均呈现高表达。
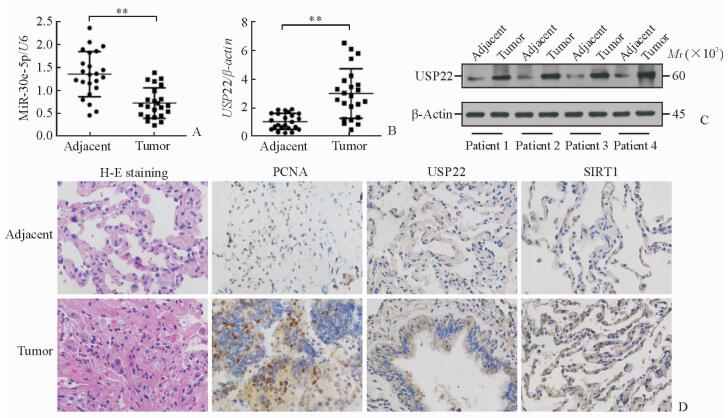
|
图 1 NSCLC组织中miR-30e-5p和USP22的表达 Fig 1 Expressions of miR-30e-5p and USP22 in NSCLC tissues A, B: Relative expressions of miR-30e-5p (A) and USP22 mRNA (B) in 23 pairs of NSCLC and adjacent non-tumor tissues by qPCR; C: Expression of USP22 protein in 4 pairs of NSCLC and adjacent non-tumor tissues by Western blotting; D: NSCLC and adjacent non-tumor tissues by hematoxylin-eosin (H-E) staining, and PCNA, USP22, and SIRT1 expressions by immunohistochemistry staining. miR: MicroRNA; NSCLC: Non-small cell lung cancer; USP22: Ubiquitin-specific protease 22; PCNA: Proliferating cell nuclear antigen; SIRT1: Silent information regulator 1. Original magnification: ×400 (D). **P < 0.01 |
2.2 H460细胞中miR-30e-5p mRNA的表达
与NC相比,转染miR-30e-5p模拟物后H460细胞中miR-30e-5p的表达上调(P < 0.01),而转染miR-30e-5p抑制物后细胞中miR-30e-5p的表达下调(P < 0.01,图 2)。
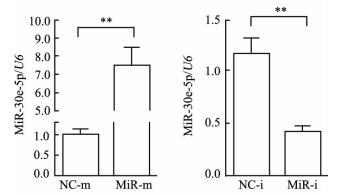
|
图 2 转染miR-30e-5p模拟物和抑制物对H460细胞中miR-30e-5p表达的影响 Fig 2 MiR-30e-5p expression in H460 cells transfected with miR-30e-5p mimic (miR-m) or miR-30e-5p inhibitor (miR-i) NC-m: Negative control mimic; NC-i: Negative control inhibitor. miR: MicroRNA. **P < 0.01. n=3, x±s |
2.3 MiR-30e-5p与USP22的相关性及靶标关系
与NC相比,转染miR-30e-5p模拟物后USP22 mRNA(P < 0.01)和蛋白(0.52±0.03 vs 1.00±0.10,P < 0.01)的表达均下调,而转染miR-30e-5p抑制物后USP22 mRNA(P < 0.01)和蛋白(2.55±0.19 vs 0.98±0.08,P < 0.01)的表达均上调(图 3A、3B)。相关性分析显示USP22与miR-30e-5p呈负相关(P < 0.01,图 3C)。且在线TargetScan显示UGUUUAC为miR-30e-5p的结合序列(图 3D)。荧光素酶基因报告分析结果(图 3E、3F)显示,在转染USP22-MUT荧光素酶的H460细胞中,共转染miR-30e-5p模拟物或miR-30e-5p抑制物的细胞荧光素酶活性与相应NC相比差异均无统计学意义;而在转染USP22-WT荧光素酶的H460细胞中,共转染miR-30e-5p模拟物的细胞荧光素酶活性相比NC下降(P < 0.01),而共转染miR-30e-5p抑制物的细胞荧光素酶活性较NC升高(P < 0.01)。
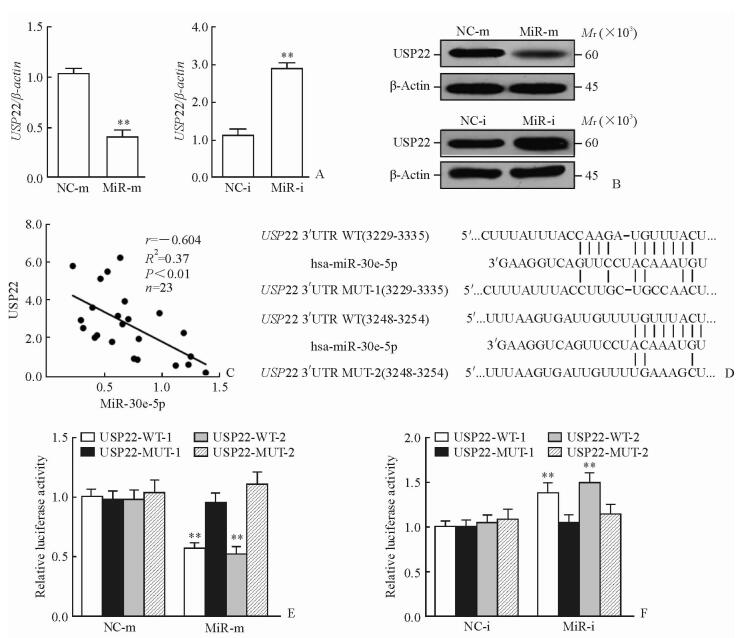
|
图 3 MiR-30e-5p与USP22的相关性及靶标关系 Fig 3 Correlation and target relationship between miR-30e-5p and USP22 A, B: Expressions of USP22 mRNA (A) and protein (B) in H460 cells; C: MiR-30e-5p expression was negatively related to USP22 expression in NSCLC tissues; D: Putative miR-30e-5p binding sites in 3′UTR of USP22; E, F: Relative luciferase activity in H460 cells transfected with wild type (WT) or mutant (MUT) USP22 3′UTR reporter constructs together with miR-30e-5p mimic (miR-m), miR-30e-5p inhibitor (miR-i), and the corresponding negative controls (NCs). miR: MicroRNA. **P < 0.01 vs NC group. n=3, x±s |
2.4 MiR-30e-5p抑制H460细胞增殖和裸鼠体内肿瘤的生长
转染72 h后,miR-30e-5p模拟物组H460细胞的增殖能力较对照组下降,而miR-30e-5p抑制物组H460细胞的增殖能力增加(P < 0.01,图 4A、4B)。裸鼠成瘤实验结果(图 4C、4D)显示,接种miR-30e-5p过表达H460细胞的小鼠肿瘤体积和肿瘤质量均减少(P < 0.01、P < 0.05)。
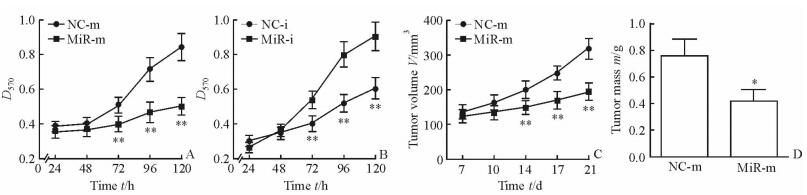
|
图 4 MicroRNA-30e-5p对H460细胞增殖能力和裸鼠肿瘤生长情况的影响 Fig 4 Effect of microRNA-30e-5p on H460 cell proliferation in vitro and tumor growth in nude mice in vivo A, B: Effect of microRNA-30e-5p mimic (miR-m, A) or microRNA-30e-5p inhibitor (miR-i, B) on cell proliferation of H460 cells in vitro by MTT assay (n=3); C, D: Tumor volume (C) and mass (D) in nude mice by xenograft assay (n=6). NC: Negative control.*P < 0.05, **P < 0.01 vs NC group. x±s |
2.5 MiR-30e-5p诱导H460细胞周期阻滞、促进细胞凋亡
对NC相比,转染miR-30e-5p模拟物后G0/G1期H460细胞数目增加,S期细胞数目减少(P < 0.05);而转染miR-30e-5p抑制物后G0/G1期H460细胞数目减少,S期细胞数目升高(P < 0.05,图 5A)。此外,转染miR-30e-5p模拟物增加H460细胞的凋亡率,而转染miR-30e-5p抑制物可减少细胞凋亡(P < 0.05,图 5B)。
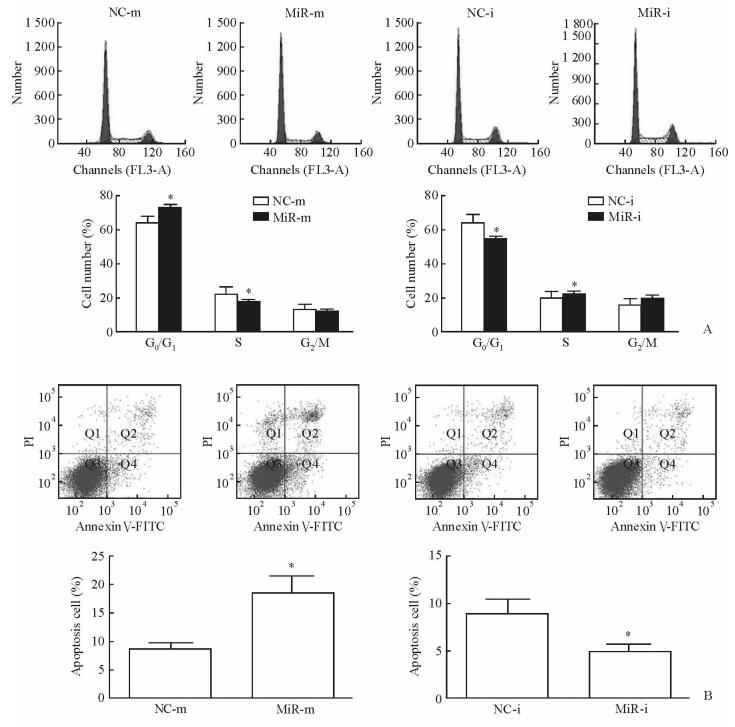
|
图 5 MiR-30e-5p对H460细胞周期及凋亡的影响 Fig 5 Effect of miR-30e-5p on H460 cells cycle and apoptosis by flow cytometry A: Effect of miR-30e-5p mimic (miR-m) and miR-30e-5p inhibitor (miR-i) on cell cycle arrest in H460 cells; B: Effect of miR-m and miR-i on cell apoptosis. miR: MicroRNA; NC: Negative control. *P < 0.05 vs NC group. n=3, x±s |
3 讨论
MiR-30e-5p是一种肿瘤抑制基因,在NSCLC组织中表达下调,研究发现在多发性骨髓瘤中miR-30e-5p靶向作用Wnt/β-catenin/BCL9通路发挥肿瘤抑制功能[5]。然而,它是通过何种机制抑制NSCLC的发生和发展仍未明确。本研究发现,在NSCLC组织中miR-30e-5p表达下调,由此推测miR-30e-5p与NSCLC的发生、发展具有相关性。
USP22是近年来发现的泛素水解酶家族的一个新成员,定位于人17号染色体上,由14个外显子组成,其cDNA包含一个长为1 578 bp的开放阅读框,可编码525个氨基酸,包括半胱氨酸、天冬氨酸、组氨酸和天冬氨酸/天冬酰胺以及泛素水解酶家族去泛素化酶的高度保守区域等。研究表明,USP22参与肿瘤细胞周期相关基因的调控,并与肿瘤细胞增殖密切相关;此外,USP22在肿瘤组织中高表达是预后不良的指标[5]。USP22可促进肿瘤的形成并在不同肿瘤中表达上调,有研究结果显示在大肠癌组织中USP22可通过Bmi-1和p-Akt通路诱导细胞周期的进展[21],其也被证明可通过调控上皮-间质转化(epithelial-mesenchymal transition,EMT)标志物的表达促进EMT[16-18]。然而,USP22基因在NSCLC发展中是否具有关键作用及其具体分子机制如何,目前尚不清楚,而miR-30e-5p是否通过调控USP22激活下游通路的机制,继而影响NSCLC的发生、发展,目前也未见研究报道,因此揭示miR-30e-5p与USP22的关系以及其在NSCLC发生、发展中的具体机制,对于NSCLC的治疗有着重要意义。
本研究结果证明在NSCLC组织中USP22 mRNA及蛋白均呈高表达,而miR-30e-5p则呈相反表达,且两者呈负相关,表明miR-30e-5p可能通过下调USP22影响NSCLC发生、发展。在线TargetScan生物信息学算法结果显示,UGUUUAC是miR-30e-5p在USP22上的特定结合序列,同时荧光素酶报告分析方法结果也证实了NSCLC中miR-30e-5p通过与USP22 3′UTR特异序列结合下调其表达。
细胞的异常增殖和凋亡以及细胞失控在肿瘤的发生、发展中起着重要作用。本研究发现过表达miR-30e-5p可抑制NSCLC细胞株H460的增殖能力;流式细胞术检测结果也发现,过表达miR-30e-5p使G0/G1期H460细胞数目增加,S期细胞数目减少,且细胞凋亡率增加,表明miR-30e-5p可诱导NSCLC细胞的细胞周期阻滞、促进细胞凋亡。以上发现从分子水平证明miR-30e-5p可通过下调USP22抑制NSCLC细胞的生长、阻碍细胞周期的进程、促进细胞凋亡,从而抑制NSCLC的发生和发展。
此外,本研究通过裸鼠成瘤实验证明在裸鼠体内过表达miR-30e-5p可以抑制肿瘤生长,进一步验证了miR-30e-5p的抗肿瘤作用,但其在体内是否是通过下调USP22来发挥作用,尚需进一步实验证实。
综上所述,miR-30e-5p可抑制USP22蛋白的表达,从而抑制NSCLC的发生和发展,上调miR-30e-5p可能是NSCLC治疗的新方法。下一步研究中我们将探究miR-30e-5p调控USP22影响NSCLC发生和发展的可能通路。
| [1] | TORRE L A, BRAY F, SIEGEL R L, FERLAY J, LORTET-TIEULENT J, JEMAL A. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65: 87–108. DOI: 10.3322/caac.21262 |
| [2] | GOLDSTRAW P, BALL D, JETT J R, LE CHEVALIER T, LIM E, NICHOLSON A G, et al. Non-small-cell lung cancer[J]. Lancet, 2011, 378: 1727–1740. DOI: 10.1016/S0140-6736(10)62101-0 |
| [3] | HE L, HANNON G J. MicroRNAs:small RNAs with a big role in gene regulation[J]. Nat Rev Genet, 2004, 5: 522–531. DOI: 10.1038/nrg1379 |
| [4] | SOTIROPOULOU G, PAMPALAKIS G, LIANIDOU E, MOURELATOS Z. Emerging roles of microRNAs as molecular switches in the integrated circuit of the cancer cell[J]. RNA, 2009, 15: 1443–1461. DOI: 10.1261/rna.1534709 |
| [5] | ZHAO J J, LIN J, ZHU D, WANG X, BROOKS D, CHEN M, et al. miR-30-5p functions as a tumor suppressor and novel therapeutic tool by targeting the oncogenic Wnt/β-catenin/BCL9 pathway[J]. Cancer Res, 2014, 74: 1801–1813. DOI: 10.1158/0008-5472.CAN-13-3311-T |
| [6] | NING J, ZHANG J, LIU W, LANG Y, XUE Y, XU S. Overexpression of ubiquitin-specific protease 22 predicts poor survival in patients with early-stage non-small cell lung cancer[J/OL]. Eur J Histochem, 2012, 56:e46. doi:10.4081/ejh.2012.e46. |
| [7] | LI Y, YANG Y, LI J, LIU H, CHEN F, LI B, et al. USP22 drives colorectal cancer invasion and metastasis via epithelial-mesenchymal transition by activating AP4[J]. Oncotarget, 2017, 8: 32683–32695. |
| [8] | TANG B, TANG F, LI B, YUAN S, XU Q, TOMLINSON S, et al. High USP22 expression indicates poor prognosis in hepatocellular carcinoma[J]. Oncotarget, 2015, 6: 12654–12667. DOI: 10.18632/oncotarget.v6i14 |
| [9] | MARKOU A, SOURVINOU I, VORKAS P A, YOUSEF G M, LIANIDOU E. Clinical evaluation of microRNA expression profiling in non small cell lung cancer[J]. Lung Cancer, 2013, 81: 388–396. DOI: 10.1016/j.lungcan.2013.05.007 |
| [10] | ZHU J, ZENG Y, XU C, QIN H, LEI Z, SHEN D, et al. Expression profile analysis of microRNAs and downregulated miR-486-5p and miR-30a-5p in non-small cell lung cancer[J]. Oncol Rep, 2015, 34: 1779–1786. DOI: 10.3892/or.2015.4141 |
| [11] | WANG Y, CHEN J, LIN Z, CAO J, HUANG J, JIANG Y, et al. Role of deregulated microRNAs in non-small cell lung cancer progression using fresh-frozen and formalin-fixed, paraffin-embedded samples[J]. Oncology letters, 2016, 11: 801–808. |
| [12] | ZHANG X Y, PFEIFFER H K, THOME A W, McMAHON S B. USP22, an hSAGA subunit and potential cancer stem cell marker, reverses the polycomb-catalyzed ubiquitylation of histone H2A[J]. Cell Cycle, 2008, 7: 1522–1524. DOI: 10.4161/cc.7.11.5962 |
| [13] | NING Z, WANG A, LIANG J, XIE Y, LIU J, FENG L, et al. USP22 promotes the G1/S phase transition by upregulating FoxM1 expression via β-catenin nuclear localization and is associated with poor prognosis in stage Ⅱ pancreatic ductal adenocarcinoma[J]. Int J Oncol, 2014, 45: 1594–1608. DOI: 10.3892/ijo.2014.2531 |
| [14] | HE Y, JIN Y J, ZHANG Y H, MENG H X, ZHAO B S, JIANG Y, et al. Ubiquitin-specific peptidase 22 overexpression may promote cancer progression and poor prognosis in human gastric carcinoma[J]. Trans Res, 2015, 165: 407–416. DOI: 10.1016/j.trsl.2014.09.005 |
| [15] | HU J, LIU Y L, PIAO S L, YANG D D, YANG Y M, CAI L. Expression patterns of USP22 and potential targets BMI-1, PTEN, p-AKT in non-small-cell lung cancer[J]. Lung Cancer, 2012, 77: 593–599. DOI: 10.1016/j.lungcan.2012.05.112 |
| [16] | HU J, YANG D, ZHANG H, LIU W, ZHAO Y, LU H, et al. USP22 promotes tumor progression and induces epithelial-mesenchymal transition in lung adenocarcinoma[J]. Lung Cancer, 2015, 88: 239–245. DOI: 10.1016/j.lungcan.2015.02.019 |
| [17] | TAN T Z, MIOW Q H, MIKI Y, NODA T, MORI S, HUANG R Y, et al. Epithelial-mesenchymal transition spectrum quantification and its efficacy in deciphering survival and drug responses of cancer patients[J]. EMBO Mol Med, 2014, 6: 1279–1293. DOI: 10.15252/emmm.201404208 |
| [18] | LIANG L, SUN H, ZHANG W, ZHANG M, YANG X, KUANG R, et al. Meta-analysis of EMT datasets reveals different types of EMT[J/OL]. PLoS One, 2016, 11:e0156839. doi:10.1371/journal.pone.0156839. |
| [19] | TANG B, LIANG X, TANG F, ZHANG J, ZENG S, JIN S, et al. Expression of USP22 and survivin is an indicator of malignant behavior in hepatocellular carcinoma[J]. Int J Oncol, 2015, 47: 2208–2216. DOI: 10.3892/ijo.2015.3214 |
| [20] | DING F, BAO C, TIAN Y, XIAO H, WANG M, XIE X, et al. USP22 promotes NSCLC tumorigenesis via MDMX up-regulation and subsequent p53 inhibition[J]. Int J Mol Sci, 2014, 16: 307–320. DOI: 10.3390/ijms16010307 |
| [21] | LIN Z, YANG H, KONG Q, LI J, LEE S M, GAO B, et al. USP22 antagonizes p53 transcriptional activation by deubiquitinating Sirt1 to suppress cell apoptosis and is required for mouse embryonic development[J]. Mol Cell, 2012, 46: 484–494. DOI: 10.1016/j.molcel.2012.03.024 |
 2017, Vol. 38
2017, Vol. 38


