2. 第二军医大学长征医院药学部, 上海 200003
2. Department of Pharmacy, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
丙戊酸钠(sodium valproate,VPA)是临床常用的一线广谱抗癫癎药物,对各种类型癫癎均有治疗作用[1],其作用机制与γ-氨基丁酸(γ-aminobutyric acid,GABA)有关,通过增加脑内抑制性神经递质GABA的含量,降低神经元兴奋性,从而控制癫癎的发作[2]。VPA在体内药代动力学过程复杂,治疗窗窄,有效血药浓度范围是50~100 μg/mL,个体吸收代谢差异较大,中毒症状与癫癎发作症状相似,临床给药剂量难以确定,因此需要进行血药浓度监测来保证其治疗的安全、有效性[3]。群体药代动力学(population pharmacokinetics,PPK)是将经典的药代动力学模型与群体统计学模型相结合,分析药代动力学特性中存在的变异性,研究药物体内过程的群体规律、药动学参数的统计分布及其影响因素[4]。PPK研究是设计个体化治疗方案的有效方法,是在患者群体中进行治疗药物人体内过程的研究。PPK研究的最大优点是其可采用临床常规监测中分散的血药浓度数据进行群体分析,定量描述患者群体中治疗药物的体内过程[5-7]。本研究通过非线性混合效应模型获取VPA的PPK参数,为临床医师调整癫癎患者VPA的给药方案及提高临床疗效提供可靠依据。
1 对象和方法 1.1 研究对象选取2012年10月至2014年12月在第二军医大学长征医院做过VPA血药浓度监测的住院癫癎患者69例,所有患者连续用抗癫癎药物2周以上(血药浓度达到稳态),患者的年龄、体质量不限,用药前癫癎患者检查肝肾功能正常。
1.2 药品注射用丙戊酸钠(商品名:德巴金,赛诺菲杭州制药有限公司),丙戊酸钠片(批号:120326,湖南省湘中制药有限公司)。
1.3 基础模型的建立 1.3.1 基本结构模型的建立本研究每位患者收集1~7个血药浓度点,经高效液相色谱-串联质谱联用技术(LC-MS/MS)[8]检测后以VPA血药浓度数据结果为基础,采用Phoenix NLME软件(美国Centara公司)中的一级条件评估法(FOCE-ELS)对VPA数据进行拟合,构建PPK模型。VPA属于一级吸收和一级消除的一房室开放模型[9-10]。根据文献,吸收速率常数(Ka)对清除率(clearance,CL)的估算影响很小,本次研究固定值为2.38[11]。
1.3.2 随机误差效应模型的建立选择指数型误差模型对个体间变异进行解释:Pi = TvP·exp(ηi),Pi为第i个个体的药物动力学参数,TvP为群体典型值,ηi为第i个个体的个体间变异。
1.3.3 随机残差效应模型的建立解释个体内变异,依次尝试加和型、比例型、混合型误差模型对残留效应的影响,从目标函数值(objective function value,OFV)的变化、模型拟合的预测值与观测值的拟合程度、所估算参数的合理性以及拟合的图形效果等方面选择合适的残差模型,构建基础结构模型。
1.4 PPK模型的建立 1.4.1 固定效应模型的建立在基础模型中引入协变量,选择有显著影响的协变量进而构建全量模型。本研究拟纳入到模型中的协变量包括人口统计学资料、合并用药(卡马西平)。协变量分为连续型(如年龄、体质量等)和非连续型(如性别、合并用药等)。可以采用线性、指数以及幂函数等方式将协变量引入到模型中。
1.4.2 全量回归模型的建立协变量能否纳入到模型中取决于协变量在模型中对药动学参数的影响是否具有统计学差异和临床意义。应用非线性最小二乘法原理,Phoenix NLME软件程序将拟合过程中最大似然值对数(log likelihood,LL)的-2倍(-2LL)作为目标函数。如模型有相互衍生关系,OFV值变化基本符合自由度(df)为n的χ2分布(n为参数的个数差)。当协变量引入模型中(n=1),OFV的差值(即ΔOFV)大于3.84,则P < 0.05或当协变量引入模型中(n=2),ΔOFV >5.99,P < 0.05,差异有统计学意义,协变量可保留在模型中。协变量筛选完成后,将差异有统计学意义的协变量整合至模型中,完成全量模型的构建。
1.4.3 最终模型的建立全量模型建立后,需采用逐步剔除法检验每一个已经入选的协变量是否具有统计学意义。在剔除协变量时选用更为严格的标准。当df=1时,ΔOFV < 6.635,则P < 0.01,说明差异有统计学意义,该变量不可剔除。所有全量模型的协变量筛选完成后,保留差异有统计学意义的协变量,完成最终模型的构建。
1.4.4 最终模型的验证采用常用的自举法对最终模型进行验证及评价。
2 结果 2.1 一般统计结果本研究共纳入住院癫癎患者69例,其中男40例,女29例,有效监测VPA血药浓度样本量为101个;患者年龄11~93岁,中位年龄47岁,平均年龄为(45.84±21.9)岁;体质量39~80 kg,平均体质量为(60.19±11.7) kg。住院癫癎患者不同时间点血药浓度检测结果见图 1。
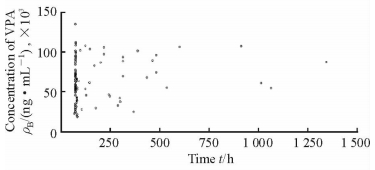
|
图 1 69例癫癎患者的VPA血药浓度散点图 Fig 1 Scatter diagram of dodium valproate (VPA) plasma concentrations of 69 patients with epilepsy in different time |
2.2 基础模型与随机模型的选择
最终选择一级吸收和一级消除的一房室开放模型作为基础模型。应用Phoenix NLME软件尝试加和型、比例型、混合型误差模型对残留效应的影响,从OFV模型拟合的预测值与观测值的拟合程度等方面选择适合的残差模型,结果发现比例模型的个体权重残差值大多介于-2和2之间,比例型残差模型目标函数OFV(-2LL)最小,变异系数(CV)也最小,模型拟合度最优。因此,选择比例型残差模型作为随机残差效应模型,结果见图 2。
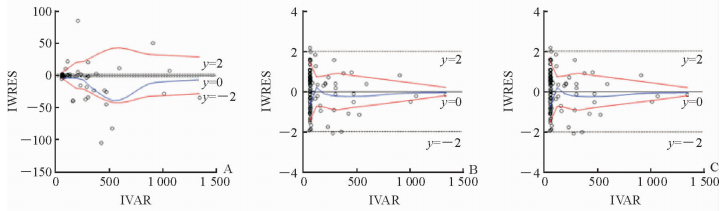
|
图 2 个体权重残差(IWRES)对独立变量(IVAR)的散点图 Fig 2 Scatter diagram of individual weights residual (IWRES) to independent variable (IVAR) A: Additive type; B: Proportional type; C: Mixed type. The blue line indicates regression curve of LOESS, while the red line stands for the distribution curve and the mirror image of reserved error absolute value |
2.3 最终PPK模型的建立
在基础模型的基础上将性别、年龄、体质量、合并用药等协变量通过逐步法引入,引入方式以线性、指数、幂函数等方式进行考察,初步结果显示性别、年龄、体质量、合并用药等协变量均不能使目标函数OFV降低到合适的水平(P < 0.05)。协变量与CL的散点图见图 3。

|
图 3 连续变量对随机误差的散点图 Fig 3 Scatter diagram of continuous covariates and random error A, B: Interindividual variation of clearance rate (ηCL); C, D: Interindividual variation of apparent volume of distribution (ηV) |
2.4 最终模型的确定
经过多次尝试,性别、年龄、体质量、合并用药等协变量均不能使目标函数OFV降低到合适的水平(P < 0.05),协变量无法引入到最终模型中,最终模型确定与基础模型一致。通过比较条件权重残差的分位数散点图,结果发现条件权重残差大致呈正态分布,没有出现很大偏倚。结果见图 4。
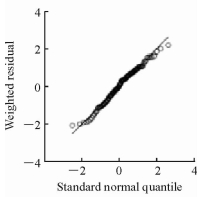
|
图 4 条件权重残差的分位数对标准正态分位数的散点图 Fig 4 Scatter diagram of standard normal quantile and conditional weighted residual |
条件权重残差对时间(独立变量,independent variable,IVAR)的散点图及条件权重残差对群体预测值的散点图分别见图 5A和图 5B,结果显示模型拟合理想。通过对观测值与群体预测值及个体预测值之间做相关性分析,结果(图 6)发现观测值与群体预测值及个体预测值间有良好的相关性,表明该模型能较好的拟合观测值。
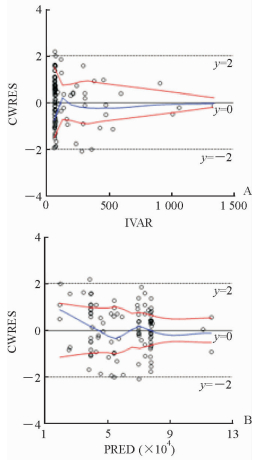
|
图 5 CWRES对IVAR(A)及PRED(B)的散点图 Fig 5 Scatter diagram of CWRES to IVAR(A) and PRED(B) CWRES: Conditional weight residual; IVAR: Independent variable; PRED: Population predication. The blue line indicates regression curve of LOESS, while the red line stands for the distribution curve and the mirror image of reserved error absolute value |
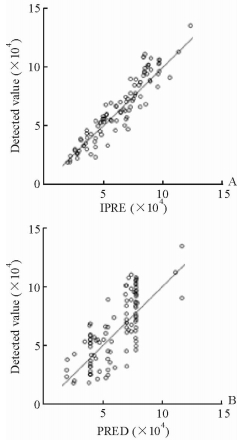
|
图 6 观测值对个体预测值(IPRE, A)及群体预测值(PRED, B)的散点图 Fig 6 Scatter diagram of observed value to individual prediction (IPRE, A) and population prediction (PRED, B) |
最终模型如下:TvKa=2.38,V=TvV,CL=TvCL·exp(ηCL),其中η表示随机误差(即个体间变异),其值服从以0为中心、ω2为方差的正态分布,ω2为0.057 979。建立最终PPK模型,模型中各参数及参数变异估计值见表 1。
|
|
表 1 VPA的最终PPK参数表 Tab 1 Parameters of VPA in final PPK model |
2.5 PPK最终模型的验证
采用自举法对最终模型进行验证及评价。自举500次,稳健率100%,得到的参数平均值、中位数均与模型参数结果一致,说明模型比较稳定,结果见表 2。
|
|
表 2 自举法验证模型的参数表 Tab 2 Parameters of VPA by Bootstraps |
3 讨论
本研究采用PPK中的NONMEM法对癫癎患者稀疏的血药浓度监测数据进行分析,收集69例住院癫癎患者采用LC-MS/MS检测的101个血药浓度点,使用质控样本保证检测数据的准确性,以查看病历、药历及电话随访的形式,记录了解69例患者的基本信息,如性别、年龄、体质量、给药时间、给药剂量、联合用药等;用已建立LC-MS/MS法检测癫癎患者血浆VPA及其3个代谢产物的血药浓度的方法,该方法快速、简便、准确[11],应用Phoenix NLME软件定量考察影响VPA代谢的因素,经过多次模型拟合和尝试得出的最终模型与基础模型一致。采用自举法验证模型的可靠性,自举500次验证,结果显示所建模型的稳健率为100%,各项参数值都在95%置信区间内,得到的参数平均值、中位数均与模型参数结果一致,说明模型比较稳定。
Jiang等[12]研究结果表明,随着年龄的增长VPA的清除率逐渐降低。胡敏等[13]用NONMEM法定量考察联合用药、体质量和日剂量等因素对VPA清除率的影响,结果发现VPA日剂量>1.3 g或联合使用卡马西平等可使VPA的清除率增加。Correa等[14]研究结果显示,联合使用酶诱导剂苯妥英钠可使VPA的清除率增加28.9%。Fattore等[15]研究结果表明,老年人对VPA的清除率与年龄、给药剂量、合并用酶诱导剂有关。Lin等[16]研究结果表明,联用苯妥英钠时VPA的清除率增加11%,联用卡马西平时VPA的清除率增加36%。以上相关VPA的PPK分析都相应地引入了协变量,大多研究结果显示体质量、年龄、合并用药影响VPA的清除率。而本研究建立PPK模型将相关协变量引入模型中时,结果显示协变量降低模型的值差异无统计学意义。建议下一步深入研究时加大样本量,尽可能将男女比例控制在1:1,以便将协变量引入模型。
| [1] | 李新林, 赵明明, 姜力, 肇丽梅. 丙戊酸群体药代动力学研究进展[J]. 实用药物与临床, 2014, 17: 345–349. |
| [2] | OGUNGBENRO K, AARONS L; CRESim & Epi-CRESim Project Groups. A physiologically based pharmacokinetic model for valproic acid in adults and children[J]. Eur J Pharm Sci, 2014, 63: 45–52. DOI: 10.1016/j.ejps.2014.06.023 |
| [3] | 梅艳, 汪洋, 宋新文, 彭静, 周军. 癫癎患儿丙戊酸钠血药浓度监测结果回顾分析[J]. 中国现代应用药学, 2011, 28: 174–177. |
| [4] | 陈荣. 抗癫癎药物群体药动学模型及其临床应用的研究进展[J]. 中国民康医学, 2012, 24: 2021–2022. DOI: 10.3969/j.issn.1672-0369.2012.16.066 |
| [5] | 张仲斌, 吴晔, 季双敏, 臧丽丽, 王颖慧, 王云秀, 等. 不同年龄组中国癫癎患儿丙戊酸群体药代动力学模型的建立[J]. 中华实用儿科临床杂志, 2014, 29: 698–703. |
| [6] | 焦正, 钟明康, 胡敏, 施孝金, 李中东, 张静华, 等. 丙戊酸清除率的群体药动学模型的建立[J]. 中国医院药学杂志, 2004, 24: 515–517. DOI: 10.3321/j.issn:1001-5213.2004.09.002 |
| [7] | 王化明, 赖萍, 谢娟. 用NONMEM法建立癫癎患者丙戊酸群体药代动力学模型[J]. 今日药学, 2012, 22: 1–6. |
| [8] | GAO S, MIAO H, TAO X, JIANG B, XIAO Y, CAI F, et al. LC-MS/MS method for simultaneous determination of valproic acid and major metabolites in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879: 1939–1944. DOI: 10.1016/j.jchromb.2011.05.022 |
| [9] | EVANS W E, RELLING M V. Pharmacogenomics:translating functional genomics into rational therapeutics[J]. Science, 1999, 286: 487–491. DOI: 10.1126/science.286.5439.487 |
| [10] | JIANG D, BAI X, ZHANG Q, LU W, WANG Y, LI L, et al. Effects of CYP2C19 and CYP2C9 genotypes on pharmacokinetic variability of valproic acid in Chinese epileptic patients:nonlinear mixed-effect modeling[J]. Eur J Clin Pharmoacol, 2009, 65: 1187–1193. DOI: 10.1007/s00228-009-0712-x |
| [11] | WADE J R, KELMAN A W, HOWIE C A, WHITING B. Effect of misspecification of the absorption process on subsequent parameter estimation in population analysis[J]. J Pharmacokinet Biopharm, 1993, 21: 209–222. DOI: 10.1007/BF01059771 |
| [12] | JIANG D C, WANG L, WANG Y Q, LI L, LU W, BAI X R. Population pharmacokinetics of valproate in Chinese children with epilepsy[J]. Acta Pharmacol Sin, 2007, 28: 1677–1684. DOI: 10.1111/aphs.2007.28.issue-10 |
| [13] | 胡敏, 张静华, 孙鹤, 施孝金, 俞丽云, 钟明康. NONMEM法估算3种抗癫癎药对丙戊酸相对清除率的影响[J]. 中国药学杂志, 2002, 37: 201–205. DOI: 10.3321/j.issn:1001-2494.2002.03.015 |
| [14] | CORREA T, RODRIGUEZ I, ROMANO S. Population pharmacokinetics of valproate in Mexican children with epilepsy[J]. Biopharm Drug Dispos, 2008, 29: 511–520. DOI: 10.1002/bdd.v29:9 |
| [15] | FATTORE C, MESSINA S, BATTINO D, CROCI D, MAMOLI D, PERUCCA E. The influence of old age and enzyme inducing comedication on the pharmacokinetics of valproic acid at steady-state:a case-matched evaluation based on therapeutic drug monitoring data[J]. Epilepsy Res, 2006, 70(2/3): 153–160. |
| [16] | LIN W W, JIAO Z, WANG C L, WANG H Y, MA C L, HUANG P F, et al. Population pharmacokinetics of valproic acid in adult Chinese epilepsy patients and its application in an individualized dosage regimen[J]. Ther Drug Monit, 2015, 37: 76–83. DOI: 10.1097/FTD.0000000000000100 |
 2017, Vol. 38
2017, Vol. 38


