随着社会经济的发展和生活方式的改变,心血管疾病已经成为导致发达国家和发展中国家人民死亡的主要病因之一。低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)是心血管疾病发展的独立危险因素,降低LDL-C对防治心血管事件具有重要意义[1]。在过去的20年里,使用他汀类药物降低LDL-C已经成为降低心血管疾病患病率和死亡率的主要方法。然而,他汀类药物存在着疗效和耐受性等方面的不足。部分患者,如家族性高胆固醇血症的患者,即使服用可耐受的最大剂量他汀类药物,LDL-C仍不能达到目标值[2]。其次,一些患者由于各种原因根本不能耐受或者仅能服用小剂量他汀类药物。此外,由于不良反应等原因,约12%服用他汀类药物的患者不能坚持长期服药[3]。因此,急需寻找新的降胆固醇药物。人类前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)是一种新发现的前蛋白转化酶(proprotein convertases,PCs),可促进低密度脂蛋白受体(low-density lipoprotein receptor, LDLR)降解,从而使血LDL-C升高。PCSK9抑制剂可减少细胞表面LDLR降解,增加LDL-C摄取,具有降低血LDL-C的作用,还可增加他汀类药物的疗效,可望成为一类新的降LDL-C药物。
1 PCSK9的分子生物学基础2003年,Seidah等首先发现PCSK9基因。此后不久,Abifadel等[4]发现PCSK9突变可导致家族性高胆固醇血症。PCSK9属于PCs。PCs是一类Ca2+依赖的丝氨酸内切酶,目前为止,该家族在哺乳类动物中共有9个成员,分别是PC1/3、PC2、弗林蛋白酶(Furin)、PC4、PC5/6、PACE4和PC7以及2个非碱性氨基酸特异性的转化酶SKI-1/S1P和NARC-1/PCSK9[5]。PCs的结构分为信号肽、前肽区、催化区、中间区和胞质区。
PCSK9基因可编码692个氨基酸。在最初合成时,PCSK9是一种相对分子质量为73 000的酶原,主要由信号肽、前片段、催化结构域以及富含半胱氨酸和组氨酸的羧基末端结构域组成。PCSK9通过在Val-Phe-Ala-Gln↓Ser-Ile-Pro处进行分子内自剪切形成了一个相对分子质量为14 000的前片段和一个相对分子质量为63 000的成熟PCSK9。剪切后的前片段仍然与其催化区非共价连接。分泌的PCSK9作为分子伴侣而不是酶发挥作用[6]。到目前为止,PCSK9作为内切酶的底物只有它自身。
2 PCSK9在胆固醇代谢中的作用 2.1 PCSK9与LDLRPCSK9调节LDLR降解有细胞外途径和细胞内途径两种方式,前者是主要途径。细胞外途径中,PCSK9从反面高尔基体管网状结构(trans-Golgi network,TGN)中分泌出胞,与LDLR结合后内吞至内体,最后在溶酶体中被降解[7]。细胞内途径中,从TGN直接分泌至细胞质的PCSK9与LDLR在细胞内结合,进入溶酶体降解[8](图 1)。PCSK9-LDLR经溶酶体降解的途径并不涉及泛素化,也与蛋白酶体和自噬途径无关[9]。PCSK9可以形成二聚体或三聚体发挥作用,这使其促LDLR降解活性明显增强[10]。
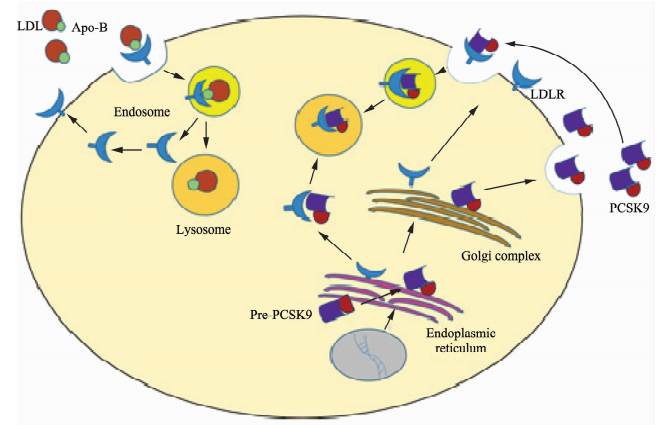
|
图 1 PCSK9调节肝脏LDLR Fig 1 Regulation of hepatic LDLR expression by PCSK9 The major part of circulating LDL-C is removed from the plasma by hepatic uptake, which is mediated via transmembrane LDLR that internalizes bound LDL particles by endocytosis; PCSK9 undergoes intramolecular autocatalytic processing in the endoplasmic reticulum to form a prodomain and mature PCSK9.And then autocatalytic prodomain closely attaches to the catalytic domain of PCSK9. PCSK9 is secreted in plasma, where it binds the epidermal growth factor-like domain of the LDLR. The LDLR-PCSK9 complex in both intracellular and extracellular PCSK9 is directed to lysosomal degradation. LDL: Low-density lipoprotein; LDL-C: Low-density lipoprotein-cholesterol; Apo-B: Apolipoprotein-B; PCSK9: Proprotein convertase subtilisin/kexin type 9; LDLR: Low-density lipoprotein receptor |
PCSK9除了促进LDLR的降解外,也可以在内质网中与LDLR相互作用。研究发现,在内质网中,PCSK9以分子伴侣的形式与LDLR结合,促进LDLR向高尔基体转运并在高尔基体中获得其成熟所需的碳水化合物残基。另一方面,与LDLR的结合有助于PCSK9前体的自我剪切[11]。
2.2 PCSK9与载脂蛋白E受体2(apolipoprotein E receptor 2,ApoER2)和VLDL受体(very low-density lipoprotein receptor,VLDLR)与LDLR相似,ApoER2和VLDLR含有一个高度保守的表皮生长因子样结构域A(epidermal growth factor-like domain A,EGF-A)。PCSK9可促进这两种受体的降解,而且这种作用并不依赖于LDLR。ApoER2存在于中枢神经系统、睾丸和胎盘中,VLDLR存在于游离脂质丰富的组织,如脑和心脏等。抑制PCSK9会增加这两种受体的数量,对于ApoER2而言这可能有助于保护脑血管[12],而对于VLDLR而言,这可能会增加脂肪细胞对脂质的摄取[13]。
2.3 PCKS9与LDLR相关蛋白1(LDLR-related protein 1, LRP1)LRP1是一种结构和功能与LDLR高度相似的LDLR家族成员,可与至少40种配体结合。LRP1参与吞噬细胞清除细菌毒素和凋亡细胞碎片等颗粒过程中的运输和溶酶体降解,对炎性反应具有调节作用[14]。PCSK9参与LRP1的降解。研究显示,在感染性休克小鼠模型中,PCSK9敲除或使用PCSK9抑制剂可明显改善预后;脓毒败血症的临床回顾性研究证据也显示,PCSK9活性与炎性反应、生存率之间存在相关关系[15]。
2.4 PCSK9与CD36作为脂质转运蛋白,CD36在多种组织细胞中高表达。体外实验发现,PCSK9对CD36的调节作用因细胞种类而异。在小肠上皮细胞系中,PCSK9可以上调CD36表达,促进食物性胆固醇的摄取[16];在肝细胞和肾脏细胞系中,PCSK9可直接诱发LDLR非依赖性的CD36降解;在小鼠脂肪细胞中,PCSK9可促进CD36降解。PCSK9敲除可增强肝脏和脂肪组织的脂肪酸摄取能力、升高肝脏三酰甘油水平[17]。
3 PCSK9基因表达的转录调节机制参与PCSK9基因转录调节的转录因子和共作用分子主要包括固醇调节元件结合蛋白2(sterol response element binding protein 2, SREBP2)、肝细胞核因子(hepatocyte nuclear factor, HNF)1α等。
3.1 SREBP2SREBP2主要调节与固醇合成和摄取相关基因的表达,包括固醇合成的限速酶3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methyl glutary coenzyme A,HMG-CoA)还原酶、LDLR和PCSK9等。在细胞内低胆固醇水平的状态下,SREBP经过蛋白水解变成活性形式[18]。他汀类药物通过抑制HMG-CoA还原酶抑制胆固醇合成,从而激活SREBP2、上调肝脏LDL表达和对血清LDL-C的摄取。但SREBP2激活导致PCSK9水平升高,使LDLR降解增加,从而削弱了他汀类药物的作用[19]。研究表明,SREBP2通过PCSK9启动子区域的固醇调节元件(sterol regulatory element,SRE)发挥作用[20]。SREBP2同时激活PCSK9和LDLR,使PCSK9作为一种对抗的机制参与SREBP2调节通路,与LDLR共同维持细胞内胆固醇的稳态。另外,SREBP1也可激活PCSK9基因转录,在肝脏中主要是SREBP2对PCSK9起调节作用[20]。
3.2 HNF1αPCSK9近端启动子有3个高度保守的序列:SRE1、SP1和HNF1α结合位点,其中HNF1α位点位于SP1与SRE1之间。除SREBP2以外,HNF1α对PCSK9的基因转录也具有重要的激活作用,并且二者有协同作用;而SP1对PCSK9的调节作用较弱[20]。HNF1有HNF1α和HNF1β两种亚型,调节PCSK9的主要是HNF1α[21]。黄连素可通过降低SREBP2和HNF1α的活性下调PCSK9表达[21],而胰岛素可通过雷帕霉素复合体1(mammalian target of rapamycin complex 1,mTORC1)信号通路下调HNF1含量,从而降低PCSK9的转录[22]。最近的研究发现,用雌激素或者特定的兴奋剂激活G蛋白偶联雌激素受体1(G protein-coupled estrogen receptor 1, GPER1)可通过HNF1α途径降低PCSK9转录及蛋白表达,但对LDLR的mRNA表达没有影响,从而增加了LDLR含量及其对LDL-C的摄取[23],这可能与携带GPER获能性突变女性的LDL-C水平较低有关。
3.3 其他调节因子过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)可以通过抑制PCSK9基因转录以及增加弗林蛋白酶/PC5/6来抑制PCSK9,而PPARγ则可增加PCSK9在肝细胞中的表达。其他可以抑制PCSK9的有法尼醇X受体(farnesoid X receptor,FXR)和长寿蛋白1/6(sirtuins 1/6,SIRT1/6);对PCSK9有促进作用的有肝X受体(liver X receptor, LXR)、组蛋白核因子P(histone nuclear factor P,HINFP)、脂肪组织源性脂肪因子和抵抗素等。
4 PCSK9基因突变与胆固醇代谢PCSK9突变对胆固醇代谢的影响可以分为功能获得性突变(gain of function, GOF)和功能缺失性突变(loss of function, LOF)。在转基因小鼠中过表达人PCSK9可引起高胆固醇血症[24],而PCSK9基因敲除小鼠的LDL-C水平很低[4]。在PCSK9无义突变人群中,血LDL-C水平下降了40%[25]。Y142X和C679X是PCSK9的两种主要LOF变异类型, 表现出家族性低LDL-C水平,提示是LOF[25]。另外一些研究鉴定出了罕见的错义和非编码PCSK9 LOF变异,它们也表现出较低的LDL-C水平[26]。在一项关于社区动脉粥样硬化危险因素的研究中,发现携带PCSK9 LOF变异的人群中,血LDL-C水平较无变异者低40%,15年的随访中,这些携带PCSK9变异基因的人患冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CHD)的风险下降了约88%[27]。这种PCSK9 LOF变异与低LDL-C之间的关系以及低LDL-C与CHD之间的关系,使得PCSK9成为一个潜在的药物靶点[28]。
人类PCSK9的GOF变异通过多种特有的机制在分子水平上发挥作用,但最终都会导致PCSK9的表达量或者活性增加,并增加LDLR的降解[29]。同样,LOF变异也会导致循环中PCSK9水平降低,肝细胞表面LDLR密度增加。LOF变异主要出现在蛋白质的催化区,但也有报道会出现在前结构域、C端和P-结构域[30-31]。这种变异大多会降低或者抑制PCSK9合成,或者阻断运输导致分泌减少[31]。例如,Y142X变异会导致无义介导的RNA衰变, L253F会阻碍PCSK9的自剪切,抑制其分泌[14]。PCSK9 LOF变异会降低循环中的PCSK9含量,阻止或者减弱其与LDLR的相互作用,减少LDLR在溶酶体中的降解,增加了LDLR的循环次数和寿命,并降低循环LDL-C水平[29]。虽然GOF变异在人群中很少出现,但对家族性和杂合子的GOF变异研究显示,这些携带者早期发生CHD的危险增加。而极其稀少的纯合型GOF变异携带者,其血胆固醇水平更高[32]。
5 PCSK9抑制剂的分类PCSK9在胆固醇代谢中的重要作用使其成为新的药物靶点,PCSK9抑制剂分为PCSK9的单克隆抗体和非抗体型抑制剂,后者包括小干扰RNA(small interfering RNA,siRNA)、反义寡核苷酸(antisense oligonucleotides,ASO)、模拟肽、小分子抑制剂等。
5.1 单克隆抗体PCSK9的单克隆抗体抑制剂于2009年被首次发现,它也是最常见的PCSK9抑制剂。这些单克隆抗体与PCSK9上和LDLR作用的区域结合,通过抑制二者之间的相互作用抑制LDLR的降解,从而提高肝细胞中LDLR的数量并最终使循环中导致动脉粥样硬化的脂蛋白减少。首个中和性的抗PCSK9抗体在小鼠和灵长类动物中使得肝细胞表面LDLR表达增加,并使血中LDL-C水平降低了大约30%[33]。其他类型的抗体也使LDL-C下降了大约20%~50%不等,这种作用是剂量依赖性的[34]。Alirocumab和evolocumab是仅有的2个已在美国和欧盟被批准的人单克隆抗体药物,会在最大程度上降低针对这些抗体的免疫反应[35]。
另外2种PCSK9抗体bococizumab和LY3015014正在研发中[35]。其中LY3015014与PCSK9结合的位点不同于其他抗体,LY3015014对PCSK9的内源性降解途径没有影响;而在LY3015014-PCSK9复合体被降解之前,LY3015014就会从这个复合体解离下来,这些特性会延长其作用时间,增加患者的顺从性[36]。
5.2 PCSK9的非抗体型抑制剂与单克隆抗体不同,非抗体型抑制剂既可以在细胞外发挥作用,也可以在细胞内发挥作用,并且可以通过口服或者接种疫苗来发挥作用。其方便的使用方式以及可能对PCSK9更强的抑制作用,使其有可能取代PCSK9单克隆抗体成为主要的PCSK9抑制剂。
5.2.1 siRNA在研究中发现,PCSK9的LOF变异可以抑制其在肝细胞中的分泌,以及PCSK9-/-小鼠表现出的低胆固醇血症,使得PCSK9的合成成为药物治疗的一个可能靶标。siRNA是一种短的双链RNA分子,可直接导致特定的mRNA分子降解[37]。通过用脂质作为载体,使其进入肝细胞,从而实现静脉或者皮下注射siRNA抑制体内PCSK9的产生,降低细胞内外PCSK9水平。抗PCSK9的siRNA治疗方法与单克隆抗体一样,在提高肝细胞LDLR密度与降低血LDL-C水平方面的效果类似[38]。而且,这些治疗方法也具有良好的耐受性。在PCSK9或者LDL-C水平很低时,也并没有观察到不良影响。有一种皮下注射的siRNA产品正处于Ⅰ期临床试验中[39]。
5.2.2 ASOASO通过直接与mRNA结合干扰转录,ASO治疗可以从源头上抑制PCSK9的合成,同时降低其细胞内外水平。在临床动物模型研究中,静脉注射抗PCSK9 ASO可以使LDL-C水平降低32%~38%, 并且这种作用会持续2~4周[40]。人抗PCSK9 ASO治疗2周后,LDL-C水平最多可以降低24%,然而,与安慰剂组相比,其急性肾损伤率增加[41]。另外, 锁核苷酸ASO比ASO拥有更高的亲和力,有潜在的应用前景[42]。
5.2.3 模拟肽模拟肽是一种模仿LDLR上与PCSK9结合的EGF-A的抑制剂。在HepG2细胞中,合成的EGF-A肽类似物与LDLR结合,可以抑制PCSK9介导的LDLR降解,这种抑制作用是剂量依赖性的[24]。另外,PCSK9的片段也可以与PCSK9竞争性结合LDLR,这成为另一种可选择的方法。
5.2.4 小分子抑制剂小分子是一类可以与靶蛋白、DNA或者RNA结合并抑制靶标生物学功能的复合物。这些小分子比单克隆抗体和siRNA更有优势,因为它们可以口服并且更便宜。理论上,小分子抑制剂可以在任何地方与PCSK9序列反应,并影响其自剪切过程,以及分泌和(或)与LDLR的反应。在应用小分子抑制剂的过程中存在两个问题,一是PCSK9的活性与LDLR的降解无关,二是其催化三聚体与其他许多PCs相似,这影响了其作用的特异性。此外,PCSK9与小分子抑制剂相作用是比较困难的,因为其表面并没有可以促进特异性结合的结合口袋[43]。因此,小分子抑制剂的发展较慢。
6 PCSK9抑制剂的临床应用PCSK9抑制剂中应用比较成熟的是PCSK9单克隆抗体,其已被证明在应用单药治疗后可有效降低血液循环中的LDL-C水平,也可以作为他汀类药物的补充药物[44]。关于PCSK9抑制剂(alirocumab和evolocumab)安全性和有效性的主要研究ODYSSEY LONG TERM、OSLER-1、OSLER-2于2015年发表, 根据这些和其他一些研究结果,美国国家脂质学会(National Lipid Association,NLA)发表了使用PCSK9抑制剂的建议(2015版)。NLA根据2016年发表的一项通过血管超声评估粥样斑块体积及退化程度的试验[45]和2017年发表的一项关于心血管疾病预后结果的试验[46]的结果更新了2015版建议,发表了2017版[44]。新版主要推荐PCSK9抑制剂适合以下4种情况:(1)患有稳定性动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的患者可以考虑使用PCSK9抑制剂来降低ASCVD的危险因素;(2)患有进展性ASCVD的患者可以使用PCSK9抑制剂进一步降低LDL-C水平; (3)表型家族性高胆固醇血症,预治疗后LDL-C≥1 900 mg/L; (4)极高危且他汀类药物不耐受者[44]。
7 展望在15年的时间里,研究者们对PCSK9的了解已经有了一定的认识,但对其许多机制仍不够清楚,人群中自然存在的PCSK9 LOF变异以及PCSK9在胆固醇代谢中的作用,使PCSK9抑制剂有望成为新的降胆固醇的药物。然而,任何一种新药物从研发到临床应用都需要面对各种困难,目前以PCSK9-LDLR为靶点的许多新药仍在临床试验中,其中包括一些PCSK9抑制剂在糖尿病中作用的实验,随着对PCSK9病理生理机制认识的不断加深,其必将为临床治疗带来更大的益处。
| [1] | BOEKHOLDT S M, ARSENAULT B J, MORA S, PEDERSEN T R, LAROSA J C, NESTEL P J, et al. Association of LDL cholesterol, non-HDL cholesterol, and apolipoprotein B levels with risk of cardiovascular events among patients treated with statins:a meta-analysis[J]. JAMA, 2012, 307: 1302–1309. DOI: 10.1001/jama.2012.366 |
| [2] | BRAAMSKAMP M J A M, LANGSLET G, MCCRINDLE B W, CASSIMAN D, FRANCIS G A, GAGNÉ C, et al. Efficacy and safety of rosuvastatin therapy in children and adolescents with familial hypercholesterolemia:results from the CHARON study[J]. J Clin Lipidol, 2015, 9: 741–750. DOI: 10.1016/j.jacl.2015.07.011 |
| [3] | TOTH P P, HARPER C R, JACOBSON T A. Clinical characterization and molecular mechanisms of statin myopathy[J]. Expert Rev Cardiovasc Ther, 2008, 6: 955–969. DOI: 10.1586/14779072.6.7.955 |
| [4] | ABIFADEL M, VARRET M, RABÉS J P, ALLARD D, OUGUERRAM K, DEVILLERS M, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia[J]. Nat Genet, 2003, 34: 154–156. DOI: 10.1038/ng1161 |
| [5] | SEIDAH N G. The proprotein convertases, 20 years later[J]. Methods Mol Biol, 2011, 768: 23–57. DOI: 10.1007/978-1-61779-204-5 |
| [6] | LI J, TUMANUT C, GAVIGAN J A, HUANG W J, HAMPTON E N, TUMANUT R, et al. Secreted PCSK9 promotes LDL receptor degradation independently of proteolytic activity[J]. Biochem J, 2007, 406: 203–207. DOI: 10.1042/BJ20070664 |
| [7] | LEREN T P. Sorting an LDL receptor with bound PCSK9 to intracellular degradation[J]. Atherosclerosis, 2014, 237: 76–81. DOI: 10.1016/j.atherosclerosis.2014.08.038 |
| [8] | SEIDAH N G, PRAT A. The biology and therapeutic targeting of the proprotein convertases[J]. Nat Rev Drug Discov, 2012, 11: 367–383. DOI: 10.1038/nrd3699 |
| [9] | WANG Y, HUANG Y, HOBBS H H, COHEN J C. Molecular characterization of proprotein convertase subtilisin/kexin type 9-mediated degradation of the LDLR[J]. J Lipid Res, 2012, 53: 1932–1943. DOI: 10.1194/jlr.M028563 |
| [10] | FAN D, YANCEY P G, QIU S, DING L, WEEBER E J, LINTON M F, et al. Self-association of human PCSK9 correlates with its LDLR-degrading activity[J]. Biochemistry, 2008, 47: 1631–1639. DOI: 10.1021/bi7016359 |
| [11] | STRØM T B, TVETEN K, LEREN T P. PCSK9 acts as a chaperone for the LDL receptor in the endoplasmic reticulum[J]. Biochem J, 2014, 457: 99–105. DOI: 10.1042/BJ20130930 |
| [12] | KYSENIUS K, MUGGALLA P, MÄTLIK K, ARUMÄE U, HUTTUNEN H J. PCSK9 regulates neuronal apoptosis by adjusting ApoER2 levels and signaling[J]. Cell Mol Life Sci, 2012, 69: 1903–1916. DOI: 10.1007/s00018-012-0977-6 |
| [13] | ROUBTSOVA A, MUNKONDA M N, AWAN Z, MARCINKIEWICZ J, CHAMBERLAND A, LAZURE C, et al. Circulating proprotein convertase subtilisin/kexin 9(PCSK9) regulates VLDLR protein and triglyceride accumulation in visceral adipose tissue[J]. Arterioscler Thromb Vasc Biol, 2011, 31: 785–791. DOI: 10.1161/ATVBAHA.110.220988 |
| [14] | ZHAO Z, TUAKLI-WOSORNU Y, LAGACE T A, KINCH L, GRISHIN N V, HORTON J D, et al. Molecular characterization of loss-of-function mutations in PCSK9 and identification of a compound heterozygote[J]. Am J Hum Genet, 2006, 79: 514–523. DOI: 10.1086/507488 |
| [15] | WALLEY K R, THAIN K R, RUSSELL J A, REILLY M P, MEYER N J, FERGUSON J F, et al. PCSK9 is a critical regulator of the innate immune response and septic shock outcome[J/OL]. Sci Transl Med, 2014, 6:258ra143. doi:10.1126/scitranslmed.3008782. |
| [16] | LEVY E, BEN DJOUDI OUADDA A, SPAHIS S, SANE A T, GAROFALO C, GRENIER É, et al. PCSK9 plays a significant role in cholesterol homeostasis and lipid transport in intestinal epithelial cells[J]. Atherosclerosis, 2013, 227: 297–306. DOI: 10.1016/j.atherosclerosis.2013.01.023 |
| [17] | DEMERS A, SAMAMI S, LAUZIER B, DES ROSIERS C, NGO SOCK E T, ONG H, et al. PCSK9 induces CD36 degradation and affects long-chain fatty acid uptake and triglyceride metabolism in adipocytes and in mouse liver[J]. Arterioscler Thromb Vasc Biol, 2015, 35: 2517–2525. DOI: 10.1161/ATVBAHA.115.306032 |
| [18] | LAGACE T A. PCSK9 and LDLR degradation:regulatory mechanisms in circulation and in cells[J]. Curr Opin Lipidol, 2014, 25: 387–393. DOI: 10.1097/MOL.0000000000000114 |
| [19] | DUBUC G, CHAMBERLAND A, WASSEF H, DAVIGNON J, SEIDAH N G, BERNIER L, et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia[J]. Arterioscler Thromb Vasc Biol, 2004, 24: 1454–1459. DOI: 10.1161/01.ATV.0000134621.14315.43 |
| [20] | JEONG H J, LEE H S, KIM K S, KIM Y K, YOON D, PARK S W. Sterol-dependent regulation of proprotein convertase subtilisin/kexin type 9 expression by sterol-regulatory element binding protein-2[J]. J Lipid Res, 2008, 49: 399–409. DOI: 10.1194/jlr.M700443-JLR200 |
| [21] | LI H, DONG B, PARK S W, LEE H S, CHEN W, LIU J. Hepatocyte nuclear factor 1alpha plays a critical role in PCSK9 gene transcription and regulation by the natural hypocholesterolemic compound berberine[J]. J Biol Chem, 2009, 284: 28885–28895. DOI: 10.1074/jbc.M109.052407 |
| [22] | AI D, CHEN C, HAN S, GANDA A, MURPHY A J, HAEUSLER R, et al. Regulation of hepatic LDL receptors by mTORC1 and PCSK9 in mice[J]. J Clin Invest, 2012, 122: 1262–1270. DOI: 10.1172/JCI61919 |
| [23] | HUSSAIN Y, DING Q, CONNELLY P W, BRUNT J H, BAN M R, MCINTYRE A D, et al. G-protein estrogen receptor as a regulator of low-density lipoprotein cholesterol metabolism:cellular and population genetic studies[J]. Arterioscler Thromb Vasc Biol, 2015, 35: 213–221. DOI: 10.1161/ATVBAHA.114.304326 |
| [24] | MAXWELL K N, BRESLOW J L. Adenoviral-mediated expression of Pcsk9 in mice results in a low-density lipoprotein receptor knockout phenotype[J]. Proc Natl Acad Sci USA, 2004, 101: 7100–7105. DOI: 10.1073/pnas.0402133101 |
| [25] | COHEN J, PERTSEMLIDIS A, KOTOWSKI I K, GRAHAM R, GARCIA C K, HOBBS H H. Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9[J]. Nat Genet, 2005, 37: 161–165. DOI: 10.1038/ng1509 |
| [26] | KOTOWSKI I K, PERTSEMLIDIS A, LUKE A, COOPER R S, VEGA G L, COHEN J C, et al. A spectrum of PCSK9 alleles contributes to plasma levels of low-density lipoprotein cholesterol[J]. Am J Hum Genet, 2006, 78: 410–422. DOI: 10.1086/500615 |
| [27] | COHEN J C, BOERWINKLE E, MOSLEY T H Jr, Hobbs H H. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease[J]. N Engl J Med, 2006, 354: 1264–1272. DOI: 10.1056/NEJMoa054013 |
| [28] | STENDER S, TYBJAERG-HANSEN A. Using human genetics to predict the effects and side-effects of drugs[J]. Curr Opin Lipidol, 2016, 27: 105–111. DOI: 10.1097/MOL.0000000000000280 |
| [29] | SEIDAH N G, AWAN Z, CHRÉTIEN M, MBIKAY M. PCSK9:a key modulator of cardiovascular health[J]. Circ Res, 2014, 114: 1022–1036. DOI: 10.1161/CIRCRESAHA.114.301621 |
| [30] | ABIFADEL M, ELBITAR S, EL KHOURY P, GHALEB Y, CHÉMALY M, MOUSSALLI M L, et al. Living the PCSK9 adventure:from the identification of a new gene in familial hypercholesterolemia towards a potential new class of anticholesterol drugs[J/OL]. Curr Atheroscler Rep, 2014, 16:439. doi:10.1007/s11883-014-0439-8. |
| [31] | MAYNE J, DEWPURA T, RAYMOND A, BERNIER L, COUSINS M, OOI T C, et al. Novel loss-of-function PCSK9 variant is associated with low plasma LDL cholesterol in a French-Canadian family and with impaired processing and secretion in cell culture[J]. Clin Chem, 2011, 57: 1415–1423. DOI: 10.1373/clinchem.2011.165191 |
| [32] | ALVES A C, ETXEBARRIA A, MEDEIROS A M, BENITO-VICENTE A, THEDREZ A, PASSARD M, et al. Characterization of the first PCSK9 gain of function homozygote[J]. J Am Coll Cardiol, 2015, 66: 2152–2154. DOI: 10.1016/j.jacc.2015.08.871 |
| [33] | CHAN J C, PIPER D E, CAO Q, LIU D, KING C, WANG W, et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates[J]. Proc Natl Acad Sci USA, 2009, 106: 9820–9825. DOI: 10.1073/pnas.0903849106 |
| [34] | ZHANG L, McCABE T, CONDRA J H, NI Y G, PETERSON L B, WANG W, et al. An anti-PCSK9 antibody reduces LDL-cholesterol on top of a statin and suppresses hepatocyte SREBP-regulated genes[J]. Int J Biol Sci, 2012, 8: 310–327. DOI: 10.7150/ijbs.3524 |
| [35] | McKENNEY J M. Understanding PCSK9 and anti-PCSK9 therapies[J]. J Clin Lipidol, 2015, 9: 170–186. DOI: 10.1016/j.jacl.2015.01.001 |
| [36] | SCHROEDER K M, BEYER T P, HANSEN R J, HAN B, PICKARD R T, WROBLEWSKI V J, et al. Proteolytic cleavage of antigen extends the durability of an anti-PCSK9 monoclonal antibody[J]. J Lipid Res, 2015, 56: 2124–2132. DOI: 10.1194/jlr.M061903 |
| [37] | LAM J K, CHOW M Y, ZHANG Y, LEUNG S W. siRNA versus miRNA as therapeutics for gene silencing[J/OL]. Mol Ther Nucleic Acids, 2015, 4:e252. doi:10.1038/mtna.2015.23. |
| [38] | FITZGERALD K, FRANK-KAMENETSKY M, SHULGA-MORSKAYA S, LIEBOW A, BETTENCOURT B R, SUTHERLAND J E, et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9(PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers:a randomised, single-blind, placebo-controlled, phase 1 trial[J]. Lancet, 2014, 383: 60–68. DOI: 10.1016/S0140-6736(13)61914-5 |
| [39] | DO R Q, VOGEL R A, SCHWARTZ G G. PCSK9 inhibitors:potential in cardiovascular therapeutics[J/OL]. Curr Cardiol Rep, 2013, 15:345. doi:10.1007/s11886-012-0345-z. |
| [40] | GRAHAM M J, LEMONIDIS K M, WHIPPLE C P, SUBRAMANIAM A, MONIA B P, CROOKE S T, et al. Antisense inhibition of proprotein convertase subtilisin/kexin type 9 reduces serum LDL in hyperlipidemic mice[J]. J Lipid Res, 2007, 48: 763–767. DOI: 10.1194/jlr.C600025-JLR200 |
| [41] | VAN POELGEEST E P, SWART R M, BETJES M G, MOERLAND M, WEENING J J, TESSIER Y, et al. Acute kidney injury during therapy with an antisense oligonucleotide directed against PCSK9[J]. Am J Kidney Dis, 2013, 62: 796–800. DOI: 10.1053/j.ajkd.2013.02.359 |
| [42] | LINDHOLM M W, ELMÉN J, FISKER N, HANSEN H F, PERSSON R, MØLLER M R, et al. PCSK9 LNA antisense oligonucleotides induce sustained reduction of LDL cholesterol in nonhuman primates[J]. Mol Ther, 2012, 20: 376–381. DOI: 10.1038/mt.2011.260 |
| [43] | LO SURDO P, BOTTOMLEY M J, CALZETTA A, SETTEMBRE E C, CIRILLO A, PANDIT S, et al. Mechanistic implications for LDL receptor degradation from the PCSK9/LDLR structure at neutral pH[J]. EMBO Rep, 2011, 12: 1300–1305. DOI: 10.1038/embor.2011.205 |
| [44] | ORRINGER C E, JACOBSON T A, SASEEN J J, BROWN A S, GOTTO A M, ROSS J L, et al. Update on the use of PCSK9 inhibitors in adults:recommendations from an Expert Panel of the National Lipid Association[J]. J Clin Lipidol, 2017, 11: 880–890. DOI: 10.1016/j.jacl.2017.05.001 |
| [45] | NICHOLLS S J, PURI R, ANDERSON T, BALLANTYNE C M, CHO L, KASTELEIN J J, et al. Effect of evolocumab on progression of coronary disease in statin-treated patients:the GLAGOV randomized clinical trial[J]. JAMA, 2016, 316: 2373–2384. DOI: 10.1001/jama.2016.16951 |
| [46] | HADJIPHILIPPOU S, RAY K K. Evolocumab and clinical outcomes in patients with cardiovascular disease[J]. J R Coll Physicians Edinb, 2017, 47: 153–155. DOI: 10.4997/JRCPE |
 2017, Vol. 38
2017, Vol. 38


