良性阵发性位置性眩晕(benign paroxysmal positional vertigo,BPPV)是神经科门诊、急诊工作的常见病及多发病,该病是由椭圆囊耳石膜上的碳酸钙颗粒脱落并进入半规管所致[1-3]。经恰当的手法复位治疗,绝大多数患者的眩晕症状能得到明显改善。部分患者在手法复位治疗后的一段时间内会出现症状复发,而相应预防手段的缺乏使之成为当前BPPV诊治工作的一大难题[4]。近年来国外研究发现BPPV的发生和复发与骨质疏松密切相关[5-6],而维生素D代谢障碍在骨更新中发挥着重要作用。血清25-羟维生素D[25-hydroxyvitamin D, 25(OH)D]水平是公认的反映人体维生素D营养及功能状况的最佳指标[7]。有学者发现,与健康对照组相比,BPPV患者体内血清25(OH)D水平下降[8]。小样本病例报道提示复发性BPPV患者体内存在更明显的维生素D代谢障碍[9-10]。然而,迄今尚缺乏与非BPPV眩晕患者的比较研究,我国在此领域处于相对空白的状态。本研究比较了BPPV及非BPPV患者的血清25(OH)D水平差异,并初步探讨了其与BPPV复发的关系,以期为进一步探索BPPV发生、复发的生物标志物提供科学依据。
1 资料和方法 1.1 研究对象纳入2013年1月至2014年12月上海交通大学医学院附属第九人民医院神经内科诊治的部分BPPV及非BPPV眩晕病患者。BPPV患者需满足:(1)诊断经Dix-Hallpike试验及翻滚试验证实[11],具有完整的人口学资料(年龄、性别、睡眠习惯、高血压、糖尿病等);(2)经手法复位治疗,随访2周内眩晕消失,诱发试验证实复位成功;(3)每3个月随访1次,直至1年,若有眩晕复发则再次来院复诊明确,所有复发患者均经再次诱发试验证实。取同期明确诊断的非BPPV眩晕病患者作为对照,患者需满足:(1)以急性眩晕/发作性眩晕为主诉来院就诊;(2)头颅MRI检查排除急性脑卒中、颅内占位。所有入选病例均同意留取外周血标本行血清25(OH)D水平检测。排除正在使用降钙素、阿法骨化醇胶丸、钙片及雌激素等可能影响钙磷代谢的患者。本研究获得上海交通大学医学院附属第九人民医院医学伦理委员会批准,所有受试者均签署知情同意书。
1.2 分组设计根据1年随访结果,将BPPV患者分为BPPV复发组和未复发组,其中未复发组207例(后半规管BPPV 154例,水平半规管BPPV 53例),复发组42例(首诊为后半规管BPPV 35例,水平半规管BPPV 7例);非BPPV眩晕对照组43例,其中前庭神经炎37例、前庭阵发症4例、偏头痛性眩晕2例。
1.3 血清25(OH)D水平测定所有受试者均空腹采外周静脉血(抗凝管)4 mL,在采血6 h内运用25(OH)D定量测定试剂盒(DiaSorin Inc, USA)通过免疫化学发光法检测血清25(OH)D水平。
1.4 统计学处理运用SPSS 23.0及GraphPad Prism 5.0软件进行统计分析和绘图。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,3组间变量比较用单因素方差分析。计数资料以百分数表示,3组间计数资料的单因素分析采用χ2检验。相关性分析运用Pearson相关分析。采用多因素线性逐层回归方法分析影响人血清25(OH)D水平的独立影响因素。检验水准(α)为0.05。
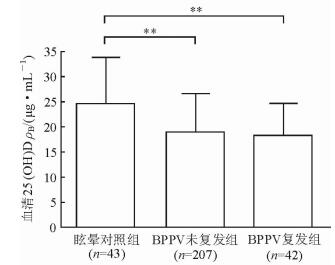
2 结果 2.1 3组一般资料及血清25(OH)D水平比较眩晕对照组、BPPV未复发组及BPPV复发组受试者之间的年龄、高血压及糖尿病比例比较差异均无统计学意义;BPPV复发组中女性比例有增高趋势,但3组间差异无统计学意义(P=0.073);见表 1。如图 1所示,眩晕对照组患者的血清25(OH)D水平高于BPPV未复发组和BPPV复发组[(24.6±8.8) ng/mL vs (19.0±7.6) ng/mL, (24.6±8.8) ng/mL vs (18.1±6.6) ng/mL; P均 < 0.01],但BPPV复发组与未复发组患者之间血清25(OH)D水平差异无统计学意义。
|
|
表 1 3组患者的基线资料比较 |
|
图 1 3组患者血清25(OH)D水平的比较 25(OH)D: 25-羟维生素D; BPPV:良性阵发性位置性眩晕. **P < 0.01. x±s |
2.2 血清25(OH)D的影响因素分析
Pearson相关性分析显示,在所有入组患者(n=292)中血清25(OH)D水平与受试者年龄无明显相关性(r=-0.070, P=0.176),但与性别相关,女性血清25(OH)D水平低于男性[(18.7±7.5) ng/mL vs (21.7±8.3) ng/mL,P=0.002)]。高血压及糖尿病与受试者血清25(OH)D水平也无相关性。多因素逐层线性回归分析结果显示女性(β=-2.6,标准误0.95,t=-2.81, 95%CI:-4.516~-0.796, P=0.005)、BPPV(β=-5.5,标准误1.25,t=-4.41, 95%CI:-7.969~-3.052, P < 0.001)是血清25(OH)D的独立影响因素。
3 讨论积极探寻BPPV发生、复发的相关危险因素是当前BPPV的研究热点之一。本研究通过与非BPPV眩晕病患者比较,证实我国BPPV患者体内存在血清25(OH)D水平的下降,且其水平与BPPV复发无明显关系。
与国外学者报道[8-10]相一致,BPPV患者体内存在血清25(OH)D水平的下降,提示人体维生素D水平下降可能参与了BPPV的发生过程。维生素D属脂溶性类固醇衍生物,其家族中以麦角钙化醇(维生素D2)和胆钙化醇(维生素D3)的作用最为重要,分别主要来源于食物吸收及紫外线照射。其中,维生素D3对人体的生物学效应高于维生素D2[12]。维生素D经肝脏组织内的25-羟化酶作用后转换为25(OH)D,最终经肾脏组织内1α-羟化酶作用转换为有活性的1, 25-二羟维生素D[1, 25(OH)2D]。血清25(OH)D的生物半衰期约为3周,较1, 25(OH)2D(半衰期4~6 h)稳定[7]。有研究发现耳石的主要成分由碳酸钙组成,其形成需要局部钙离子和碳酸盐(二氧化碳)浓度的增加,从而启动核心蛋白质的晶体形成[13]。生理情况下,内淋巴处于低钙水平,而此环境的维持受许多编码钙通道转运体调节。动物实验研究发现这些钙通道转运体同样也在半规管及耳蜗中表达,且受到维生素D3的调节;而基础研究发现补充1, 25(OH)2D3可提高大鼠原代半规管上皮细胞中钙离子转运体的mRNA水平[14]。因此,人25(OH)D水平下降可能导致半规管钙离子转运体功能发挥不足,内淋巴低钙环境难以维持,半规管内淋巴内容易形成碳酸钙结晶。
本研究发现,BPPV复发组患者血清25(OH)D水平较未复发组略有下降,但差异无统计学意义。不同研究的样本量、种族差异可能是影响因素,其他可能的因素有:(1)维生素D不同成分及检测方法的差异。本研究采用的是免疫化学发光法检测25-羟总维生素D,而Büki等[9]采用的是电化学免疫技术,且其结果经液相色谱-串联质谱法(LC-MS)标化。LC-MS可以进一步检测出25(OH)D2和25(OH)D3[7];(2)遗传因素的影响。人体维生素D3通过维生素D受体(vitamin D receptor, VDR)介导发挥生物学作用。研究发现壶腹嵴内上皮细胞核、膜半规管、小鼠的骨细胞周围也存在VDR,且VDR基因突变小鼠存在平衡功能降低的现象[15]。VDR基因位于12号染色体(12q12),含有11个外显子,主要编码核转录因子,该基因上存在多个限制性内切酶酶切位点。研究发现,部分位点如Fok-Ⅰ及Cdx-2的遗传变异会影响人血清25(OH)D的水平[16-17]。因此,基于25(OH)D的组分分层、VDR基因分层设计将有助于进一步探讨人维生素D代谢障碍与BPPV发生、复发的相关性。
此外,本研究结果发现女性血清25(OH)D水平较男性下降,由于本研究入组对象平均年龄在50~60岁,提示了围绝经期女性雌激素水平的变化可能影响了人体维生素D的代谢过程。流行病学研究发现,绝经后妇女容易出现维生素D水平下降[18-19],给予外源性雌激素可以提高女性25(OH)D水平[20]。雌激素水平下降将导致对骨细胞的直接作用减弱,骨代谢加快,从而引起女性骨密度下降。另外,雌激素缺乏也会引起肠道对钙的吸收减少、肾小管对钙的重吸收减少,从而间接影响人体骨外钙稳态[21-22]。
本研究尚存在一定的方法学缺陷:眩晕对照组样本量有限;BPPV女性患者比例偏多;血清25(OH)D为单次检测结果,缺乏重复性校正和健康对照组数据;此外,检测的季节性也是可能的影响因素之一。但总之,本研究为进一步揭示维生素D代谢障碍在BPPV的发生、复发中的作用进行了有益的初步探讨,提示人血清低维生素D水平也是中国BPPV患者发生的危险因素,而有关维生素D代谢障碍与BPPV复发的关系尚待设计严谨的、前瞻性多中心队列研究的结果。
| [1] | VON BREVERN M, RADTKE A, LEZIUS F, FELDMANN M, ZIESE T, LEMPERT T, et al. Epidemiology of benign paroxysmal positional vertigo:a population based study[J]. J Neurol Neurosurg Psychiatry, 2007, 78: 710–715. |
| [2] | KIM J S, ZEE D S. Clinical practice. Benign paroxysmal positional vertigo[J]. N Engl J Me, 2014, 370: 1138–1147. DOI: 10.1056/NEJMcp1309481 |
| [3] | FURMAN J M, CASS S P. Benign paroxysmal positional vertigo[J]. N Engl J Med, 1999, 341: 1590–1596. DOI: 10.1056/NEJM199911183412107 |
| [4] | HELMINSKI J O, JANSSEN I, KOTASPOUIKIS D, KOVACS K, SHELDON P, McQUEEN K, et al. Strategies to prevent recurrence of benign paroxysmal positional vertigo[J]. Arch Otolaryngol Head Neck Surg, 2005, 131: 344–348. DOI: 10.1001/archotol.131.4.344 |
| [5] | JEONG S H, CHOI S H, KIM J Y, KOO J W, KIM H J, KIM J S. Osteopenia and osteoporosis in idiopathic benign positional vertigo[J]. Neurology, 2009, 72: 1069–1076. DOI: 10.1212/01.wnl.0000345016.33983.e0 |
| [6] | YAMANAKA T, SHIROTA S, SAWAI Y, MURAI T, FUJITA N, HOSOI H. Osteoporosis as a risk factor for the recurrence of benign paroxysmal positional vertigo[J]. Laryngoscope, 2013, 123: 2813–2816. DOI: 10.1002/lary.v123.11 |
| [7] | HOLICK M F. Vitamin D deficiency[J]. N Engl J Med, 2007, 357: 266–281. DOI: 10.1056/NEJMra070553 |
| [8] | JEONG S H, KIM J S, SHIN J W, KIM S, LEE H, LEE A Y, et al. Decreased serum vitamin D in idiopathic benign paroxysmal positional vertigo[J]. J Neurol, 2013, 260: 832–838. DOI: 10.1007/s00415-012-6712-2 |
| [9] | BVKI B, ECKER M, JVNGER H, LUNDBERG Y W. Vitamin D deficiency and benign paroxysmal positioning vertigo[J]. Med Hypotheses, 2013, 80: 201–204. DOI: 10.1016/j.mehy.2012.11.029 |
| [10] | TALAAT H S, ABUHADIED G, TALAAT A S, ABDELAAL M S. Low bone mineral density and vitamin D deficiency in patients with benign positional paroxysmal vertigo[J]. Eur Arch Otorhinolaryngol, 2015, 272: 2249–2253. DOI: 10.1007/s00405-014-3175-3 |
| [11] | PARNES L S, AGRAWAL S K, ATLAS J. Diagnosis and management of benign paroxysmal positional vertigo (BPPV)[J]. CMAJ, 2003, 169: 681–693. |
| [12] | ARMAS L A, HOLLIS B W, HEANEY R P. Vitamin D2 is much less effective than vitamin D3 in humans[J]. J Clin Endocrinol Metab, 2004, 89: 5387–5391. DOI: 10.1210/jc.2004-0360 |
| [13] | YANG H, ZHAO X, XU Y, WANG L, HE Q, LUNDBERG Y W. Matrix recruitment and calcium sequestration for spatial specific otoconia development[J/OL]. PLoS One, 2011, 6:e20498. doi:10.1371/journal.pone.0020498. |
| [14] | YAMAUCHI D, RAVEENDRAN N N, PONDUGULA S R, KAMPALLI S B, SANNEMAN J D, HARBIDGE D G, et al. Vitamin D upregulates expression of ECaC1 mRNA in semicircular canal[J]. Biochem Biophys Res Commun, 2005, 331: 1353–1357. DOI: 10.1016/j.bbrc.2005.04.053 |
| [15] | MINASYAN A, KEISALA T, ZOU J, ZHANG Y, TOPPILA E, SYVÄLÄ H, et al. Vestibular dysfunction in vitamin D receptor mutant mice[J]. J Steroid Biochem Mol Biol, 2009, 114: 161–166. DOI: 10.1016/j.jsbmb.2009.01.020 |
| [16] | TANABE R, KAWAMURA Y, TSUGAWA N, HARAIKAWA M, SOGABE N, OKANO T, et al. Effects of Fok-Ⅰ polymorphism in vitamin D receptor gene on serum 25-hydroxyvitamin D, bone-specific alkaline phosphatase and calcaneal quantitative ultrasound parameters in young adults[J]. Asia Pac J Clin Nutr, 2015, 24: 329–335. |
| [17] | LING Y, LIN H, ALETENG Q, MA H, PAN B, GAO J, et al. Cdx-2 polymorphism in Vitamin D Receptor gene was associated with serum 25-hydroxyvitamin D levels, bone mineral density and fracture in middle-aged and elderly Chinese women[J]. Mol Cell Endocrinol, 2016, 427: 155–161. DOI: 10.1016/j.mce.2016.03.014 |
| [18] | ARABI A, EL RASSI R, EL-HAJJ FULEIHAN G. Hypovitaminosis D in developing countries-prevalence, risk factors and outcomes[J]. Nat Rev Endocrinol, 2010, 6: 550–561. DOI: 10.1038/nrendo.2010.146 |
| [19] | KONDO M, TOYODA M, MIYATAKE H, TANAKA E, KOIZUMI M, KOMABA H, et al. The prevalence of 25-hydroxy vitamin D deficiency in Japanese patients with diabetic nephropathy[J]. Intern Med, 2016, 55: 2555–2562. DOI: 10.2169/internalmedicine.55.6346 |
| [20] | HARMON Q E, UMBACH D M, BAIRD D D. Use of estrogen-containing contraception is associated with increased concentrations of 25-hydroxy vitamin D[J]. J Clin Endocrinol Metab, 2016, 101: 3370–3377. DOI: 10.1210/jc.2016-1658 |
| [21] | GENNARI C, AGNUSDEI D, NARDI P, CIVITELLI R. Estrogen preserves a normal intestinal responsiveness to 1, 25-dihydroxyvitamin D3 in oophorectomized women[J]. J Clin Endocrinol Metab, 1990, 71: 1288–1293. DOI: 10.1210/jcem-71-5-1288 |
| [22] | McKANE W R, KHOSLA S, BURRITT M F, KAO P C, WILSON D M, ORY S J, et al. Mechanism of renal calcium conservation with estrogen replacement therapy in women in early postmenopause-a clinical research center study[J]. J Clin Endocrinol Metab, 1995, 80: 3458–3464. |
 2017, Vol. 38
2017, Vol. 38


