2. 上海海事大学信息工程学院计算机科学系, 上海 201306
2. Department of Computer Science, Institute of Information Engineering, Shanghai Maritime University, Shanghai 201306, China
高分辨率超声检查是骨骼肌损伤首选的影像学诊断工具[1],相对于CT和磁共振成像(MRI),其具有无创、无辐射的优势,能够较好显示由肌肉纤维束排列与走行所构成的特定肌纹理。虽然在损伤后肌肉的超声图像上能够观察到与病理组织学变化较为一致的纹理改变,但不同技术级别的超声医师或同一超声医师在不同时期单独进行定性诊断时均会有难以避免的主观局限性,致使相关研究的可重复性差,至今对超声图像显示的肌肉损伤回声特点、范围、严重程度等特征未能做出统一标准的精确判断和评估。
随着人工智能技术的迅速发展,越来越多的超声医师期望借力计算机辅助诊断技术提高影像临床判读的一致性及准确率,但对于骨骼肌损伤的超声诊断,目前临床上尚无客观可靠的定量标准。本课题组所在第二军医大学长征医院承担过多次火灾、地震等重大公共卫生突发事件伤员的急救超声检查任务,我们通过回顾骨骼肌损伤的超声诊断经验和医工结合研究体会,开展了一系列实验研究和初步临床实践,尝试运用骨骼肌超声图像计算机纹理分析技术研究损伤修复不同时期的肌肉超声影像表现,定量探讨损伤及修复期声像图上的肌纹理特征变化,并从组织病理学角度对照观察损伤及修复期的肌纤维结构与胶原分布特点、血管化程度与其排列分布。相关研究有望为今后临床寻找定量、客观的骨骼肌损伤超声诊断评价指标提供依据。
1 骨骼肌损伤诊断的现状及超声诊断优势骨骼肌是完成人体运动量最大的器官,其损伤最为常见。调查数据显示,外力创伤造成的骨骼肌损伤发生率为10%~55%[2],特别是近年来频发高震级强地震、交通事故等严重创伤事件,导致广泛性肌肉损伤具备高发、频发的流行病学特征,致死率及致残率达20%以上,且呈逐年上升趋势[3]。骨骼肌损伤后,在第一时间精准判定肌肉损伤区域以及严重状况并选择合理的医治方式是临床首要重视的问题,这通常依赖于医师自身积累的临床经验,因此主观性大。超声诊断是早期救治和预后随访的保障,能减少伤残以及死亡的发生,但要单独判读骨骼肌损伤超声图像,不同技术级别的超声医师在主观意识上往往存在一定的局限性,且现阶段超声诊断体系的定量标准也并不可靠、完善[4]。
遭受损伤后,骨骼肌内部胶原纤维结构破坏及滋养血管束架构的排列改变可致超声图像表现不同,二维超声图像表现为肌纹理紊乱、模糊,超声造影后出现灌注缺损、滋养血管束显影紊乱;修复期随着肌纤维再生、新生血管出现、纤维化等,肌纤维纹理及血管束逐渐恢复。因此,从超声图像上的肌肉纹理特征、血管束排列分布形状变化入手,运用骨骼肌超声图像计算肌纹理及图像处理中的骨架提取法,通过频域信息[5]定量阐明骨骼肌损伤修复的发生、发展及特征性超声影像演变规律,可为临床寻求合理、可靠的声学量化指标,快速构建骨骼肌损伤的超声影像定量诊断体系和流程框架奠定理论基础,以便适时提供干预策略。
临床上对骨骼肌损伤程度的诊断通常依据医师的临床经验,并视情况使用肌电图、血清标志物检测等方法辅助诊断,在诊断过程中易受干扰,导致评价结果不够准确[6]。而肌肉活检技术一般有明显的创伤性,其临床应用受到一定限制。X线和低电压放射线检查是既往诊断骨骼肌病变最常用的影像学手段,但其对软组织缺乏足够的对比分辨率。即使是最常见的肌肉损伤,CT也不能精确分辨肌肉的解剖结构,经静脉注射造影剂行增强扫描亦不能有所改善;此外,骨骼肌损伤多沿长轴方向撕裂或断裂回缩,此种变化在CT横断面成像上不容易看出[7]。MRI的分辨能力和敏感程度均强于CT,容易区分病变肌肉部位的信号改变特点,多层成像也能精准评定受伤部位和受伤面积[8],但这种大型影像装置缺乏灵活度和便捷性,费用高,不能为行动不便的患者提供床旁检查。目前,超声诊断仪已从固定大体积向便携移动式改良,在各级医院均可灵活应用,也非常适用于各类抢险救灾的现场床旁诊治。超声检查无创、经济实惠,且具备丰富的成像模式,能清晰显示人体的解剖结构(二维切面、三维容积)和血流动力学(如彩色/频谱多普勒、超声造影)等多方面信息[9-10]。实时超声造影模式还能获得动态图像连续监测,通过比对造影剂灌注超声视频图像中血管束几何形状和排列分布的变化,能即刻对病情做出精准诊查,为临床评估肌肉结构及血流灌注损伤情况提供直观、准确的影像学手段。
2 计算机图像处理技术在骨骼肌超声诊断中的应用计算机技术的日新月异推动了超声图像计算机自动处理分析研究的发展,一些学者已将计算机辅助纹理定量识别应用于实验或临床分析[11],为体内组织定量分析提供了新的有力工具[12-16]。徐琪[17]研究认为,从主观视觉的角度看,超声图像纹理是把一个声图像区域中的内容理解成具有一定程度均匀性的整体视觉感受,从客观上可把一幅声像图看成一个矩阵,或者是拥有2个不同自变量的单一函数,因此任一超声图像的感兴趣区(region of interest,ROI)能够写成一个以该区间内容为自变量的函数,同时赋予函数一些属性要求且和这个区域内的综合纹理视觉感觉相一致;实现上述目标的核心技术之一是纹理特征提取,即从超声图像区域中提取有效的纹理信息,通过对若干个量计算得到一个矢量,获得超声图像ROI准确的纹理参量后,再进行数学几何参量的统计学分析。
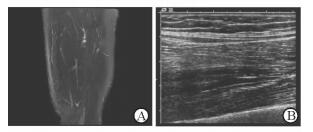
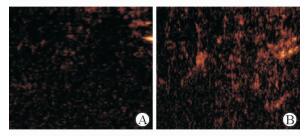
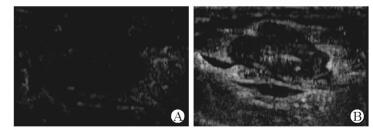
在高频超声图像上,骨骼肌束排列有序,因每个肌纤维都由肌内膜包裹,再聚集呈束状被肌束膜包裹,肌内膜和肌束膜由结缔组织、血管、神经和脂肪组织组成,其结构与肌肉的声阻抗差别较大,呈线状强回声,与呈低回声的肌肉斑驳交错,使肌纤维之间、肌束之间的界面反射较为强烈,显示出特定的纹理特征[18]。第二军医大学长征医院超声诊疗科超声实践显示,高分辨率高频超声的肌肉纹理成像不逊于MRI,肌纤维之间及肌束之间的界面反射清晰可辨(图 1),但不同技术级别超声医师进行定性诊断时具有主观局限性,目前临床对于肌肉纹理损伤尚未形成超声定量诊断标准,不能客观定量分析[19]。超声造影视频图像显示,运动后正常人大腿外侧骨骼肌群微循环灌注增加,较静息状态时造影剂回声增强、增多,密集、杂乱分布(图 2)[20],提示肌肉内反映血管束架构的几何形状、排列密度、分布走向的变化有一定规律。因此,基于超声图像纹理特征的计算机辅助图像处理技术在超声定量诊断骨骼肌损伤修复研究中应用前景广阔。
|
图 1 正常人股外侧肌群MRI(A)和高频超声二维成像(B) Fig 1 MRI (A) and high frequency ultrasonogram (B) of normal femoral muscles The images were derived from unpublished studies in Department of Ultrasound, Changzheng Hospital, Second Military Medical University. MRI: Magnetic resonance imaging |
|
图 2 正常人下肢肌群静息状态(A)与运动时(B)的超声造影成像[20] Fig 2 Characteristics of normal thigh muscles on contrast-enhanced ultrasound in stationary (A) and motion (B) states[20] |
3 骨骼肌损伤超声定量诊断肌纹理的探索
近年来, Pillen等[21-23]对疑诊为神经肌肉障碍的76例儿童患者分别运用Heckmatt主观评分标准和计算机辅助灰阶定量分析四肢骨骼肌群的回声强度,结果显示后者的诊断敏感性高达87%,并获得小腿及足部肌肉厚度和回声强度的正常参考值;Jansen等[24]通过测量图像中的肌肉回声强度及厚度,提出量化肌肉超声(QMUS)对于随访Duchenne型肌营养不良症具有较大的实用价值。这些研究虽然对肌肉超声图像进行了定量分析,但均未进一步探讨肌肉纹理变化的数学几何特征。周翔等[25]曾运用高频超声(13 MHz)检测了30例肌肉萎缩患者及32例正常人双侧大腿肌群,观察其二维超声图像的特征与差异,并对获取的单幅图像尝试做计算机纹理分析,基于后向散射回波幅度和角度关系提取分维数、共生矩阵的相关系数、角二矩、反差和灰阶的方差与偏度。用这些纹理特征参量表征超声图像的肌纤维粗糙程度、复杂性、均匀性等,能定量分析超声图像上肉眼难以分辨的肌肉萎缩纹理细节变化,具有相当的应用价值,但目前尚缺乏大样本病例与病理对照研究。
自2011年始,第二军医大学长征医院超声诊疗科先后与复旦大学计算机系、上海海事大学计算机系合作,致力于利用计算机软件进行计算机视觉下的骨骼肌纹理定量识别,开展了一系列实验研究和初步临床实践。采用多尺度斑块纹理特征的基本分解思想[26],发明了国家专利技术《骨骼肌损伤超声图像纹理定量分析的强度界面多级分解法》[27],先针对声像图ROI使用高斯核函数进行滤波分解,获取不同超声回波反射界面大小的二值图像,再根据线性尺度空间的分解原则,采用高斯核函数为分解核函数[28]。同时,为了获取不同强度尺度的二值图像,在使用反射界面尺度分解图像为基准的情况下,采用自适应的灰度偏移量来获得一组灰度阈值平面;针对获取的二值图像,使用拟定的8种纹理特征描述子来进行定量描述[27]。主要包括:(1)超声图像ROI中灰度的均值(mean),对应超声回声强度的衡量值。(2)超声图像ROI中灰度值的标准方差(standard deviation, SDev),衡量病变区域与正常区域中的组织是否基本相同。(3)超声图像ROI中纹理的密致性(number of blob, NOB),反映横纹肌肌纤维是否正常紧密分布。骨骼肌损伤产生血肿后,肌肉间液体的积聚使NOB发生重大改变,肌束间的等间距排列改变。(4)超声图像ROI中纹理基元形状的不规则度(irregularity),描述超声图像中肌纤维基元是呈条索状还是呈斑点状。(5)超声图像ROI中纹理基元的平均大小(size of blob),反映肌纤维是否存在断裂。肌纤维断裂则延续性被破坏,肌纤维基元较短。(6)超声图像ROI中纹理分布的均匀性(homogeneity of distribution, HOD)。此纹理特征与纹理基元的平均大小合并使用,HOD值越大说明区域中基元分布越不均匀,可能存在损伤区域。(7)超声图像ROI中纹理分布的方向性(directionality of distribution, DOD)。发生损伤时,肌纤维的结构分布走向发生改变或消失,该特征值是根据超声对应频谱图上极值点的位置进行描述的。(8)超声图像ROI中纹理分布的周期性(periodicity of distribution, POD)。出现血肿或水肿后,肌束间的距离发生参差不齐的改变,肌纤维不再按照某个距离值近似等距离间隔分布,POD值小说明超声图像上存在损伤后血肿或水肿问题的随机弥散性纹理分布。
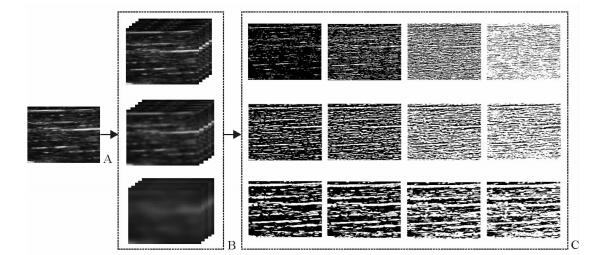
此后,我们使用离体猪理化损伤模型进行超声肌纹理定量研究。猪横纹肌正常区域、微波热消融损伤区域、无水乙酸局部注射化学损伤区域长轴切面的高频超声二维图像可清晰显示微波消融及无水乙酸损伤区域的肌纹理连续性中断,网络样结构模糊或消失[29]。为提高对猪横纹肌纹理特征超声定性诊断的准确性和主观判读的趋同性,我们又采用计算机纹理自动提取与定量分析的超声回波强度界面多级分解法(图 3),对各ROI肌纹理超声图像同时从分辨率和灰度2个维度进行分解,得到二值图像阵列,然后统计二值图像中的0值连通域和1值连通域的属性,得到纹理特征并进行参量对照研究。结果表明正常组、热损伤组、化学损伤组任意两个横纹肌ROI间的8种超声纹理特征参量差异有统计学意义(P<0.05),能有效提取用于定量描述横纹肌超声图像中的肌纹理形态、组构及分布状态信息的数学纹理特征参量[29-30]。
|
图 3 横纹肌声像图强度界面多级分解过程示意图[29] Fig 3 Diagram of ultrasonographic texture extracted from injured skeletal muscle named multiscale decomposition method of echo intensity of interface reflections[29] A: Grayscale ultrasonogram; B: Decomposition of threshold graphs; C: Decomposition of binary graphs |
基于离体研究,王晓艳[31]发现骨骼肌损伤的超声影像演变与其病理组织学特征相对应。以此为借鉴,我们成功建立了兔骨骼肌急性微波热损伤模型[32]和重物打击致兔骨骼肌钝挫伤模型(黄禾菁, 赵佳琦, 章建全, 曹昆昆, 刘昕乐.兔骨骼肌急性钝挫伤修复的超声影像演变特征.中华医学会第十七次全国超声医学学术会议壁报交流.2017),观察肌损伤修复不同时期肌肉组织的超声影像特征,探讨其相应的组织病理学、血清标志物的变化。结果表明,无论是兔骨骼肌急性微波消融损伤还是重物打击钝挫伤均在损伤后1~3 d进行性加重,7~28 d呈修复趋势;高频超声成像可动态观察受损后肌肉相应的组织结构、血流分布的超声影像演变特征,形象、直观地反映骨骼肌损伤修复过程,与组织病理学、血清生化指标随时间变化的趋势一致,可作为定性诊断和动态评估肌肉损伤修复变化的可靠方法。在定性诊断基础上,由2名具有3年以上工作经验的超声主治医师和1名图像处理人员共同应用超声回波强度界面多级分解法,提取了用于定量描述兔骨骼肌超声图像中肌纹理形态、组构及分布状态信息的8种纹理特征参量[27]。这些图像纹理特征和平面形状特征的识别检索性能在当时处于国际领先。这种对图像灰度和空间尺度进行分解的纹理分析方法联合大规模纹理集(Brodatz+VisTex+CURet+OuTex)的正确分类率达到了92%,当查全率为50%时其查准率达到了82.5%,高于当时的其他方法。从8个不同层次定量分析兔骨骼肌损伤区域超声图像中个体肌纤维的几何特征和肌纤维分布的几何特征,从而反映不同损伤类型导致兔肌肉纹理声像图的差异,对热损伤、化学损伤、钝挫伤后肌纤维形状与结构改变所致的纹理特征变化均能定量描述,有力验证了计算机辅助诊断肌肉损伤的定量诊断能力。
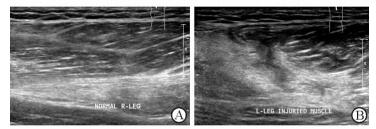
近年来,肌肉损伤的定量超声研究已取得了一定的研究成果[33-35],但初步临床应用主要针对运动或病理劳损肌肉开展,缺乏对最常见的肌肉损伤类型——外力致肌肉钝挫伤的研究。第二军医大学长征医院超声诊疗科超声实践表明,与正常健侧肌肉相比,损伤部位肌肉的超声图像特征有明显改变,肌肉条索样层次和羽毛状纹理模糊不清(图 4)。高频超声能直观观察损伤肌肉的结构形态及其与周围软组织的关系[36],动物实验研究验证的8种纹理特征参量可有效结合临床钝挫伤肌肉的纹理变化,但所提取的统计描述参量能否表征钝挫伤肌肉在静息或运动状态下的不同纹理变化并用于定量分析,尚有待进一步开展肌肉结构与功能损伤程度的相关评价。
|
图 4 股部健侧和损伤部位肌肉的超声二维图像特征 Fig 4 Ultrasonographic features of femoral normal and injured muscles A: Normal muscle shows clear texture and structure; B: Injured muscle shows hyperechoic and unclear textural structure. The images were derived from unpublished studies in Department of Ultrasound, Changzheng Hospital, Second Military Medical University |
近年来兴起的超声造影(contrast-enhanced ultrasound,CEUS)多着重于良恶性肿瘤的相关研究[37-39],对于骨骼肌肉系统的研究则刚刚起步。研究发现,彩色多普勒血流成像对于显示肌肉内血流信号不及超声造影敏感,且超声造影可用于新西兰白兔下肢骨骼肌组织血流灌注的定量研究[40-41];此外,应用新型超声造影剂SonoVue和低机械指数实时动态超声造影技术,能有效定量骨骼肌群的微循环变化信息、评价糖尿病患者下肢肌群微血管床分布情况,可作为活体定量肌肉组织绝对血流量及血管密度检测的新方法[20, 42]。然而,目前损伤修复时期骨骼肌群滋养血管超声影像的变化与其本身组织病理学的变化规律尚未完全清楚,特别是在损伤修复过程中,造影灌注超声图像上动脉期反映血管束架构的几何形状、排列密度、分布走向的演变规律仍未见定量研究。针对损伤肌肉的血流循环灌注情况在超声造影图像上的特征变化(图 5)[32],我们采用纹理替换、独立成分分析等计算机图像处理技术实现了人工智能对肌肉损伤区域模糊边缘的分割[43],为下一步实现综合定量智能化诊断奠定了基础,主要包括:对受损肌群修复后反映滋养血管束排列变化的造影剂图像纹理分布和回声强度等进行定量研究;提取血管束形状的单像素骨架信息,描述骨架连续性和骨架曲率分布;提出图像区域纹理特征,从频域信息描述血管束的分布密度和分布走向;利用神经网络方法自适应权重学习血管束的几何特征和纹理特征,构建骨骼肌超声造影图像的定量分析指标。
|
图 5 不同程度肌肉损伤的超声造影图像特征[32] Fig 5 Contrast-enhanced ultrasonographic features of injured muscles of varying degrees[32] A: 1 d after injury, anechoic region appears without ultrasonic contrast agent filling; B: 7 d after injury, region of interest displays ultrasonic contrast agents appearing in the filling-defect lesion |
4 展望
骨骼肌超声已成为国内外学者研究的热点,目前报道的计算机辅助定量诊断基本围绕某种特定类型的肌肉病损展开。第二军医大学长征医院超声诊疗科前期研究提出了8种有效纹理特征描述参量,是基于少数几种类型的骨骼肌损伤实验模型和较为初期的骨骼肌损伤临床病例,其在超声医师肉眼判读不明显或不同医师主观判断差异较大时有一定的客观意义。考虑到骨骼肌不同损伤的超声图像表征权重不同,下一阶段研究首先应根据临床不同肌肉损伤特点逐步改进目前采用的超声回波强度界面多级分解法等计算机图像处理技术,尝试开发更具针对性的骨骼肌声像图计算机纹理定量识别分析方法,精确探讨骨骼肌损伤后的声像图纹理特征与病理学演变规律,构建骨骼肌损伤超声影像学快速定量诊断与疗效分级评价的流程框架。其次,由于超声图像纹理特征受超声仪器显示信息的限制,会产生图像噪声或变形,超声图像纹理定量分析过程需确保超声仪器系统参数恒定,以消除对照研究中该因素的影响,因此未来仍需进行大样本研究,并针对原始数据库探索出一套不受超声仪器型号限定和扫描参数影响的横纹肌损伤纹理特征定量分析与评价体系。
目前先进的实时超声造影技术正逐步应用到骨骼肌系统[44]。其优势是可对骨骼肌血流灌注情况进行连续动态监测,通过比对造影剂灌注超声视频图像中血管束几何形状和排列分布随时间变化的规律,利用贝叶斯跟踪框架法跟踪超声造影灌注视频图像中血管束的形成,从血管束几何形状和空间排列分布两方面对造影视频资料进行动态定量分析,对损伤修复时期骨骼肌群滋养血管超声影像变化做出快速、准确的诊断,从而提升骨骼肌损伤修复的超声定性诊断价值。未来还可利用计算机图像技术根据肌肉损伤纹理的统计特征相似性绘制肌肉纤维纹理特点,并采用参数化方法仿真肌肉损伤用于虚拟肌肉手术系统[45],对于指导临床精准化诊疗具有重要的理论意义和应用价值。
| [1] | FRICK M A, MURTHY N S. Imaging of elbow:muscle and tendon injuries[J]. Semin Musculoskelet Radiol, 2010, 14: 430–437. DOI: 10.1055/s-0030-1263258 |
| [2] | WOODHOUSE J B, McNALLY E G. Ultrasound of skeletal muscle injury:an update[J]. Semin Ultrasound CT MR, 2011, 32: 91–100. DOI: 10.1053/j.sult.2010.12.002 |
| [3] | SAFARI S, NAJAFI I, HOSSEINI M, SANADGOL H, SHARIFI A, ALAVI MOGHADAM M, et al. Outcomes of fasciotomy in patients with crush-induced acute kidney injury after Bam earthquake[J]. Iran J Kidney Dis, 2011, 5: 25–28. |
| [4] | ZAIDMAN C M, WU J S, KAPUR K, PASTERNAK A, MADABUSI L, YIM S, et al. Quantitative muscle ultrasound detects disease progression in Duchenne muscular dystrophy[J]. Ann Neurol, 2017, 81: 633–640. DOI: 10.1002/ana.v81.5 |
| [5] | 徐哈宁, 肖慧, 侯宏录, 黎正根. 基于UKF的简化交互多模型视频图像机动目标跟踪算法[J]. 光电工程, 2010, 37: 14–18. DOI: 10.3969/j.issn.1003-501X.2010.09.003 |
| [6] | 王希海, 李琦, 潘诗农. 磁共振扩散张量成像技术在骨骼肌损伤中的应用进展[J]. 中国医学影像技术, 2011, 27: 1070–1073. |
| [7] | STRANDBERG S, LINDSTRÖM M, WRETLING M L, ASPELIN P, SHALABI A. Muscle morphometric effect of anterior cruciate ligament injury measured by computed tomography:aspects on using non-injured leg as control[J]. BMC Musculoskelet Disord, 2013, 14: 150. DOI: 10.1186/1471-2474-14-150 |
| [8] | FARJOODI P, MESFIN A, CARRINO J A, KHANNA A J. Magnetic resonance imaging of the musculoskeletal system:basic science, pulse sequences, and a systematic approach to image interpretation[J]. J Bone Joint Surg Am, 2010, 92(Suppl 2): 105–116. DOI: 10.2106/JBJS.J.00783 |
| [9] | 赵佳琦, 何金, 章建全. 男性乳腺癌多模式超声影像学特征分析[J]. 第二军医大学学报, 2009, 30: 917–920. |
| [10] | POTANAS C P, ARMBRUST L J, KLOCKE E E, LISTER S A, JIMENEZ D A, SALTYSIAK K A. Ultrasonographic and magnetic resonance imaging diagnosis of an oropharyneal wood penetrating injury in a dog[J/OL]. J Am Anim Hosp Assoc, 2011, 47:e1-e6. doi:10.5326/JAAHA-MS-5506. |
| [11] | 闵加艳, 邹建中. 纹理分析在二维超声图像中的应用[J]. 中国介入影像与治疗学, 2012, 9: 389–391. |
| [12] | GAO S, PENG Y, GUO H, LIU W, GAO T, XU Y, et al. Texture analysis and classification of ultrasound liver images[J]. Biomed Mater Eng, 2014, 24: 1209–1216. |
| [13] | MORARU L, MOLDOVANU S, BISWAS A. Optimization of breast lesion segmentation in texture feature space approach[J]. Med Eng Phys, 2014, 36: 129–135. DOI: 10.1016/j.medengphy.2013.05.013 |
| [14] | NARCHI H, MAHMOUD-GHONEIM D, SKINNER A, COGINGS P. Texture analysis of periventricular echogenicity on neonatal cranial ultrasound predicts periventricular leukomalacia[J]. J Neonatal Perinatal Med, 2013, 6: 117–124. |
| [15] | CHEN D R, HUANG Y L, LIN S H. Computer-aided diagnosis with textural features for breast lesions in sonograms[J]. Comput Med Imaging Graph, 2011, 35: 220–226. DOI: 10.1016/j.compmedimag.2010.11.003 |
| [16] | IAKOVIDIS D K, KERAMIDAS E G, MAROULIS D. Fusion of fuzzy statistical distributions for classification of thyroid ultrasound patterns[J]. Artif Intell Med, 2010, 50: 33–41. DOI: 10.1016/j.artmed.2010.04.004 |
| [17] | 徐琪. 一种新的纹理描述方法及其应用[D]. 上海: 复旦大学, 2011. https://wenku.baidu.com/view/b3278294c5da50e2524d7ff9.html |
| [18] | JIMÉNEZ-DÍAZ F, JIMENA I, LUQUE E, MENDIZÁBAL S, BOUFFARD A, JIMÉNEZ-REINA L, et al. Experimental muscle injury:correlation between ultrasound and histological findings[J]. Muscle Nerve, 2012, 45: 705–712. DOI: 10.1002/mus.23243 |
| [19] | 赵佳琦, 章建全, 盛建国, 赵璐璐, 潘倩. 不同技术级别超声医师对离体猪横纹肌理化损伤模型超声定性诊断的局限性分析[J/CD]. 中华医学超声杂志(电子版), 2014, 11: 763-769. |
| [20] | KRIX M, WEBER M A, KAUCZOR H U, DELORME S, KRAKOWSKI-ROOSEND H. Changes in the micro-circulation of skeletal muscle due to varied isometric exercise assessed by contrast-enhanced ultrasound[J]. Eur J Radiol, 2010, 76: 110–116. DOI: 10.1016/j.ejrad.2009.05.007 |
| [21] | PILLEN S, VAN DIJK J P, WEIJERS G, RAIJMANN W, KORTE C L, ZWARTS M J. Quantitative gray-scale analysis in skeletal muscle ultrasound:a comparison study of two ultrasound devices[J]. Muscle Nerve, 2009, 39: 781–786. DOI: 10.1002/mus.v39:6 |
| [22] | VERHULST F V, LEEUWESTEIJN A E, LOUWERENS J W, GEURTS A C, VAN ALFEN N, PILLEN S. Quantitative ultrasound of lower leg and foot muscles:feasibility and reference values[J]. Foot Ankle Surg, 2011, 17: 145–149. DOI: 10.1016/j.fas.2010.04.002 |
| [23] | ARTS I M, PILLEN S, SCHELHAAS H J, OVEREEM S, ZWARTS M J. Normal values for quantitative muscle ultrasonography in adults[J]. Muscle Nerve, 2010, 41: 32–41. DOI: 10.1002/mus.v41:1 |
| [24] | JANSEN M, VAN ALFEN N, NIJHUIS VAN DER SANDEN M W, VAN DIJK J P, PILLEN S, DE GROOT I J. Quantitative muscle ultrasound is a promising longitudinal follow-up tool in Duchenne muscular dystrophy[J]. Neuromuscul Disord, 2012, 22: 306–317. DOI: 10.1016/j.nmd.2011.10.020 |
| [25] | 周翔, 张青萍, 乐桂蓉. 肌肉高频超声成像及其纹理分析[J]. 中国超声医学杂志, 2001, 17: 70–72. DOI: 10.3969/j.issn.1002-0101.2001.01.024 |
| [26] | XU Q, WU H S, CHEN Y Q. Statistical multiscale blob features for classifying and retrieving image texture from large-scale databases[J]. J Electronic Imaging, 2010, 19: 2384–2391. |
| [27] | 徐琪, 陈雁秋, 章建全, 赵佳琦, 宋家琳, 贺延涛. 骨骼肌损伤超声图像纹理定量分析的强度界面多级分解法: 2011101424977[P]. 2012-01-18. |
| [28] | JAIN A K, FARROKHNIA F. Unsupervised texture segmentation using Gabor filters[J]. Pattern Recognit, 1991, 24: 1167–1186. DOI: 10.1016/0031-3203(91)90143-S |
| [29] | 赵佳琦, 章建全, 徐琪, 陈雁秋, 盛建国, 卢峰. 超声图像纹理分析技术对离体猪横纹肌理化损伤模型的定量研究[J/CD]. 中华医学超声杂志(电子版), 2013, 10: 674-680. |
| [30] | ZHAO J, ZHANG J, XU Q, SHENG J, DIAO Z, LIU S. Quantitative evaluation of striated muscle injury by multiscale blob features method[J]. J Med Ultrason(2001), 2016, 43: 337–345. DOI: 10.1007/s10396-016-0708-y |
| [31] | 王晓艳. 超声观察重物打击致家兔肌肉损伤的实验应用研究[D]. 大连: 大连医科大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10161-2008129410.htm |
| [32] | 赵佳琦, 章建全, 赵璐璐, 宋家琳, 潘倩, 盛建国. 不同消融功率致兔骨骼肌急性微波热损伤修复的超声影像演变特征[J/CD]. 中华医学超声杂志(电子版), 2016, 13: 779-788. |
| [33] | CUNNINGHAM R. The application of b-mode ultrasonography for analysis of human skeletal muscle[D]. Manchester, England, UK:Manchester Metropolitan University, 2015. |
| [34] | DARBY J, HODSON-TOLE E F, COSTEN N, LORAM I D. Automated regional analysis of B-mode ultrasound images of skeletal muscle movement[J]. J Appl Physiol(1985), 2012, 112: 313–327. DOI: 10.1152/japplphysiol.00701.2011 |
| [35] | MOLINARI F, CARESIO C, ACHARYA U R, MOOKIAH M R, MINETTO M A. Advances in quantitative muscle ultrasonography using texture analysis of ultrasound images[J]. Ultrasound Med Biol, 2015, 41: 2520–2532. DOI: 10.1016/j.ultrasmedbio.2015.04.021 |
| [36] | 高邓琴, 卢漫, 王硕华, 肖敏, 戴潇禹. 高频超声诊断肌肉损伤68例分析[J]. 实用医院临床杂志, 2014, 11: 148–150. DOI: 10.3969/j.issn.1672-6170.2014.05.057 |
| [37] | ZHENG S G, XU H X, LIU L N. Management of hepatocellular carcinoma:the role of contrast-enhanced ultrasound[J]. World J Radiol, 2014, 6: 7–14. DOI: 10.4329/wjr.v6.i1.7 |
| [38] | ZHAO H, XU R, OUYANG Q, CHEN L, DONG B, HUIHUA Y. Contrast-enhance ultrasound is helpful in the differentiation of malignant and benign breast lesions[J]. Eur J Radiol, 2010, 73: 288–293. DOI: 10.1016/j.ejrad.2009.05.043 |
| [39] | PARK J S, KIM H K, BANG B W, KIM S G, JEONG S, LEE D H. Effectiveness of contrast-enhanced harmonic endoscopic ultrasound for the evaluation of solid pancreatic masses[J]. World J Gastroenterol, 2014, 20: 518–524. DOI: 10.3748/wjg.v20.i2.518 |
| [40] | 王月香, 唐杰, 梅兴国, 张立海, 李文秀. 灰阶超声造影定量分析骨骼肌血流灌注的实验研究[J]. 中国超声医学杂志, 2008, 24: 591–593. DOI: 10.3969/j.issn.1002-0101.2008.07.005 |
| [41] | WEBER M A, KRIX M, JAPPE U, HUTTNER H B, HARTMANN M, MEYDING-LAMADÉ U, et al. Pathologic skeletal muscle perfusion in patients with myositis:detection with quantitative contrast-enhanced US-initial results[J]. Radiology, 2006, 238: 640–649. DOI: 10.1148/radiol.2382041822 |
| [42] | 郑德伸, 张泉, 查道刚, 胡锋, 杨莉, 刘伊丽. 对比超声定量大鼠后肢骨骼肌绝对血流量的研究[J]. 临床超声医学杂志, 2011, 13: 1–3. DOI: 10.3969/j.issn.1008-6978.2011.01.001 |
| [43] | 徐琪, 曾卫明. 一种基于结构化信息极大分解的肌肉损伤超声造影图像分割方法: 201410530036. 0[P]. 2015-02-09. |
| [44] | 张春东, 唐杰. 超声造影在骨骼肌病变中的应用进展[J]. 中华超声影像学杂志, 2014, 23: 725–727. DOI: 10.3760/cma.j.issn.1004-4477.2014.08.023 |
| [45] | 马健超, 陈国栋, 周霆. 基于场向参数化的肌肉纤维纹理合成研究[J]. 微型机与应用, 2017, 36: 18–21. |
 2017, Vol. 38
2017, Vol. 38


