2. 贵阳市第一人民医院病理科, 贵阳 550002;
3. 贵州医科大学基础医学院病理学教研室, 贵阳 550004
2. Department of Pathology, The First People's Hospital of Guiyang, Guiyang 550002, Guizhou, China;
3. Department of Pathology, School of Basic Medicine, Guizhou Medical University, Guiyang 550004, Guizhou, China
阿尔茨海默病(Alzheimer disease,AD)作为一种最常见的痴呆类型,是中枢神经系统最具毁损性的疾病之一,其治疗药物虽较多,但并未获得满意的疗效。在AD发病机制的众多假说中,最受关注的“β淀粉样肽(β-amyloid peptide, Aβ)级联假说”认为Aβ在AD发病过程中发挥核心作用[1],是各种原因诱发AD的共同通路,其引起的一系列神经毒性反应导致神经细胞功能紊乱和死亡,引发痴呆。建立以Aβ为靶点的治疗策略来指导药物研究,通过对Aβ及其相关蛋白的研究深入揭示AD发病机制并找到有效的治疗方法是当前研究热点。
从抑制Aβ的产生到对抗Aβ的毒性,中药具有多途径、多靶点、多层次的神经保护作用[2],但其治疗机制仍未明确。通过调节差异蛋白治疗疾病,显示可能性的分子及疗效基础成为当前发展中医中药的热点课题。中药石菖蒲为天南星科多年生草本植物石菖蒲的干燥根茎,其味辛性温,具有化湿开胃、开窍豁痰、醒神益智的功效[3],是AD治疗的常用中药,其公认的药理活性成分β-细辛醚具有较好的益智和脑保护作用。本实验以Aβ毒性相关的转基因动物模型为载体进行比较蛋白质组学研究,运用可视化方法识别小鼠脑组织中成对样本的差异表达蛋白,观察β-细辛醚通过调节关键蛋白改善小鼠学习记忆能力的疗效,从蛋白质水平寻找可能的药靶蛋白,为临床研究提供可靠的实验资料和理论依据。
1 材料和方法 1.1 实验动物与药物3个月龄的APPswe/PS1dE9双转基因小鼠40只,3个月龄的同背景品系C57BL/6J小鼠10只,雌雄各半,由中国医学科学院实验动物所遗传中心提供,许可证号:SCXK(京)2013-2002。动物实验经贵阳市第一人民医院动物伦理委员会批准,在SPF级实验室分笼分性别饲养,每笼5只,普通繁殖饲料饲养。
实验用β-细辛醚为中药石菖蒲的提取物,由南京广润生物制品有限公司提供(批号:GR-133-20141223),经高效液相色谱(HPLC)法鉴定纯度大于95%。
1.2 主要仪器与试剂ELx800UV型酶标仪(美国BioTek公司);HPLC仪(美国Agilent公司);UltiMate-3000纳升液相色谱仪(美国Dionex公司);Q-Exactive质谱仪(美国Thermo Fisher公司);UMAX PowerLook 2100XL-USB扫描仪(美国UMAX公司);Eppendorf Centrifuge 5417R型离心机(德国Eppendorf公司);同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)试剂盒(iTRAQ® Reagent-8Plex Multiplex Kit,美国Applied Biosystem公司);Strata-X C18除盐柱、SCX强阳离子交换柱(SCX 100A)购自美国Phenomenex公司;DMS-2型Morris水迷宫系统(中国医学科学院药物研究所)。多克隆兔抗组蛋白H2A和H2B抗体、β淀粉样前体蛋白(β-amyloid precursor protein,APP)免疫组化一抗购自英国Abcam公司;抗β-肌动蛋白(β-actin)抗体、抗IgG抗体(辣根过氧化物酶标记)、预染蛋白相对分子质量标准蛋白及可曝光标准蛋白等购自美国Sigma公司。
1.3 动物分组及给药方法实验动物分为5组:正常对照组,模型组,β-细辛醚高、中、低剂量治疗组,每组10只。模型组为APPswe/PS1dE9双转基因小鼠; 正常对照组为同背景品系C57BL/6J小鼠;β-细辛醚高、中、低剂量治疗组为APPswe/PS1dE9双转基因小鼠,药物剂量根据患者临床用量的等效剂量和动物体表面积折算而得。对各组小鼠进行灌胃给药,β-细辛醚高、中、低剂量组的给药剂量分别为15、10、5 mg/(kg·d),正常对照组和模型组给予等量生理盐水,历时90 d。
1.4 学习记忆能力测试用Morris水迷宫行为学方法进行学习记忆能力检测,历时5 d。第1~4天进行定向航行实验,记录60 s内大鼠从不同象限入水到爬上平台(固定于第1象限)所需时间(即逃避潜伏期),每天连续测试4次,连续4 d,取其平均值。第5天撤去平台, 进行空间探索实验,记录大鼠第1次穿越原平台时间及1 min内穿过原平台位置的次数。根据测试结果,选择疗效显著的剂量组作为后续实验的治疗组。
1.5 动物处理所有组别在治疗结束后次日进行Morris水迷宫测试,测试24 h后将各组小鼠断颈处死,用预冷的磷酸盐缓冲液(PBS)清洗干净后,小心剥离脑组织,称量后迅速于冰盘上沿矢状缝将脑组织一切为二。取左侧脑组织置于-80 ℃冰箱冻存用于蛋白质组学检测。将右侧脑组织沿正矢状面片开,厚度为0.2 cm,放入4%多聚甲醛溶液中浸泡固定用于组织学检查;其余脑组织置于-80 ℃冰箱冻存用于指标检测。
1.6 免疫组织化学染色检测小鼠脑组织中APP的表达取材后用常规方法进行石蜡包埋,取5 μm厚度切片,用免疫组织化学法(EnVision二步法)染色,一抗为APP兔多克隆抗体,1:150稀释,以试剂公司提供已知阳性片作为阳性对照,以PBS代替一抗作为阴性对照。用DAB显色后在光镜下观察。综合考虑切片中阳性细胞所占观察细胞数的百分比和阳性细胞着色强度两项指标,随机选取小鼠大脑皮质8个高倍视野(×400)进行计算,半定量判定结果。阳性细胞所占比例:阳性细胞数≤10%记1分,11%~50%记2分,51%~75%记3分,>75%记4分;阳性细胞着色强度:细胞无色记0分,淡黄色记1分,棕黄色记2分,棕褐色记3分。这两项指标的总积分在4分以上者代表阳性表达。
1.7 iTRAQ技术分析鉴定差异蛋白提取各组动物脑组织总蛋白,行还原烷基化和酶解消化处理,每组样本消化的全部肽段分别用iTRAQ试剂标记,利用二维液相色谱串联质谱(2D-LC-MS)技术,经过HPLC肽段分离后,用Strata-X C18反相色谱除盐纯化肽段,采用Q-Exactive质谱仪检测肽段信号。质谱扫描完毕后,将得到的原始质谱文件转换成质谱峰文件,质谱数据用PD(Thermo Proteome Discoverer 1.3)软件进行数据库检索,与数据库中的序列进行搜索匹配,并对质谱数据进行过滤筛选和质量控制,从UniProt_2015_mus数据库中获取可信的蛋白质定性信息,并通过报告基团对组织样本的蛋白质进行定量分析。
1.8 生物信息学分析基于iTRAQ定量比值,利用95%置信区间法则计算蛋白质差异是否具有统计学意义,并通过差异倍数筛选出差异存在统计学意义的蛋白质作为后续分析的备选。通过KEGG(Kyoto encyclopedia of genes and genomes)软件对差异蛋白质进行通路分析及富集分析,采用KOBAS 2.0软件对比蛋白质的相似序列并进行通路注释,得到蛋白质参与的生物通路。
1.9 小鼠脑组织组蛋白H2A、H2B的蛋白表达水平鉴定用玻璃匀浆器将各组小鼠脑组织在冰上匀浆,提取总蛋白,定量后用蛋白质印迹法检测组蛋白H2A和H2B的表达水平,聚丙烯酰胺凝胶电泳后转至PVDF膜上印迹显色,分别加入一抗(H2A和H2B,1:2 000;β-actin,1:1 000)和二抗(1:6 500)孵育后曝光显影,定影。以β-actin蛋白作为内参照,用LabWorks软件对图像进行灰度分析,结果以组蛋白H2A和H2B条带与β-actin条带灰度的百分比值作为H2A和H2B蛋白的相对表达量。
1.10 统计学处理应用SPSS 20.0软件进行统计学分析,实验数据以x±s表示,组间差异的比较采用t检验和秩和检验, 检验水准(α)为0.05。
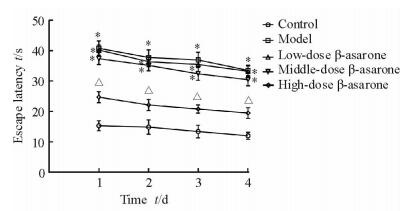
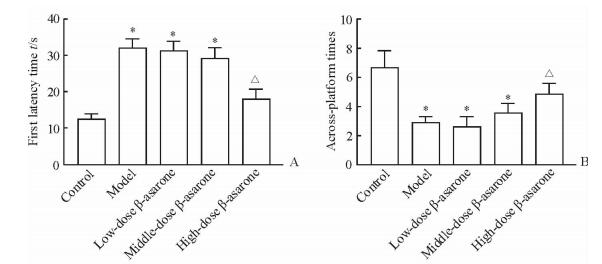
2 结果 2.1 学习记忆能力测定定向航行和空间探索实验结果显示,模型组小鼠的学习记忆能力下降,经β-细辛醚治疗后学习记忆能力有所回升。与模型组比较,高剂量治疗组小鼠逃避潜伏期的时间和第1次穿越平台时间缩短(P<0.05),平台穿越次数增多(P<0.05),中、低剂量治疗组小鼠未见明显改善(P>0.05),故选取高剂量组作为后续实验的治疗组。见图 1、2。
|
图 1 各组小鼠的逃避潜伏期时间 Fig 1 Escape latency of mice in each group *P < 0.05 vs control group; △P < 0.05 vs model group. n=10, x±s |
|
图 2 各组小鼠的第1次穿越平台时间(A)和穿越次数(B) Fig 2 First latency time required to find the escape platform (A) and across-platform times (B) of mice in each group *P < 0.05 vs control group; △P < 0.05 vs model group. n=10, x±s |
2.2 小鼠脑组织中APP的表达
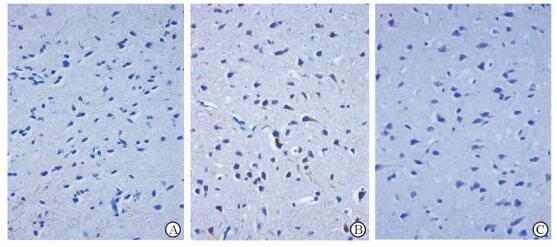
免疫组织化学染色可见阳性染色位于细胞膜和(或)细胞质,呈棕黄色(图 3)。与正常对照组[(1.30±0.30)分]相比,模型组小鼠脑组织中APP的表达升高[(5.60±0.28)分,P<0.05];与模型组相比,β-细辛醚治疗组小鼠脑组织中APP的表达减少[(3.20±0.26)分,P<0.05]。
|
图 3 各组小鼠脑组织中APP的表达 Fig 3 Expression of APP in brain tissues of mice in each group A: Control group; B: Model group; C: β-Asarone treatment group. APP: β-Amyloid precursor protein. EnVision immunohistochemical staining. Original magnification: ×40 |
2.3 蛋白质谱鉴定及表达差异分析
实验通过选取差异倍数为1.2倍并与P≤0.05相结合进行差异蛋白质的筛选。结果显示,与正常对照组相比,模型组中有59种蛋白质表达上调、35种蛋白质表达下调;与模型组相比,β-细辛醚治疗组中有37种蛋白质表达上调、107种蛋白质表达下调。
2.4 KEGG数据库通路富集结果以P < 0.05为筛选标准,经过富集分析,模型组与正常对照组的差异蛋白主要参与了13条通路(表 1),β-细辛醚治疗组与模型组的差异蛋白主要参与了10条通路(表 2)。进一步比对模型组和β-细辛醚治疗组的通路调控结果,发现可信度最高的1条共同通路,即systemic lupus erythematosus,匹配到3个基因转录翻译的差异蛋白质,分别是组蛋白H2A 1-H型(Q8CGP6)、H2B 2-E型(Q64524)、H2B 1-F/J/L型(P10853)。其中,模型组与正常对照组相比,组蛋白H2A 1-H型、H2B 2-E型、H2B 1-F/J/L型表达上调(分别为1.219、1.617、1.385);经过β-细辛醚治疗后,上述3个蛋白的表达下降(分别为0.652、0.738、0.747)。
|
|
表 1 模型组与正常对照组的差异蛋白参与的13条通路 Tab 1 Thirteen pathways associated with differential proteins in model and control groups |
|
|
表 2 β-细辛醚治疗组与模型组的差异蛋白参与的10条通路 Tab 2 Ten pathways associated with differential proteins in model and β-asarone treatment groups |
2.5 组蛋白H2A和H2B的蛋白表达鉴定结果
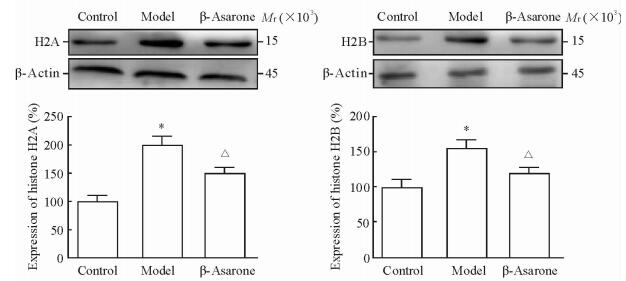
蛋白质印迹分析检测结果显示,与正常对照组相比,模型组小鼠脑组织中组蛋白H2A和H2B的蛋白表达水平升高(P<0.05),经β-细辛醚治疗后二者明显下降(P<0.05),见图 4。
|
图 4 各组小鼠脑组织中组蛋白H2A和H2B的表达水平 Fig 4 Expression of histone H2A and H2B in brain tissues of mice in each group *P < 0.05 vs control group; △P < 0.05 vs model group. n=10, x±s |
3 讨论
AD以老年斑和神经原纤维缠结为主要病理学改变,老年斑的核心物质Aβ随着浓度升高引发神经毒性的环形事件,最终导致记忆力减退与认知功能障碍。APP通过蛋白酶解途径裂解形成Aβ,其与早老素1(presenilin 1,PS1)均是AD的重要相关蛋白质,在AD的病理进程中发挥重要作用。APPswe/PS1dE9双转基因痴呆小鼠模型是利用APPswe转基因小鼠与PS1转基因小鼠杂交建立[4],也是Aβ毒性相关的痴呆动物研究模型之一。该模型在3个月龄开始即出现逃避潜伏和空间探索的记忆能力缺陷。本研究以β-细辛醚[15 mg/(kg·d)]对3个月龄APPswe/PS1dE9双转基因模型小鼠连续灌胃90 d后进行Morris水迷宫行为学测试和脑组织APP检测,证实经过药物处理,缩短了模型小鼠的逃避潜伏期和穿越平台时间,并增加了小鼠的平台穿越次数,降低了APP的表达,显示出β-细辛醚在改善小鼠学习记忆能力和减少Aβ沉积方面的积极作用(考虑到药物本身的毒性作用,又是长期给药,在剂量设定上有所保留,药物处理的中、低剂量治疗组未显示出有统计学意义的学习记忆能力改善)。为进一步明确药物产生疗效的物质基础,本研究进行了差异蛋白的检测和验证,发现β-细辛醚调控了systemic lupus erythematosus通路中组蛋白H2A 1-H型、H2B 2-E型和H2B 1-F/J/L型蛋白的表达。
组蛋白是存在于真核生物核内构成染色体的基本结构蛋白,包括H2A、H2B、H3、H4和H1,由前4型各2分子构成八聚体成为核小体核心,H1作为连接分子位于核小体之间调节其在DNA高级结构的装配。组蛋白N末端保守且易发生转录后修饰,修饰的方式和数量不同可产生不同的表观遗传学信息。组蛋白修饰参与广泛的神经生物学过程,包括中枢神经系统发育、记忆的形成、星形胶质细胞源性和脑源性神经营养因子的转录,以及各种神经系统疾病如AD等。AD患者海马组织中组蛋白H2A变体H2AX丝氨酸磷酸化水平升高,与DNA损伤有关[5],H2B的泛素化则在DNA复制与修复、基因表达及转录调控过程中起重要作用[6],同时,组蛋白的修饰可通过相互之间的促进和抑制形成修饰级联来发挥作用。本实验结果显示,与正常对照组相比,模型小鼠脑组织中组蛋白H2A 1-H、H2B 2-E和H2B 1-F/J/L型的表达上调,经β-细辛醚治疗后上述组蛋白表达均降低,提示β-细辛醚可能介入组蛋白修饰过程而起到治疗作用。
值得一提的是,组蛋白的乙酰化与AD的发生发展关系密切,AD患者脑内总组蛋白的乙酰化修饰显著增加,促进多个基因的转录活性[7];在APP剪切酶BACE1与PS1等基因的启动子区域组蛋白发生乙酰化有利于促进Aβ的形成[8-9],通过乙酰化过程调节脑内Aβ的含量并影响Aβ的神经毒性作用。组蛋白的乙酰化过程主要由组蛋白乙酰化转移酶(HATs)与组蛋白去乙酰化酶(HDACs)动态调节,乙酰化可激活基因的转录活性,去乙酰化则可沉默或抑制基因转录[10]。AD患者早期出现内嗅皮质与海马CA1区的Ⅰ类去乙酰化酶HDAC2表达增加,这2个区域也是AD患者脑组织受损最早、最严重的区域[11-12];Ⅱ类去乙酰化酶HDAC6表达降低可降低tau蛋白在Thr231位点的磷酸化水平,从而调节tau磷酸化蛋白向异常蛋白包涵体聚集[13];SIRT1作为第Ⅲ类HDACs,对神经保护、突触可塑和学习记忆起重要作用,可通过与不同的非组蛋白和组蛋白的相互作用来完成不同的功能[14]。研究表明,AD患者顶叶皮质中SIRT1显著减少,与Aβ和tau蛋白的异常沉积相关[15];AD小鼠模型中出现SIRT1过表达,可以激活编码解聚素和金属蛋白酶10(ADAM10)α分泌酶的基因,从而减少Aβ的产生和老年斑的形成;SIRT1还能够调节Notch通路从而修复神经元损伤[16]。目前,HDACs成为较为理想的AD药物干预靶点,HDACs抑制剂也是研究较为广泛的针对AD表观遗传的治疗措施。当然,β-细辛醚是否可以产生HDACs抑制剂的作用需要进一步研究。
AD的发生由遗传因素和环境因素共同决定,遗传因素包括基因突变等传统意义的遗传信息和表观遗传学信息,表观遗传信息的改变是可以逆转的,在早期治疗指导上有重要意义。本研究通过比对APPswe/PS1dE9双转基因小鼠模型脑组织中的差异蛋白质并进行通路富集的分析,寻找到β-细辛醚产生疗效的重要靶标蛋白,即:组蛋白H2A 1-H型、H2B 2-E型和H2B 1-F/J/L型。提示β-细辛醚可能通过调节上述3种蛋白参与表观遗传修饰方面作用降低Aβ毒性,改善学习记忆能力;同时表明药物的治疗作用可以存在于早期干预的环节,提供了β-细辛醚抗痴呆疗效的新信息。
| [1] | HARDY J, SELKOE D J. The amlyoid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J]. Science, 2002, 297: 353–356. DOI: 10.1126/science.1072994 |
| [2] | 李娜. 基于"Aβ级联假说"的中药治疗阿尔茨海默病研究进展[J]. 中国中西医结合杂志, 2011, 31: 1714–1720. |
| [3] | 陈新俊, 程黎晖. 石菖蒲的药理作用和临床应用探讨[J]. 中草药, 2007, 38: 附1–附3. DOI: 10.3321/j.issn:0253-2670.2007.01.053 |
| [4] | WANG D M, YANG Y J, ZHANG L, ZHANG X, GUAN F F, ZHANG L F. Naringin enhances CaMKⅡ activity and improves long-term memory in a mouse model of Alzheimer's disease[J]. Int J Mol Sci, 2013, 14: 5576–5586. DOI: 10.3390/ijms14035576 |
| [5] | MYUNG N H, ZHU X, KRUMAN I I, CASTELLANI R J, PETERSEN R B, SIEDLAK S L, et al. Evidence of DNA damage in Alzheimer disease:phosphorylation of histone H2AX in astrocytes[J]. Age (Dordr), 2008, 30: 209–215. DOI: 10.1007/s11357-008-9050-7 |
| [6] | SHEMA E, TIROSH I, AYLON Y, HUANG J, YE C, MOSKOVITS N, et al. The histone H2B-specific ubiquitin ligase RNF20/hBRE1 acts as a putative tumor suppressor through selective regulation of gene expression[J]. Genes Dev, 2008, 22: 2664–2676. DOI: 10.1101/gad.1703008 |
| [7] | NARAYAN P J, LILL C, FAULL R, CURTIS M A, DRAGUNOW M. Increased acetyl and total histone levels in post-mortem Alzheimer's disease brain[J]. Neurobiol Dis, 2015, 74: 281–294. DOI: 10.1016/j.nbd.2014.11.023 |
| [8] | LU X, DENG Y, YU D, CAO H, WANG L, LIU L, et al. Histone acetyltransferase p300 mediates histone acetylation of PS1 and BACE1 in a cellular model of Alzheimer's disease[J/OL]. PLoS One, 2014, 9:e103067. doi:10.1371/journal.pone.0103067. |
| [9] | MARQUES S C, LEMOS R, FERREIRO E, MARTINS M, DE MENDONÇA A, SANTANA I, et al. Epigenetic regulation of BACE1 in Alzheimer's disease patients and in transgenic mice[J]. Neuroscience, 2012, 220: 256–266. DOI: 10.1016/j.neuroscience.2012.06.029 |
| [10] | BERGER S L. The complex language of chromatin regulation during transcription[J]. Nature, 2007, 447: 407–412. DOI: 10.1038/nature05915 |
| [11] | GUAN J S, HAGGARTY S J, GIACOMETTI E, DANNENBERG J H, JOSEPH N, GAO J, et al. HDAC2 negatively regulates memory formation and synaptic plasticity[J]. Nature, 2009, 459: 55–60. DOI: 10.1038/nature07925 |
| [12] | GRÄFF J, REI D, GUAN J S, WANG W Y, SEO J, HENNIG K M, et al. An epigenetic blockade of cognitive functions in the neurodegenerating brain[J]. Nature, 2012, 483: 222–226. DOI: 10.1038/nature10849 |
| [13] | DING H, DOLAN P J, JOHNSON G V. Histone deacetylase 6 interacts with the microtubule-associated protein tau[J]. J Neurochem, 2008, 106: 2119–2130. DOI: 10.1111/jnc.2008.106.issue-5 |
| [14] | BONDA D J, LEE H G, CAMINS A, PALLÀS M, CASADESUS G, SMITH M A, et al. The sirtuin pathway in adeing and Alzheimer disease:mechanistic and therapeutic considerations[J]. Lancet Neurol, 2011, 10: 275–279. DOI: 10.1016/S1474-4422(11)70013-8 |
| [15] | JULIEN C, TREMBLAY C, EMOND V, LEBBADI M, SALEM N Jr, BENNETT D A, et al. Sirtuin 1 reduction parallels the accumulation of tau in Alzheimer disease[J]. J Neuropathol Exp Neurol, 2009, 68: 48–58. DOI: 10.1097/NEN.0b013e3181922348 |
| [16] | DONMEZ G, WANG D, COHEN D E, GUARENTE L. SIRT1 suppresses β-amyloid production by activating the α-secretase gene ADAM10[J]. Cell, 2010, 142: 320–332. DOI: 10.1016/j.cell.2010.06.020 |
 2017, Vol. 38
2017, Vol. 38


