2. 第二军医大学基础部医学遗传学教研室, 上海 200433
2. Department of Medical Genetics, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
随着社会的发展,电离辐射的应用已经渗透到我们生活中的各个角落。放射性检查或治疗使用的医疗设备、安检使用的X射线机等,都是我们生活中常见的辐射源。过多地接触电离辐射会影响自身健康。放射工作人员随着累计接触剂量、工龄的增加,会出现皮肤损伤、眼晶状体混浊、外周血细胞和中性粒细胞减少等症状[1]。男性生殖系统作为容易受电离辐射影响的系统之一,与后代健康水平密切相关[2]。已有文献报道,长期暴露于电离辐射的人群,其精液质量会出现不同程度的下降,包括精液浓度降低、精子形态异常等[3-4]。自噬是广泛存在于真核生物内的一种现象,通过降解包裹自噬溶酶体内受损的蛋白质及细胞器,实现细胞本身的代谢需要及某些细胞器更新,是细胞重要的修复途径[5-6]。近期有研究发现自噬可通过多种途径在化学毒物诱导的生精细胞凋亡过程中发挥保护作用[7-8],但自噬是否在电离辐射诱导的生精细胞凋亡过程中具有保护作用还未见报道。本实验主要通过研究细胞自噬在电离辐射诱导的小鼠精母细胞GC-2凋亡过程中的作用,探讨电离辐射诱导的细胞自噬与其诱导的细胞凋亡之间的关系。
1 材料和方法 1.1 材料小鼠精母细胞GC-2购自ATCC公司(ATCC Number: CRL-2196), 细胞培养液DMEM和10%胎牛血清(FBS)购自美国Invitrogen公司,1%青霉素、1%链霉素、蛋白电泳所需试剂购自上海博光生物科技有限公司。自噬抑制剂3-甲基腺嘌呤(3-MA)购自美国Gene Operation公司。自噬微管相关蛋白轻链3(LC3)小鼠单克隆抗体(Cat No.48394)、β-actin小鼠单克隆抗体(Cat No.8226)、自噬检测试剂盒购自英国Abcam公司,自噬相关蛋白Beclin1小鼠单克隆抗体(Cat No.3495)购自美国CST公司。Annexin Ⅴ-FITC细胞凋亡检测试剂盒、BCA蛋白定量试剂盒及原位末端转移酶标记(TUNEL)法检测试剂盒购自上海碧云天生物技术研究所。
1.2 细胞培养及处理取GC-2细胞用含10% FBS、1%青霉素、1%链霉素的DMEM培养液,在37 ℃、5% CO2孵箱中培养,每2 d更换1次培养液,取对数生长期细胞用于实验。细胞分组:空白对照组,2、4、8 Gy 60Co辐射处理组,自噬抑制剂3-MA单独处理组,2、4、8 Gy 60Co辐射+3-MA处理组。根据分组情况,先用5 mmol/L 3-MA预处理细胞2 h,更换培养液后,再用相应剂量电离辐射处理细胞, 继续在孵箱内培养24 h后进行下一步实验。
1.3 蛋白质印迹法检测自噬相关蛋白LC3和Beclin1表达培养皿里加入蛋白提取液RIPA和蛋白酶抑制剂PMSF, 在冰上放置30 min, 4 ℃、1 700×g离心10 min。BCA法测定蛋白浓度,取等量总蛋白与5×SDS上样缓冲液混合,100 ℃变性10 min。行5% SDS-PAGE、转膜,5%脱脂奶粉溶液室温下封闭2 h, PBST洗膜3次, 在4 ℃摇床上孵育一抗过夜。TBST洗膜3次,室温孵育二抗2 h,用Odessey红外荧光扫描成像系统检测蛋白荧光强度。
1.4 TUNEL法检测细胞凋亡情况PBS洗涤细胞涂片1次,4%多聚甲醛溶液固定细胞60 min, PBS洗涤后加入含0.1% Triton X-100的PBS并冰浴2 min。PBS洗涤2次,加入50 μL TUNEL检测液,37 ℃避光孵育60 min。PBS洗涤2次,加入100 μL打孔液,室温避光孵育10 min。加入100 μL DAPI,室温避光孵育10 min,用含0.1% Triton X-100的PBS洗涤3次,用抗荧光淬灭封片液封片后置于荧光显微镜下观察。
1.5 流式细胞术检测细胞凋亡情况使用离心管收集细胞培养液及胰酶消化后的细胞,2 000×g离心5 min,弃上清,用PBS重悬细胞并计数。取5×104~1×105重悬的细胞,1 000×g离心5 min,弃上清,加入195 μL Annexin Ⅴ-FITC结合液轻轻重悬细胞。加入5 μL Annexin Ⅴ-FITC,轻轻混匀。加入10 μL碘化丙啶染色液,轻轻混匀。室温避光孵育10 min,上流式细胞仪检测。
1.6 细胞自噬检测采用一种特殊的可以穿过细胞双分子层的荧光示踪剂对自噬小泡进行特异性标记。用1×检测缓冲液洗涤细胞涂片2次;100 μL显微双检测试剂覆盖细胞涂片,37 ℃避光孵育30 min, 1×检测缓冲液洗涤细胞涂片1次;4%多聚甲醛溶液固定20 min,1×检测缓冲液洗涤3次,用抗荧光淬灭封片液封片后置于荧光显微镜下观察。
1.7 统计学处理应用SPSS 19.0软件进行统计学分析,实验数据以x±s表示,组间比较采用t检验或单因素方差分析。检验水准(α)为0.05。
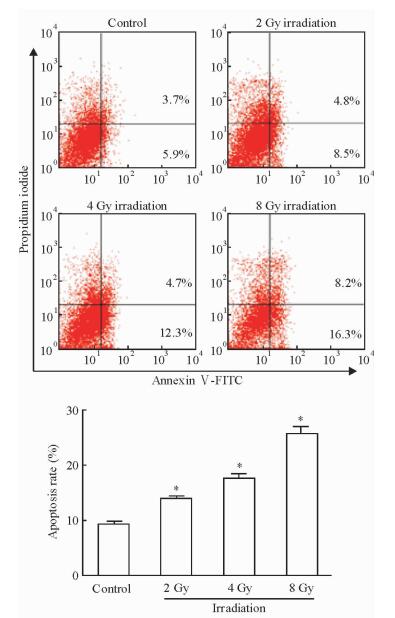
2 结果 2.1 电离辐射诱导精母细胞GC-2发生凋亡采用TUNEL法检测细胞凋亡情况,结果显示4 Gy辐射剂量处理组GC-2细胞的荧光强度明显强于对照组(图 1),表明经过电离辐射处理后GC-2细胞的凋亡数量多于对照组,电离辐射可以诱导精母细胞发生凋亡。流式细胞术检测细胞凋亡结果显示,与对照组相比,GC-2细胞经电离辐射处理后凋亡率明显增加,且随着辐射剂量的增加GC-2细胞凋亡率上升(P<0.05,图 2),说明电离辐射可以以一种剂量相关的方式诱导GC-2细胞发生凋亡。

|
图 1 TUNEL法检测精母细胞GC-2的凋亡情况 Fig 1 Apoptosis of spermatocytes GC-2 detected by TUNEL method A: Control group; B: 4 Gy irradiation group. TUNEL: In situ terminal transferase labeling. The arrows indicate apoptosis cells. Original magnification: ×200 |
|
图 2 流式细胞术检测精母细胞GC-2的凋亡情况 Fig 2 Apoptosis of spermatocytes GC-2 detected by flow cytometry *P < 0.05 vs control group. n=3, x±s |
2.2 电离辐射增强精母细胞GC-2自噬水平蛋白质印迹法检测
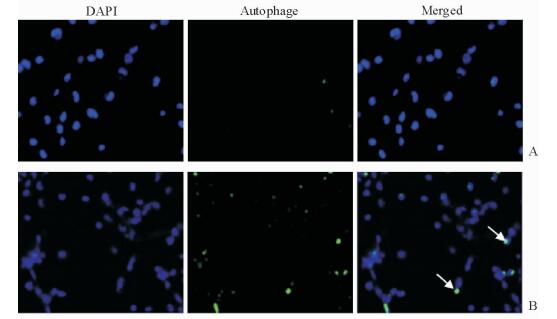
结果如图 3所示,经过不同剂量辐射处理后,GC-2细胞自噬相关蛋白LC3-Ⅱ与Beclin1的表达水平与对照组相比均升高(P<0.05),提示电离辐射可以诱导GC-2细胞内自噬水平的增加。荧光显微镜下可见,4 Gy辐射剂量处理组GC-2细胞的荧光强度强于未辐射对照组(图 4),证明经过电离辐射处理后的GC-2细胞的自噬体数量多于对照组,提示电离辐射可以增强细胞内的自噬水平。

|
图 3 电离辐射处理精母细胞GC-2后自噬相关蛋白的表达 Fig 3 Expression of autophagy-related proteins inspermatocytes GC-2 treated with ionizing radiation LC3: Microtubule-associated protein light chain 3. *P < 0.05 vs control group. n=3, x±s |
|
图 4 荧光显微镜下观察自噬小体的形成 Fig 4 Formation of autophagosome under fluorescence microscope A: Control group; B: 4 Gy irradiation group. The arrows indicate autophagosomes. Original magnification: ×200 |
2.3 抑制自噬可以增强电离辐射对精母细胞GC-2的杀伤作用
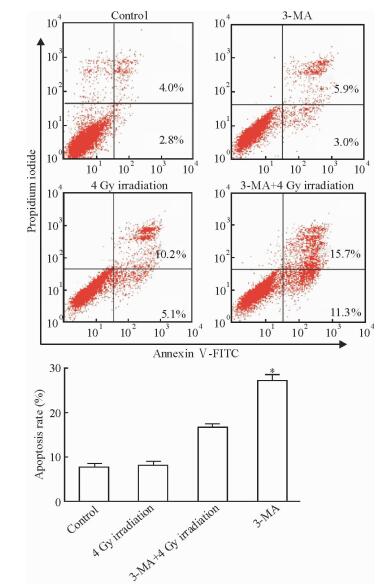
GC-2细胞经5 mmol/L自噬抑制剂3-MA处理后再给予4 Gy辐射,与单纯4 Gy辐射处理组相比,自噬相关蛋白LC3-Ⅱ和Beclin1的表达水平降低(P<0.05,图 5),证明电离辐射所诱导的GC-2细胞自噬能被3-MA抑制。流式细胞术检测结果(图 6)显示,5 mmol/L 3-MA不会引起细胞凋亡增加(P>0.05)。用5 mmol/L 3-MA处理GC-2细胞后再给予4 Gy辐射,细胞凋亡率较单纯4 Gy辐射组升高(P<0.05),提示抑制GC-2细胞自噬后可增强电离辐射诱导的细胞凋亡。

|
图 5 抑制自噬加电离辐射处理后精母细胞GC-2自噬相关蛋白的表达 Fig 5 Expression of autophagy-related proteins in spermatocytes GC-2 treated with autophagy inhibitor and ionizing radiation LC3: Microtubule-associated protein light chain 3; 3-MA: 3-Methyladenine. *P < 0.05 vs control group; △P < 0.05 vs 4 Gy irradiation group. n=3, x±s |
|
图 6 流式细胞术检测抑制自噬加电离辐射处理后精母细胞GC-2凋亡情况 Fig 6 Apoptosis of spermatocytes GC-2 treated with autophagy inhibitor and ionizing radiation detected by flow cytometry 3-MA: 3-Methyladenine. *P < 0.05 vs 4 Gy irradiation group. n=3, x±s |
3 讨论
随着工业社会的不断发展,不孕不育已日益成为一个普遍的健康问题。据统计全球大约有15%的夫妇遭遇过不孕不育问题的困扰[9],其中30%~35%由男性因素导致[10]。男性生殖系统对包括电离辐射在内的外部环境刺激很敏感,长期暴露于电离辐射的人群与非暴露人群相比,其精液中精子会出现活动度下降、结构畸形增加、浓度下降等问题[4]。除此之外,电离辐射刺激还可能会增加精子DNA断裂的概率[11],而精液中DNA断裂的精子增多,会使得女性妊娠成功率降低,即使通过辅助生殖技术受孕,也会增加胎儿流产的风险[12]。这些研究表明,电离辐射可能会影响男性生殖健康水平。
男性生精细胞包括精原细胞、精母细胞、精子细胞和精子。本实验从小鼠精母细胞着手,研究电离辐射作用与小鼠精母细胞凋亡之间的关系。研究结果显示,电离辐射作用于细胞后可以增加细胞的凋亡, 且随着辐射剂量的增加,细胞凋亡也随之增加。电离辐射与生精细胞凋亡之间的关系早已有研究报道。有研究者用2 Gy辐射剂量连续照射小鼠2个月后,发现小鼠附睾精子的数目与对照组相比下降18%,精子活动度减弱[13],无论是细胞实验还是动物实验均表明,电离辐射可以导致生精细胞凋亡增加。介导生精细胞凋亡的通路主要有以下几条:一是线粒体凋亡途径,细胞色素C的级联激活通路在其中发挥了重要作用。研究发现注射双酚A的雄性小鼠生精细胞内的细胞色素C水平会显著增高,进而激活Caspase-3和Caspase-9, 导致生精细胞的过度凋亡,造成雄性生殖毒性[14]。二是FAS/FASL介导的凋亡。正常状况下二者的相互作用调控凋亡以促进生精细胞更新[15]。研究者发现FAS系统可能介导了肥胖引起的睾丸生精细胞凋亡[16]。三是内质网应激相关的凋亡通路。研究显示内质网应激相关的细胞参与了睾丸扭转引起的生精细胞凋亡过程[17]。不同的刺激因素引起的生精细胞凋亡通路是不一样的,电离辐射引起的凋亡通路还需要进一步研究。
细胞自噬是广泛存在于真核细胞内的一种溶酶体依赖性的降解途径。生理性自噬在保护细胞防止代谢应激和氧化损伤, 以及维持细胞内稳态和细胞产物的合成、降解、循环再利用等方面具有重要作用[18-19]。自噬发生时,Beclin1、LC3-Ⅱ蛋白分别参与了自噬的起始、延长等阶段[20]。本实验分别用蛋白质印迹法和荧光染色法观察细胞自噬水平,证明电离辐射可以诱导精母细胞发生自噬,且Beclin1、LC3-Ⅱ蛋白表达水平随着辐射剂量的增加而上升;在此基础上使用自噬抑制剂3-MA抑制细胞自噬能够明显增强电离辐射诱导的精母细胞凋亡。实验结果证明,电离辐射诱导的细胞自噬会减弱其诱导的细胞凋亡。这与其他研究发现细胞自噬在精母细胞应对外部环境刺激时的作用[21]是一致的。细胞凋亡与自噬是细胞内基因参与调控的与细胞命运息息相关的程序[22]。二者之间联系密切,其中一个程序抑制后即会激活另一个程序,或者一个程序激活后即会抑制另一个程序[23]。本实验证明给予自噬抑制剂3-MA后再使用4 Gy辐射组与单纯4 Gy辐射组相比,精母细胞凋亡率上升,与上述结论相一致。
综上所述,本研究探讨了细胞自噬在电离辐射诱导的精母细胞GC-2发生凋亡的过程中所起的作用以及电离辐射诱导的细胞自噬与其诱导的细胞凋亡之间的关系,结果发现电离辐射可以以一种剂量相关的方式诱导精母细胞凋亡,抑制自噬可以增强电离辐射诱导的凋亡。下一步我们将通过动物实验进一步验证上述结果,并探讨电离辐射诱导精母细胞凋亡的具体机制。
| [1] | 梁纪文, 何寿国, 陈水江. 茂名市不同工龄和工种辐射剂量对放射工作人员的健康效应分析[J]. 职业与健康, 2011, 27: 1475–1476. |
| [2] | RYAN J L. Ionizing radiation:the good, the bad, and the ugly[J]. J Invest Dermatol, 2012, 132: 985–993. DOI: 10.1038/jid.2011.411 |
| [3] | ZHOU D D, HAO J L, GUO K M, LU C W, LIU X D. Sperm quality and DNA damage in men from Jilin Province, China, who are occupationally exposed to ionizing radiation[J/OL]. Genet Mol Res, 2016, 15(1). gmr.15018078. doi:10.4238/gmr.15018078. |
| [4] | KUMAR D, SALIAN S R, KALTHUR G, UPPANGALA S, KUMARI S, CHALLAPALLI S, et al. Semen abnormalities, sperm DNA damage and global hypermethylation in health workers occupationally exposed to ionizing radiation[J/OL]. PLoS One, 2013, 8:e69927. doi:10.1371/journal.pone.0069927. |
| [5] | CODOGNO P, MEIJER A J. Autophagy and signaling:their role in cell survival and cell death[J]. Cell Death Differ, 2005, 12(Suppl 2): 1509–1518. |
| [6] | CHO Y Y, KIM D J, LEE H S, JEONG C H, CHO E J, KIM M O, et al. Autophagy and cellular senescence mediated by Sox2 suppress malignancy of cancer cells[J/OL]. PLoS One, 2013, 8:e57172. doi:10.1371/journal.pone.0057172. |
| [7] | ZHANG G, LIU K, LING X, WANG Z, ZOU P, WANG X, et al. DBP-induced endoplasmic reticulum stress in male germ cells causes autophagy, which has a cytoprotective role against apoptosis in vitro and in vivo[J]. Toxicol Lett, 2016, 245: 86–98. DOI: 10.1016/j.toxlet.2016.01.016 |
| [8] | ZHANG G, LING X, LIU K, WANG Z, ZOU P, GAO J, et al. The p-eIF2α/ATF4 pathway links endoplasmic reticulum stress to autophagy following the production of reactive oxygen species in mouse spermatocyte-derived cells exposed to dibutyl phthalate[J]. Free Radic Res, 2016, 50: 698–707. DOI: 10.3109/10715762.2016.1169403 |
| [9] | FERLIN A, ARREDI B, FORESTA C. Genetic causes of male infertility[J]. Reprod Toxicol, 2006, 22: 133–141. DOI: 10.1016/j.reprotox.2006.04.016 |
| [10] | ODISHO A Y, NANGIA A K, KATZ P P, SMITH J F. Temporal and geospatial trends in male factor infertility with assisted reproductive technology in the United States from 1999-2010[J]. Fertil Steril, 2014, 102: 469–475. DOI: 10.1016/j.fertnstert.2014.05.006 |
| [11] | SAKKAS D, ALVAREZ J G. Sperm DNA fragmentation:mechanisms of origin, impact on reproductive outcome, and analysis[J]. Fertil Steril, 2010, 93: 1027–1036. DOI: 10.1016/j.fertnstert.2009.10.046 |
| [12] | VENKATESH S, SINGH A, SHAMSI M B, THILAGAVATHI J, KUMAR R, MITRA D K, et al. Clinical significance of sperm DNA damage threshold value in the assessment of male infertility[J]. Reprod Sci, 2011, 18: 1005–1013. DOI: 10.1177/1933719111401662 |
| [13] | VERESCHAKO G G, TSHUESHOVA N V, GOROKH G A, KOZLOV I G, NAUMOV A D. Effect of external irradiation and mobilization stress on the reproductive system of male rats[J]. Radiats Biol Radioecol, 2016, 56: 56–63. |
| [14] | WANG Q, ZHAO X F, JI Y L, WANG H, LIU P, ZHANG C, et al. Mitochondrial signaling pathway is also involved in bisphenol A induced germ cell apoptosis in testes[J]. Toxicol Lett, 2010, 199: 129–135. DOI: 10.1016/j.toxlet.2010.08.014 |
| [15] | CELIK-OZENCI C, SAHIN Z, USTUNEL I, AKKOYUNLU G, ERDOGRU T, KORGUN E T, et al. The Fas system may have a role in male reproduction[J]. Fertil Steril, 2006, 85: 1168–1178. DOI: 10.1016/j.fertnstert.2005.08.058 |
| [16] | BAYRAM S, KIZILAY G, TOPCU-TARLADACALISIR Y. Evaluation of the Fas/FasL signaling pathway in diabetic rat testis[J]. Biotech Histochem, 2016, 91: 204–211. DOI: 10.3109/10520295.2015.1129556 |
| [17] | HUANG K H, WENG T I, HUANG H Y, HUANG K D, LIN W C, CHEN S C, et al. Honokiol attenuates torsion/detorsion-induced testicular injury in rat testis by way of suppressing endoplasmic reticulum stress-related apoptosis[J/OL]. Urology, 2012, 79:e5-e11. doi:10.1016/j.urology.2011.11.027. |
| [18] | LI X, WANG S, CHEN Y, LIU G, YANG X. miR-22 targets the 3' UTR of HMGB1 and inhibits the HMGB1-associated autophagy in osteosarcoma cells during chemotherapy[J]. Tumour Biol, 2014, 35: 6021–6028. DOI: 10.1007/s13277-014-1797-0 |
| [19] | VAN DER VOS K E, ELIASSON P, PROIKAS-CEZANNE T, VERVOORT S J, VAN BOXTEL R, PUTKER M, et al. Modulation of glutamine metabolism by the PI3K-PKB-FOXO network regulates autophagy[J]. Nat Cell Biol, 2012, 14: 829–837. DOI: 10.1038/ncb2536 |
| [20] | ESTEBAN-MARTÍNEZ L, BOYA P. Autophagic flux determination in vivo, and ex vivo[J]. Methods, 2015, 75: 79–86. DOI: 10.1016/j.ymeth.2015.01.008 |
| [21] | LIU K, ZHANG G, WANG Z, LIU Y, DONG J, DONG X, et al. The protective effect of autophagy on mouse spermatocyte derived cells exposure to 1800 MHz radiofrequency electromagnetic radiation[J]. Toxicol Lett, 2014, 228: 216–224. DOI: 10.1016/j.toxlet.2014.05.004 |
| [22] | THORBURN A. Apoptosis and autophagy:regulatory connections between two supposedly different processes[J]. Apoptosis, 2008, 13: 1–9. DOI: 10.1007/s10495-007-0154-9 |
| [23] | WARR M R, BINNEWIES M, FLACH J, REYNAUD D, GARG T, MALHOTRA R, et al. FOXO3A directs a protective autophagy program in haematopoietic stem cells[J]. Nature, 2013, 494: 323–327. DOI: 10.1038/nature11895 |
 2017, Vol. 38
2017, Vol. 38


