2. 北京医院血管外科, 北京 100730
2. Department of Vascular Surgery, Beijing Hospital, Beijing 100730, China
垂体能调节多种内分泌器官的激素分泌水平,其功能改变可引起体内代谢功能的紊乱,而垂体瘤是造成垂体功能紊乱的主要原因。垂体瘤是神经系统常见肿瘤,约占颅内肿瘤的10%~25%[1]。垂体瘤分为功能性垂体瘤和无功能垂体瘤。功能性垂体瘤根据其分泌激素种类再次分为泌乳素腺瘤、生长激素腺瘤、促皮质激素腺瘤、卵泡刺激素腺瘤、促甲状腺激素腺瘤[2]。无功能垂体瘤是垂体瘤中最常见的一种类型,约占垂体瘤的1/4,虽然无功能垂体瘤为良性肿瘤,但它的危害大且极易复发,可损害患者视力造成突发性失明,或影响内分泌功能导致患者不孕不育,严重者也可有生命危险[3-4]。
肌动蛋白细丝桥梁蛋白(girders of actin filaments,Girdin)为近年来新发现的肌动蛋白结合蛋白,其在乳腺癌、结肠癌、神经胶质瘤、甲状腺癌等肿瘤中高表达,其表达和活化与肿瘤细胞的发生、发展、侵袭及迁移高度相关[5-6]。本课题组前期利用基因芯片对各种类型的垂体瘤进行了差异表达基因的分析,包括泌乳素腺瘤、生长激素腺瘤、无功能垂体瘤,结果显示无功能垂体瘤和生长激素腺瘤中Girdin表达上调(数据未发表)。本研究在此基础上,检测不同类型垂体瘤样本中Girdin的表达情况,并通过过表达和RNA干扰Girdin,探索其在垂体瘤中的功能及发挥作用的可能信号通路。
1 材料和方法 1.1 实验材料6例垂体瘤(泌乳素腺瘤、生长激素腺瘤和无功能垂体瘤各2例)样本来源于北京天坛医院神经外科研究所垂体瘤样本库,所有样本来源患者均已签署了知情同意书;1例正常垂体样本来源于首都医科大学解剖室捐献遗体。本研究获得北京市神经外科研究所伦理委员会批准。
大鼠垂体瘤细胞GH3购自中国医学科学院北京协和医学院基础医学细胞中心。DMEM培养液、青霉素、链霉素、胎牛血清均购自美国Gibco公司;抗Girdin兔单克隆抗体(ab179481)、抗Akt兔多克隆抗体(ab8805)、p-Akt(phospho 308)兔多克隆抗体(ab38449)和抗β-actin兔多克隆抗体(ab8227)均购自英国Abcam公司;BCA蛋白测定试剂盒购自美国Promega公司;山羊抗兔FITC(ZF-0311)和山羊抗兔辣根过氧化物酶(horseradish peroxidase,HRP;ZB-2301)均购自北京中杉金桥生物制品有限公司。
1.2 免疫荧光法鉴定垂体瘤中Girdin蛋白表达取垂体瘤样本,用OTC包埋后,-20 ℃过夜,制成5 μm切片。将切片放于载玻片上,用4%的多聚甲醛溶液固定20 min,0.2% Triton X-100破膜15 min,5% BSA封闭60 min,加入1:200稀释的抗Girdin兔单克隆抗体,4 ℃过夜;加入山羊抗兔FITC二抗室温静置60 min,1% DAPI核染10 mim,显微镜下观察、拍照。
1.3 细胞培养及Girdin过表达和干扰实验GH3细胞培养在含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中,5% CO2、37 ℃培养箱中培养48 h后,根据细胞生长密度每3~5 d传代1次。GH3细胞按1×105/mL的细胞密度平铺于60 mm培养皿中,过夜,次日分别用Girdin过表达载体、过表达空白载体(北京医院老年病研究所姜平教授馈赠)[5]和RNA干扰慢病毒载体(美国Santa Cruz公司,sc-94984-SH)、RNA干扰阴性对照慢病毒载体(美国Santa Cruz公司,sc-108060)感染48 h。利用蛋白质印迹法检测Girdin过表达和RNA干扰效率。然后对病毒感染细胞用10 μg/mL嘌呤霉素(美国Thermo Fisher公司,A1113803)筛选7 d后,建立稳定的Girdin过表达和RNA干扰GH3细胞,用于Akt蛋白表达和磷酸化水平检测,以及细胞增殖和凋亡实验。
1.4 细胞增殖实验以1×105/mL的细胞密度将Girdin过表达、RNA干扰及其相应的阴性对照细胞接种于35 mm培养皿中,用无病毒的完全培养液培养24、48、72、96 h后,分别收集细胞,利用细胞计数仪计数,实验重复3次取平均值,绘制细胞生长曲线。
1.5 锥虫蓝染色检测细胞凋亡以1×105/mL的细胞密度将RNA干扰和阴性对照细胞接种于35 mm培养皿中,用无病毒的完全培养液培养3 d收集细胞; 同时用蒸馏水配制4%的锥虫蓝溶液,使用时用PBS稀释至0.4%,以1:9比例加入细胞悬液中。染色2 min后,利用细胞计数板计数蓝色细胞,实验重复3次。
1.6 蛋白质印迹法检测Girdin蛋白表达取垂体瘤样本或细胞沉淀匀浆后,离心取上清,利用BCA蛋白测定试剂盒测定蛋白浓度,各样本取相同含量的蛋白质进行SDS-PAGE、转膜,脱脂牛奶封闭60 min,加入1:300稀释的抗Girdin兔单克隆抗体、1:1 000稀释的抗Akt兔多克隆抗体、1:1 000稀释的p-Akt(phospho 308)兔多克隆抗体、1:3 000稀释的抗β-actin兔多克隆抗体过夜,清洗后加入相应二抗孵育60 min,用BIO-RAD全自动凝胶成像扫描显影,实验重复3次。利用ImageJ软件测定蛋白条带灰度值,以目的蛋白与内参蛋白β-actin的灰度值比值代表目的蛋白的表达量。
1.7 统计学处理应用GraphPad 6.0软件进行统计分析,所有实验独立重复3次以上,数据以x±s表示,两组间比较采用t检验。检验水准(α)为0.05。
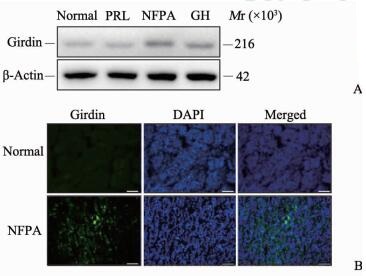
2 结果 2.1 不同类型垂体瘤中Girdin的表达由图 1A可见,无功能垂体瘤中Girdin的表达最高,生长激素腺瘤中表达次之,而正常垂体和泌乳素腺瘤中的表达很少。为了进一步验证Girdin在无功能垂体瘤中的表达,分别取正常垂体和无功能垂体瘤样本冰冻切片进行免疫荧光检测,由图 1B可见,Girdin蛋白(绿色荧光)围绕着蓝色的细胞核分布,主要集中在无功能垂体瘤细胞膜上;而正常垂体中未见明显表达。
|
图 1 Girdin蛋白在不同类型垂体瘤中的表达 Fig 1 Expression of Girdin in different pituitary adenomas A: Western blotting; B: Immunofluorescence staining. Normal: Pituitary gland; PRL: Prolactinoma; NFPA: Non-functioning pituitary adenoma; GH: Growth hormone pituitary adenoma. Scale bar=10 μm |
2.2 垂体瘤细胞系中Girdin与Akt的关系
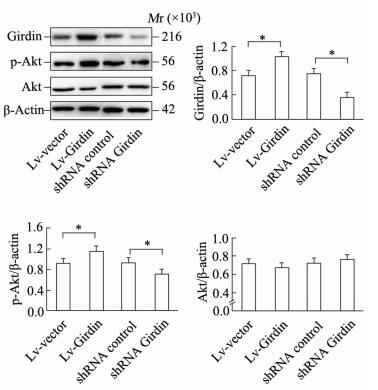
利用RNA干扰技术敲低垂体瘤细胞GH3中Girdin蛋白的表达,同时使另一组GH3细胞过表达Girdin,如图 2所示,RNA干扰组的Girdin蛋白表达减少(P < 0.05),而过表达组Girdin蛋白表达增加(P < 0.05)。同时检测Akt及其磷酸化水平,干扰Girdin蛋白表达后Akt磷酸化水平下降(P < 0.05),而Girdin过表达组Akt磷酸化水平升高(P < 0.05)。无论RNA干扰组还是过表达组,其Akt蛋白的表达与对照组相比均无明显变化。
|
图 2 过表达和RNA干扰Girdin对Akt蛋白及其磷酸化水平的影响 Fig 2 Effect of overexpression and RNA interference of Girdin on Akt and its phosphorylation levels Lv-vector: GH3 cell lines transfected with blank vector as negative control for Lv-Girdin; Lv-Girdin: GH3 cell lines transfected with Girdin overexpressed lentiviral vector; shRNA control: GH3 cell lines transfected with scrabble shRNA sequence as negative control for shRNA Girdin; shRNA Girdin: GH3 cell lines transfected with shRNA interference lentiviral vector targeting Girdin. *P < 0.05. n=3, x±s |
2.3 Girdin表达对GH3细胞增殖的影响
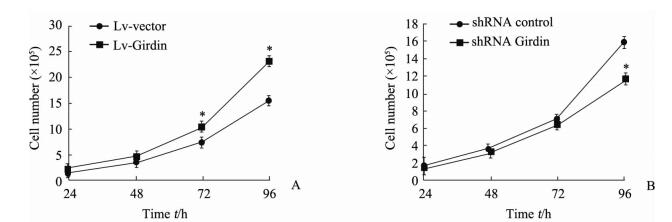
通过细胞生长曲线发现,过表达Girdin后GH3细胞的生长速度较其对照组快,在细胞培养的72 h和96 h时差异有统计学意义(P < 0.05,图 3A)。而RNA干扰Girdin组GH3细胞的增殖速度较其对照组慢,在96 h时差异有统计学意义(P < 0.05,图 3B)。
|
图 3 过表达和RNA干扰Girdin对GH3细胞增殖的影响 Fig 3 Effect of overexpression and RNA interference of Girdin on proliferation of GH3 cells A: Cell growth curve of GH3 cell lines transfected with Girdin overexpressed lentiviral vector (Lv-Girdin) and blank lentiviral vector (Lv-vector); B: Cell growth curve of GH3 cell lines transfected with shRNA interference lentiviral vector targeting Girdin (shRNA Girdin) and scrabble shRNA sequence (shRNA control). *P < 0.05 vs Lv-vector in Fig 3A, and vs shRNA control in Fig 3B. n=3, x±s |
2.4 Girdin表达对GH3细胞凋亡的影响
在RNA干扰Girdin表达后第3天,GH3细胞锥虫蓝染色结果(图 4)显示,与对照组相比,RNA干扰组锥虫蓝染色细胞增多,即凋亡细胞增加,但两组差异无统计学意义(P>0.05)。

|
图 4 RNA干扰Girdin表达对GH3细胞凋亡的影响 Fig 4 Effect of RNA interference of Girdin on apoptosis of GH3 cells Trypan blue staining showed stable transfected GH3 cells with RNA interference lentiviral vector targeting Girdin (shRNA Girdin) and scrabble shRNA sequence (shRNA control). Scale bar=20 μm. n=3, x±s |
3 讨论
Girdin在多种肿瘤组织中特异表达,包括神经胶质瘤、宫颈癌、肝癌等[7-9],但在垂体瘤中的研究尚未见报道。本研究在前期实验基础上,从蛋白水平检测Girdin的表达,结果显示与正常垂体和泌乳素腺瘤比较,无功能垂体瘤中Girdin表达最高,生长激素腺瘤次之,随后的免疫荧光实验也证实了Girdin在无功能垂体瘤中特异性表达。上述结果表明在不同类型垂体瘤中Girdin的表达不一致,无功能垂体瘤具有高表达Girdin的特征。
我们利用过表达和RNA干扰技术,建立了Girdin过表达和敲低的GH3细胞株。蛋白质印迹分析实验结果显示GH3细胞株中Girdin蛋白表达下降和升高后,Akt磷酸化水平也随之下降和升高,而Akt蛋白表达水平并没有发生明显变化,说明Girdin能够调控Akt蛋白的磷酸化水平。研究发现Girdin与Akt能够相互作用,Girdin蛋白第1 416位点上的丝氨酸被Akt磷酸化后,Girdin被激活,激活的Girdin在细胞内重新分布,促进细胞迁移及分裂[10-11]。但过表达的Girdin可进一步增强Akt结构中Thr308和Ser473的磷酸化,促进PI3K/Akt信号通路下游靶基因的活化[12]。本研究进一步证明了Girdin与Akt之间的相互作用,说明Girdin参与了PI3K/Akt通路的信号转导。
在接下来的研究中,我们利用已经建立的稳定感染细胞株进行细胞增殖及凋亡实验,发现Girdin的表达水平能够影响GH3细胞的增殖。RNA干扰后,培养GH3细胞至96 h时的细胞数少于对照组,而Girdin过表达组在第72 h和第96 h时细胞数多于对照组,且差异均有统计学意义(P < 0.05)。在随后的凋亡实验中,虽然我们观察到相对于对照组,RNA干扰组细胞凋亡增加,但两组差异并无统计学意义,所以我们认为RNA干扰组细胞数减少的主要原因可能是Girdin低表达导致了细胞生长缓慢,凋亡并不是影响细胞数减少的主要因素。PI3K/Akt信号通路是肿瘤研究中的一个重要通路,在多种肿瘤细胞中处于活跃状态。活化的Akt不但能激活cyclin D1等细胞周期调控因子影响细胞周期,促进细胞增殖,也能灭活细胞周期抑制蛋白P27、P21等达到相同目的;同时能通过调节相关死亡促进因子(Bcl-xL/Bcl-2-associated death promoter,BAD)和肿瘤抑制蛋白P53提高肿瘤细胞的抗凋亡能力;也能激活下游的靶基因雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等控制肿瘤细胞的生长及迁移[12-13]。本研究发现,在GH3细胞中Girdin促进细胞增殖的作用是通过参与PI3K/Akt信号通路的调控而实现的。
综上所述,本研究发现Girdin在无功能垂体瘤和生长激素腺瘤中呈高表达,证明Girdin具有促进垂体瘤细胞增殖的功能,该功能可能是通过调控PI3K/Akt信号通路实现的。本研究为进一步阐明垂体瘤的发病机制提供了理论基础,同时也为垂体瘤的治疗提供了一个潜在的药物靶点。
| [1] | SCHEITHAUERB W, GAFFEY T A, LLOYD R V, SEBO T J, KOVACS K T, HORVATH E, et al. Pathobiology of pituitary adenomas and carcinomas[J]. Neurosurgery, 2006, 59: 341–353. DOI: 10.1227/01.NEU.0000223437.51435.6E |
| [2] | MELMED S. Pathogenesis of pituitary tumors[J]. Nat Rev Endocrinol, 2011, 7: 257–266. DOI: 10.1038/nrendo.2011.40 |
| [3] | JAFFEC A. Clinically non-functioning pituitary adenoma[J]. Pituitary, 2006, 9: 317–321. DOI: 10.1007/s11102-006-0412-9 |
| [4] | GREENMAN Y, STERN N. Non-functioning pituitary adenomas[J]. Best Pract Res Clin Endocrinol Metab, 2009, 23: 625–638. DOI: 10.1016/j.beem.2009.05.005 |
| [5] | JIANGP, ENOMOTO A, JIJIWA M, KATO T, HASEGAWA T, ISHIDA M, et al. An actin-binding protein Girdin regulates the motility of breast cancer cells[J]. Cancer Res, 2008, 68: 1310–1318. DOI: 10.1158/0008-5472.CAN-07-5111 |
| [6] | LEYMEA, MARIVIN A, GARCIA-MARCOS M. GIV/Girdin creates a positive feedback loop that potentiates outside-in integrin signaling in cancer cells[J]. J Biol Chem, 2016, 291: 8269–8282. DOI: 10.1074/jbc.M115.691550 |
| [7] | NATSUME A, KATO T, KINJO S, ENOMOTO A, TODA H, SHIMATO S, et al. Girdin maintains the stemness of glioblastoma stem cells[J]. Oncogene, 2012, 31: 2715–2724. DOI: 10.1038/onc.2011.466 |
| [8] | JIANG P, REN Y L, LI J L, LUO J. Girdin expression in cervical carcinoma and its role in the malignant properties of HeLa cells[J]. Oncol Lett, 2016, 11: 2440–2444. |
| [9] | CAO K, LU C, HAN S, ZOU Q, LI J, XIE D, et al. Expression of Girdin in primary hepatocellular carcinoma and its effect on cell proliferation and invasion[J]. Int J Clin Exp Pathol, 2015, 8: 551–559. |
| [10] | WENG L, ENOMOTO A, ISHIDA-TAKAGISHI M, ASAI N, TAKAHASHI M. Girding for migratory cues:roles of the Akt substrate Girdin in cancer progression and angiogenesis[J]. Cancer Sci, 2010, 101: 836–842. DOI: 10.1111/j.1349-7006.2009.01487.x |
| [11] | YAMAMURA Y, ASAI N, ENOMOTO A, KATO T, MⅡ S, KONDO Y, et al. Akt-Girdin signaling in cancer-associated fibroblasts contributes to tumor progression[J]. Cancer Res, 2015, 75: 813–823. DOI: 10.1158/0008-5472.CAN-14-1317 |
| [12] | ANAI M, SHOJIMA N, KATAGIRI H, OGIHARA T, SAKODA H, ONISHI Y, et al. A novel protein kinase B (PKB)/AKT-binding protein enhances PKB kinase activity and regulates DNA synthesis[J]. J Biol Chem, 2005, 280: 18525–18535. DOI: 10.1074/jbc.M500586200 |
| [13] | 张春雨, 张捷. PI3K/Akt信号通路与肿瘤细胞凋亡相关研究进展[J]. 国际呼吸杂志, 2011, 31: 1905–1909. DOI: 10.3760/cma.j.issn.1673-436X.2011.024.015 |
 2017, Vol. 38
2017, Vol. 38


