肝癌是一种常见的恶性肿瘤,在2012年全球有782 500例新发病例、745 500例死亡病例,中国新发和死亡病例约占世界的50%[1]。其中,70%~90%的患者其组织学类型是肝细胞肝癌(hepatocellular carcinoma,HCC)[2]。HCC的发生是一个多步骤的复杂过程,因此研究HCC的发生、诊断、治疗及预后对提高公众的健康水平极为重要。
研究表明,微RNA(microRNA,miRNA)-340(miR-340)在结直肠癌[3]、卵巢癌[4]、乳腺癌[5]等多种肿瘤中充当抑癌因子,其通过抑制细胞的增殖、侵袭、转移以及诱导细胞凋亡参与肿瘤的发生和发展。此外有研究指出miR-340通过结直肠癌细胞的瓦尔堡效应(Warburg effect)影响细胞的增殖[6]。且在口腔上皮细胞癌中miR-340可上调葡萄糖转运蛋白1(glucose transporter 1,GLUT1)的表达,从而导致乳酸分泌增加和葡萄糖摄取增加[7]。可见miR-340在多种肿瘤中具有重要的作用,但其在HCC中是否也具有抑癌作用并且能否作为评价病情或预后的指标,目前尚无相关研究。本研究拟分析miR-340在HCC患者癌组织和癌旁组织中的表达特点及其在正常肝细胞系以及肝癌细胞系中的表达特点,揭示miR-340对肝癌细胞增殖和凋亡的影响,并对miR-340的作用靶点进行预测和验证。
1 材料和方法 1.1 主要材料正常肝细胞株HL-7702和肝癌细胞株HepG2、Hep3B、SMMC-7721、Bel-7402均由重庆医科大学病毒性肝炎研究所保存。MEM培养液和RPMI 1640培养液购自美国Gibco公司。胎牛血清(fetal bovine serum,FBS)购自美国PAN-Biotech公司。MiR-340模拟质粒(miR-340 mimic;质粒结构包括克隆载体pLVX-ZsGreen-Puro和miR-340 DNA引物序列,序列如下:正义5′-GAT CCG GTT ATA AAG CAA TGA GAC TGA TTT TTT CTC GAG G-3′, 反义5′-AAT TCC TCG AGA AAA AAT CAG TCT CAT TGC TTT ATA ACC G-3′)、miR-340模拟对照质粒(miR-340 mimic control;质粒结构包括克隆载体pLVX-ZsGreen)、miR-340抑制质粒(miR-340 inhibitor;质粒结构包括克隆载体pLVX-tdTomato-Puro和miR-340 inhibitor DNA引物序列,序列如下:正义5′-GAT CCG GAA TCA GTC TCG ACC TTT ATA ATT TTT TCT CGA GG-3′, 反义5′-AAT TCC TCG AGA AAA AAT TAT AAA GGT CGA GAC TGA TTC CG-3′)、miR-340抑制对照质粒(miR-340 inhibitor control;质粒结构包括克隆载体pLVX-tdTomato)、转染试剂EndoFectionTM-Max、反转录试剂盒以及qPCR试剂盒均购自广州复能基因有限公司。高纯度miRNA和mRNA提取试剂盒购自上海玉博生物科技有限公司。CCK-8试剂盒购自日本Dojindo公司。AnnexinⅤ-PE/7-AAD凋亡检测试剂盒和AnnexinⅤ-FITC/PI凋亡检测试剂盒购自杭州联科生物技术股份有限公司。蛋白质印迹实验相关试剂盒购自上海碧云天生物技术有限公司。抗S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKP2)抗体(RLT-4311)、抗GAPDH抗体(RLM-3215)和二抗(RS0002)均购自苏州睿瀛生物技术有限公司。
1.2 HCC癌组织和癌旁组织标本的收集收集重庆医科大学附属第一医院肝胆外科2015年3月至2016年9月收治的40例经术后病理确诊为HCC患者的癌组织和癌旁组织标本,其中癌旁组织要远离癌组织边缘3 cm以上。标本于术中取下后立即放入RNA保存液中,之后立即置于液氮中保存。所有纳入患者均同意参与本实验,并签署知情同意书。本实验方案和内容获得重庆医科大学附属第一医院伦理学委员会的批准并且严格遵守《赫尔辛基宣言》。
1.3 肝细胞以及肝癌细胞的培养肝癌细胞株HepG2和Hep3B培养在含10% FBS的MEM培养液中,肝癌细胞株SMMC-7721、Bel-7402以及正常肝细胞株HL-7702培养在含有10% FBS的RPMI 1640培养液中。以上细胞均培养于37 ℃、5% CO2的环境中。
1.4 miRNA和mRNA的提取、反转录、qPCR所有引物均由广州复能基因有限公司合成。各型肝癌细胞和正常肝细胞均培养48 h后进行miRNA和mRNA的提取。使用高纯度miRNA和mRNA提取试剂盒通过离心柱法提取组织和细胞中的miRNA和mRNA,然后分别用miRNA反转录试剂盒以及第一链合成试剂盒进行反转录反应。
miRNA反转录反应体系为20 μL,其中总RNA 2 μg、2.5 U/μL多聚腺苷酸聚合酶1 μL、反转录酶1 μL、5×反应缓冲液5 μL,用双蒸水(不含RNA酶和DNA酶)补足20 μL; 反转录反应条件为37 ℃ 60 min、85 ℃ 5 min, 4 ℃放置。cDNA稀释3倍进行qPCR。以U6作为内参。引物序列如下:miR-340正义5′-GCG GTT ATA AAG CAA TGA GA-3′、反义5′-GTG CGT GTC GTG GAG TCG-3′,U6正义5′-CTC GCT TCG GCA GCA CA-3′、反义5′-AAC GCT TCA CGA ATT TGC GT-3′。qPCR反应体系为20 μL,含2×一体化qPCR试剂10 μL、一体化miRNA qPCR引物2 μL、通用适配PCR引物2 μL、cDNA 2 μL、双蒸水4 μL。反应条件:95 ℃ 10 min; 95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共40个循环。mRNA反转录分为2步。第1步:总体积13 μL,包括RNA 2 μg、250 μmol/L随机引物1 μL,用双蒸水补足13 μL;反应条件65 ℃ 10 min。第2步:总体积25 μL,含RNA引物13 μL、5×反应缓冲液5 μL、25 mmol/L脱氧核糖核苷三磷酸1 μL、25 U/μL l RNA酶抑制剂1 μL、200 U/μL反转录酶1 μL、双蒸水4 μL;反应条件为37 ℃ 60 min、85 ℃ 5 min,4 ℃放置。cDNA稀释5倍进行qPCR。以GAPDH为内参。引物序列如下:SKP2正义5′-AGT CTC TAT GGC AGA CCT TAG ACC-3′、反义5′-TTT CTG GAG ATT CTT TCT GTA GCC-3′,GAPDH正义5′-CAG TCA GCC GCA TCT TCT TTT-3′、反义5′-GTG ACC AGG CGC CCA ATA C-3′。qPCR反应体系为20 μL,含2×一体化qPCR试剂10 μL、一体化qPCR引物2 μL、cDNA 2 μL、双蒸水6 μL。反应条件:95 ℃ 10 min; 95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共40个循环。每个检验指标设3个复孔,使用2-ΔΔCt法定量miRNA和mRNA的相对表达水平。
1.5 细胞转染培养SMMC-7721细胞生长至约60%融合时,按照EndoFectionTM-Max试剂盒说明书将miR-340模拟质粒及其对照质粒、miR-340抑制质粒及其对照质粒分别转入细胞内。培养6 h后更换新鲜培养液,在37 ℃、5% CO2条件下培养24~72 h,收集各组细胞进行下一步实验。
1.6 CCK-8实验检测细胞增殖将SMMC-7721细胞以1×105/孔的密度接种于96孔板,转染成功后分别在培养24、48、72 h时每孔加入含10% CCK-8反应液的培养液100 μL,等待对照孔光密度(D)值达到1时,在450 nm处检测实验孔的D值。细胞存活率(%)=[(实验孔D值-空白孔D值)/(对照孔D值-空白孔D值)]×100%。每一时间点设5个平行孔。
1.7 流式细胞术检测细胞凋亡按照细胞凋亡检测试剂盒要求收集miR-340模拟质粒组、miR-340模拟对照质粒组、miR-340抑制质粒组、miR-340抑制对照质粒组SMMC-7721细胞。PBS洗涤2次,用500 μL PBS重悬细胞后转入1.5 mL EP管。用预冷的PBS离心洗涤细胞2次,弃上清。用双蒸水稀释5×结合缓冲液为1×工作液,取适量预冷的1×工作液重悬细胞沉淀使细胞密度为1×106~1×107/mL,每个样品管中加入100 μL细胞悬液。miR-340模拟质粒组、miR-340模拟对照质粒组样品管加入5 μL AnnexinⅤ-PE和10 μL 7-AAD。MiR-340抑制质粒组、miR-340抑制对照质粒组样品管加入5 μL AnnexinⅤ-FITC和10 μL PI。轻柔漩涡混匀后,室温避光孵育5~15 min。无需洗涤,miR-340模拟质粒组和miR-340模拟对照质粒组样品管中再加入380 μL预冷的1×工作液。最后用美国BD公司Influx Flow Cytometer & Cell Sorter系统检测细胞凋亡情况。
1.8 生物信息学检测运用miRNA靶基因在线预测软件PicTar (http://pictar.mdc-berlin.de/)、miRBase(http://www.mirbase.org)、TargetScanHuman(http://www.targetscan.org)进行预测,将得到的3个软件中至少2个有交集且与细胞增殖和凋亡有关的蛋白质的编码基因作为miR-340可能的靶基因。
1.9 蛋白质印迹法检测miR-340下游可能靶蛋白SKP2的表达按照蛋白质印迹检测试剂盒要求提取细胞总蛋白,用BCA试剂盒进行蛋白质定量。使用10% SDS-PAGE分离蛋白并转移至PVDF膜上,用8%脱脂奶粉溶液封闭1 h。加入按1:500稀释的一抗,4 ℃孵育过夜。TBST洗涤3次,每次10 min;加入1:8 000稀释的二抗,常温孵育180 min。TBST洗涤3次,进行化学发光反应并采集图像。
1.10 统计学处理所有实验均重复3次。应用SPSS 19.0软件分析数据。计量资料以x±s表示,5种细胞间miR-340表达差异的比较采用单因素方差分析,两组间的比较采用t检验。MiR-340表达(以miR-340相对表达的平均值为界,高于平均值为高表达,低于平均值为低表达)与临床病理指标的关系采用χ2检验进行分析。检验水准(α)为0.05。
2 结果 2.1 癌及癌旁组织中miR-340的表达及其与临床病理指标的关系癌组织中miR-340的表达水平(0.03±0.02)低于癌旁组织(0.07±0.02,P < 0.01)。以miR-340相对表达量的平均值(0.39±0.18)为界,21例患者的miR-340低表达,19例为高表达。由表 1可见,乙肝表面抗原阳性、HBV DNA载量≥1.0×103 U/mL、肿瘤大小≥5 cm和高TNM分期的HCC患者多呈现miR-340低表达(P < 0.01)。表明miR-340可能参与HCC的形成,其表达可能受乙肝病毒影响,且miR-340表达水平可能与HCC病情的严重程度相关。
|
|
表 1 HCC患者miR-340的表达与临床病理指标的关系 Tab 1 Relationship between miR-340 expression and clinicopathological factors in HCC patients |
2.2 不同肝癌细胞和正常肝细胞中miR-340的表达
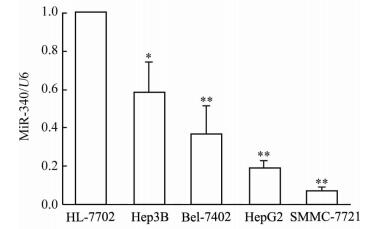
qPCR结果(图 1)显示4种肝癌细胞株中miR-340的表达均低于正常肝细胞HL-7702(P < 0.05, P < 0.01),其中miR-340在SMMC-7721细胞中的表达最低,因此选取该细胞开展后续细胞增殖和凋亡实验。
|
图 1 qPCR检测肝癌细胞和正常肝细胞中microRNA-340(miR-340)的表达 Fig 1 Expression of microRNA-340 (miR-340) in hepatoma cell lines and normal hepatocyte by qPCR Hep3B, Bel-7402, HepG2 and SMMC-7721 are hepatoma cell lines, and HL-7702 is normal hepatocyte.*P < 0.05, **P < 0.01 vs HL-7702 cells. n=3, x±s |
2.3 MiR-340对SMMC-7721细胞增殖和凋亡的影响
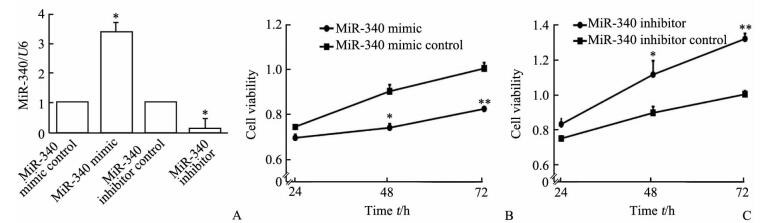
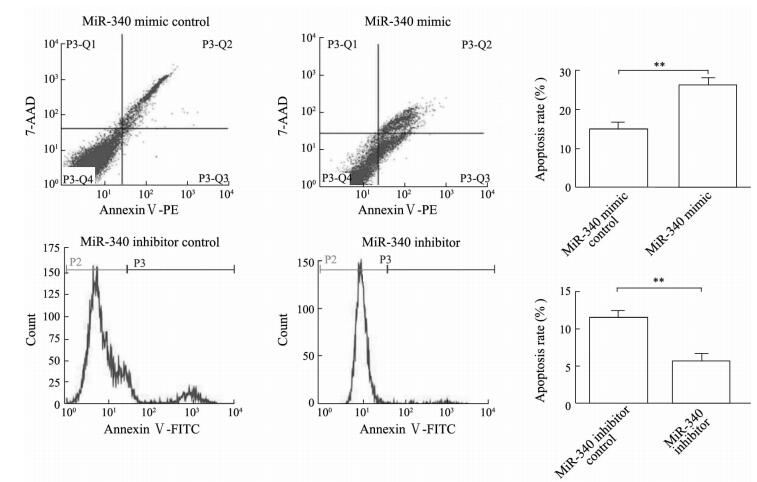
qPCR检测转染后SMMC-7721细胞内的miR-340的表达水平,结果(图 2A)显示转染miR-340模拟质粒后SMMC-7721细胞中miR-340的表达高于转染了miR-340模拟对照质粒的细胞,转染了miR-340抑制质粒后miR-340的表达低于转染了miR-340抑制对照质粒的细胞(P < 0.05)。CCK-8细胞增殖实验结果(图 2B、2C)显示,转染了miR-340模拟质粒后SMMC-7721细胞的存活率较转染miR-340模拟对照质粒的细胞降低,而转染miR-340抑制质粒的细胞存活率较转染miR-340抑制对照质粒的细胞升高(P < 0.05, P < 0.01)。流式细胞术结果(图 3)显示,与转染miR-340模拟对照质粒的细胞相比,转染miR-340模拟质粒后SMMC-7721细胞的凋亡率增加(P < 0.01),而转染miR-340抑制质粒的SMMC-7721细胞的凋亡率与转染miR-340抑制对照质粒的细胞相比下降(P < 0.01)。上述结果表明,miR-340能够抑制SMMC-7721细胞的增殖并促进凋亡。
|
图 2 增加和抑制microRNA-340(miR-340)表达对SMMC-7721细胞增殖的影响 Fig 2 Effects of overexpression or suppression of microRNA-340 (miR-340) on proliferation of SMMC-7721 cells A: Transfection efficiency of miR-340 in SMMC-7721 cells transfected with miR-340 eukaryotic expression vector by qPCR; B: Overexpression of miR-340 significantly inhibits the viability of SMMC-7721 cells at different time points; C: Suppression of miR-340 significantly increases the viability of SMMC-7721 cells at different time points. *P < 0.05, **P < 0.01 vs the corresponding control group. n=3, x±s |
|
图 3 MicroRNA-340(miR-340)表达增加和抑制对SMMC-7721细胞凋亡的影响 Fig 3 Effects of overexpression or suppression of microRNA-340 (miR-340) on apoptosis of SMMC-7721 cells by flow cytometry **P < 0.01. n=3, x±s |
2.4 MiR-340对SKP2 mRNA和蛋白表达的影响
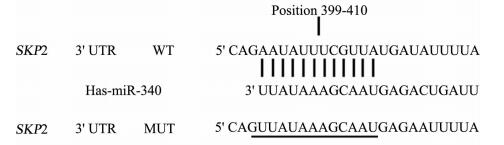
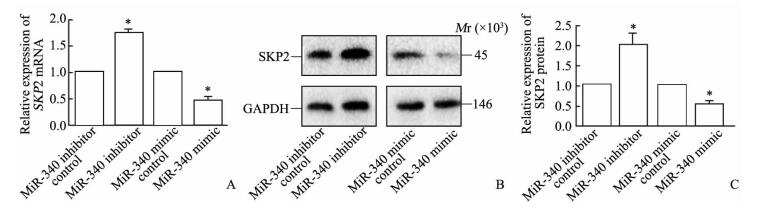
运用生物信息学技术发现,3个软件中至少2个有交集, 与细胞增殖、凋亡有关的蛋白质SKP2的编码基因可能是miR-340的靶基因。SKP2的3′ UTR具有1个miR-340的结合位点,即“种子序列”完全互补(图 4),提示SKP2基因3′ UTR与miR-340具有较强的结合性。进一步验证miR-340是否会对SKP2表达具有抑制作用,结果(图 5)显示转染miR-340模拟质粒后SMMC-7721细胞中SKP2 mRNA和蛋白质的表达均较转染miR-340模拟对照质粒的细胞降低(P < 0.05),而转染了miR-340抑制质粒后SMMC-7721细胞中SKP2 mRNA和蛋白的表达均较转染miR-340抑制对照质粒的细胞升高(P < 0.05)。表明miR-340能够抑制SKP2的表达,而这一抑制作用也许是通过miR-340与SKP2的靶向结合而实现的。
|
图 4 MicroRNA-340(miR-340)与S期激酶相关蛋白2(SKP2)基因的靶向结合位点 Fig 4 Targeted combination of microRNA-340 (miR-340) and S-phase kinase associated protein 2 (SKP2) gene UTR: Untranslated regions; WT: Wild type; MUT: Mutant type |
|
图 5 MicroRNA-340 (miR-340)对SKP2表达的影响 Fig 5 Effect of microRNA-340 (miR-340) on SKP2 expression A: Expression of SKP2 mRNA in SMMC-7721 cells after transfection detected by qPCR; B, C: Expression of SKP2 protein in SMMC-7721 cells after transfection detected by Western blotting. SKP2: S-phase kinase-associated protein 2. *P < 0.05 vs the corresponding control group.n=3, x±s |
3 讨论
MiRNA通过翻译后修饰在人类肿瘤的发生、发展过程中发挥重要的作用,其既可是致癌基因也可是抑癌基因,同时也可作为肿瘤的治疗靶点和肿瘤患者预后的评价指标。例如,miRNA在诱发人类癌症发生过程中起关键抑制作用的第1个证据来自于对慢性淋巴细胞白血病中染色体13q14上2个编码区域缺失的研究,而这2个区域正是编码miR-15a和miR-16-1的位置[8];至于miRNA所起的致癌基因的作用,较早得出确定结论的便是miR-155的过表达会导致B细胞淋巴瘤、乳腺癌、肺癌和甲状腺癌[9-10];而miR-125则能在乳腺癌中发挥重要的抑制癌细胞侵袭和转移的作用[11];在非小细胞肺癌中,let-7的减少与较差的预后和较短的患者术后生存期密切相关[12]。本研究发现miR-340在4种肝癌细胞中的表达较正常肝细胞均降低。同时,在40对HCC标本中,癌旁组织中miR-340的表达均高于癌组织。统计学分析表明,乙肝表面抗原阳性的患者或者是HBV DNA载量大于正常值的患者往往表现出更低的miR-340水平;此外,如果患者具有更高的TNM分期或者是更大的肿瘤(≥5 cm),那么这些患者也表现出更低的miR-340水平。这些结果表明miR-340可能与乙型病毒性肝炎的感染有关。
研究表明乙型肝炎病毒X蛋白(HBx)能够激活NF-κB,后者能够结合到相应miRNA的启动子区域或增强子区域进而对miRNA产生反式激活作用[13],因此可能是类似上述机制导致了miR-340的异常表达,从而导致HCC的发生和发展,但这需要进一步研究。在生物学功能方面,miR-340明显抑制了SMMC-7721细胞的增殖,并且诱导了其凋亡。这表明在HCC中miR-340是作为一种抑癌基因发挥作用的。生物信息学软件预测结果显示SKP2是miR-340的靶蛋白。研究表明,SKP2在晚期肝癌患者癌组织中的表达升高,并且SKP2的过表达与患者更差的预后有关[14]。qPCR和蛋白质印迹分析结果表明miR-340的增加会抑制SKP2 mRNA和蛋白质的表达,同时抑制miR-340会增加SKP2 mRNA和蛋白质的表达。提示miR-340可能通过靶向结合SKP2或复合体的形式发挥作用。
本研究表明miR-340在HCC中可以抑制细胞增殖并促进凋亡,而这一作用的机制可能与miR-340抑制了SKP2的表达有关,但是miR-340抑制SKP2的机制是特异性的靶向作用还是以复合体的形式发挥作用还需要进一步研究。本研究发现miR-340的表达量与HBV感染密切相关并且在HCC患者的癌组织以及癌旁组织中的表达有明显的差异,因此我们推测可能是由于HBV的感染导致抑癌基因miR-340的异常表达进而引发肝细胞向恶性转化,而HCC患者异常表达的miR-340的量也许能够作为一个预测HCC患者病情和预后的指标,但这一结论还需要进一步的实验和大样本的统计分析。
| [1] | TORRE L A, BRAY F, SIEGEL R L, FERLAY J, LORTET-TIEULENT J, JEMAL A. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65: 87–108. DOI: 10.3322/caac.21262 |
| [2] | McGLYNN K A, PETRICK J L, LONDON W T. Global epidemiology of hepatocellular carcinoma:an emphasis on demographic and regional variability[J]. Clin Liver Dis, 2015, 19: 223–238. DOI: 10.1016/j.cld.2015.01.001 |
| [3] | TAKEYAMAH, YAMAMOTO H, YAMASHITA S, WU X, TAKAHASHI H, NISHIMURA J, et al. Decreased miR-340 expression in bone marrow is associated with liver metastasis of colorectal cancer[J]. Mol Cancer Ther, 2014, 13: 976–985. DOI: 10.1158/1535-7163.MCT-13-0571 |
| [4] | LI P, SUN Y, LIU Q. MicroRNA-340 induces apoptosis and inhibits metastasis of ovarian cancer cells by inactivation of NF-κB1[J]. Cell Physiol Biochem, 2016, 38: 1915–1927. DOI: 10.1159/000445553 |
| [5] | MOHAMMADI-YEGANEH S, PARYAN M, AREFIAN E, VASEI M, GHANBARIAN H, MAHDIAN R, et al. MicroRNA-340 inhibits the migration, invasion, and metastasis of breast cancer cells by targeting Wnt pathway[J]. Tumour Biol, 2016, 37: 8993–9000. DOI: 10.1007/s13277-015-4513-9 |
| [6] | SUN Y, ZHAO X, ZHOU Y, HU Y. miR-124, miR-137 and miR-340 regulate colorectal cancer growth via inhibition of the Warburg effect[J]. Oncol Rep, 2012, 28: 1346–1352. DOI: 10.3892/or.2012.1958 |
| [7] | XU P, LI Y, ZHANG H, LI M, ZHU H. MicroRNA-340 mediates metabolic shift in oral squamous cell carcinoma by targeting glucose transporter-1[J]. J Oral Maxillofac Surg, 2016, 74: 844–850. DOI: 10.1016/j.joms.2015.09.038 |
| [8] | CALING A, DUMITRU C D, SHIMIZU M, BICHI R, ZUPO S, NOCH E, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J]. Proc Natl Acad Sci USA, 2002, 99: 15524–15529. DOI: 10.1073/pnas.242606799 |
| [9] | COSTINEANS, ZANESI N, PEKARSKY Y, TILI E, VOLINIA S, HEEREMA N, et al. Pre-B cell proliferation and lymphoblastic leukemia/high-grade lymphoma in Eμ-miR155 transgenic mice[J]. Proc Natl Acad Sci USA, 2006, 103: 7024–7029. DOI: 10.1073/pnas.0602266103 |
| [10] | NEGRINI M, FERRACIN M, SABBIONI S, CROCE C M. MicroRNAs in human cancer:from research to therapy[J]. J Cell Sci, 2007, 120: 1833–1840. DOI: 10.1242/jcs.03450 |
| [11] | SCOTT G K, GOGA A, BHAUMIK D, BERGER C E, SULLIVAN C S, BENZ C C. Coordinate suppression of ERBB2 and ERBB3 by enforced expression of micro-RNA miR-125a or miR-125b[J]. J Biol Chem, 2007, 282: 1479–1486. DOI: 10.1074/jbc.M609383200 |
| [12] | TAKAMIZAWA J, KONISHI H, YANAGISAWA K, TOMIDA S, OSADA H, ENDOH H, et al. Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival[J]. Cancer Res, 2004, 64: 3753–3756. DOI: 10.1158/0008-5472.CAN-04-0637 |
| [13] | ZHANG X, LIU S, HU T, LIU S, HE Y, SUN S. Up-regulated microRNA-143 transcribed by nuclear factor kappa B enhances hepatocarcinoma metastasis by repressing fibronectin expression[J]. Hepatology, 2009, 50: 490–499. DOI: 10.1002/hep.23008 |
| [14] | LEE S W, LI C F, JIN G, CAI Z, HAN F, CHAN C H, et al. Skp2-dependent ubiquitination and activation of LKB1 is essential for cancer cell survival under energy stress[J]. Mol Cell, 2015, 57: 1022–1033. DOI: 10.1016/j.molcel.2015.01.015 |
 2017, Vol. 38
2017, Vol. 38


