原发性肝癌是一种发病率和致死率相对较高的常见肿瘤,已成为全球范围内的肿瘤相关死亡的第三大重要因素[1]。原发性肝癌中70%~85%的组织学类型是肝细胞癌(hepatocellular carcinoma,HCC)[2]。虽然近年在HCC的流行病学、发病机制以及诊疗方面都取得一定进展,但其高复发和高转移率仍严重影响患者预后[3-4]。探索HCC发生、发展、转移和复发的机制对于控制肿瘤进展、改善患者预后具有重要的临床意义[5]。肿瘤干细胞(tumor stem cell,TSC)对包括HCC在内的肿瘤的复发与转移起着重要的作用,因而,对肿瘤的诊断、治疗以及预后评估需要将TSC及其相关指标纳入考虑范围[6]。
Musashi-1是最先在果蝇体内被确认的一种RNA结合蛋白[7],之后被用作神经干细胞的标志物[8]。越来越多的证据显示,Musashi-1在多种肿瘤中高表达,包括视网膜母细胞瘤、肺癌、食管腺癌、胶质瘤、胃肠道肿瘤等[9-14]。在这些肿瘤中,Musashi-1多与TSC相关并影响肿瘤的发生与转移。本研究主要探索Musashi-1在HCC中的表达及其与肝癌组织中公认TSC标志物CD133的关系,初步探讨其对HCC发生、发展、转移、复发的影响及其与HCC患者预后的关系。
1 材料和方法 1.1 标本来源收集138例于2000年6月至2010年6月在我院行根治性HCC切除术患者的术中肿瘤标本及其相应的癌旁标本,患者均为随机选择。纳入标准:(1)术前均未接受其他抗肿瘤治疗;(2)均接受根治性HCC切除术;(3)术后病理报告证实为HCC;(4)患者本人同意参加研究。排除标准:(1)围手术期死亡病例;(2)患者伴有其他严重的系统性疾病。将所收集的每例标本均分为2份,1份用甲醛溶液固定后石蜡包埋以待切片,另1份新鲜组织样本迅速用液氮冷冻后储存于-80 ℃冰箱。本研究通过第二军医大学东方肝胆外科医院伦理委员会批准,所有登记的患者均签署知情同意书。
1.2 免疫组织化学染色检测Musashi-1表达石蜡组织块预先置于-20 ℃冷冻处理后,用Leica石蜡切片机切片,层厚5 μm,贴于载玻片上,68 ℃烤箱烘烤约1 h后用全自动免疫组化仪器脱蜡,二甲苯、梯度乙醇脱蜡至水,3%过氧化氢甲醇溶液抗原灭活20 min,用酸性修复液修复抗原,1%小牛血清白蛋白(BSA)37 ℃封闭30 min。加入按1:50比例稀释的Musashi-1抗体(英国Abcam公司,ab52865),4 ℃过夜;第2天复温15 min,PBS漂洗4次,加入二抗于37 ℃下孵育30 min,DAB显色后用ddH2O终止反应,并用苏木精复染约10 min,盐酸乙醇分化后冲洗返蓝,梯度乙醇脱水后中性树脂封片。将免疫组织化学染色标本按以下标准评分:出现棕黄色颗粒的所有细胞(包括细胞膜、细胞质、细胞核)均判定为Musashi-1阳性细胞。根据染色的深浅程度,将阳性强度分为3个等级:0,阴性,淡黄色;1,弱阳性,黄或深黄色;2,阳性,褐或棕褐色。根据阳性细胞所占每个视野的范围分为4个等级:0, < 25%;1, ≥25%且<50%;2, ≥50%且<75%;3, ≥75%。染色评分即视野中范围等级与强度等级的乘积。将总评分 < 4定义为低表达,≥4为高表达。所有免疫组化染色评分均由2位观察者独立完成。
1.3 蛋白质印迹实验检测Musashi-1表达取大小约5 mm×5 mm×5 mm的新鲜组织,加入RAIP裂解液500 μL,匀浆后转移到新的EP管中,4 ℃、12 000×g离心15 min,取上清用BCA法进行蛋白定量,然后进行10% SDS-PAGE,用湿转仪将蛋白转移至硝酸纤维素膜上,5% BSA溶液封闭,于室温分别标记一抗Musashi-1(英国Abcam公司,ab52865;1:1 000稀释)、内参抗体GAPDH(美国CST公司,51332;1:1 000稀释) 3 h,对应的二抗室温标记1 h,TBST洗3次,每次5 min。用LICOR Odyssey Clx扫膜仪检测膜上的蛋白并进行半定量分析。
1.4 RNA的抽提、反转录、qPCR实验分别取绿豆大小(约50 mg)的新鲜癌组织及相应的癌旁组织置入2 mL EP管中,用TRIzol试剂(美国Invitrogen公司)提取总RNA。取约2 μg RNA 70 ℃变性,37 ℃反转录1 h。使用罗氏LightCycler 480 qPCR系统检测组织样品中Musashi-1和CD133 mRNA的表达。Musashi-1引物序列:正向5′-GCG ACA CTG CTG GAC AGG AAT TA-3′,反向5′-CTG GTC CAT GAA AGT GAC GAA-3′;CD133引物序列:正向5′-TTC TTG ACC GAC TGA GAC CCA-3′,反向5′-TCA TGT TCT CCA ACG CCT CTT-3′;内参基因β-actin的引物序列:正向5′-CCA CCC ATG GCA AAT TTC-3′,反向5′-GCC CAG GAT GCC CTT GA-3′。qPCR反应条件:95 ℃ 5 min,1个循环;95 ℃ 30 s、56 ℃ 40 s、72 ℃ 40 s,40个循环;95 ℃ 15 s、60 ℃ 30 s、95 ℃ 15 s,1个循环。
1.5 构建过表达Musashi-1的肝癌细胞系将人肝癌细胞系SMMC-7721细胞(我院生物信号转导室细胞库)接种于含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养液中,置37 ℃、5% CO2培养箱中培养,按照1:3传代。将细胞接种至6孔细胞培养板,待细胞生长至50%融合时,换无血清培养液,按3×106 TU/mL浓度分别加入ov-NC、ov-Musashi-1慢病毒(上海吉凯基因化学技术有限公司)以及增敏剂[polybrene, 吉满生物科技(上海)有限公司,终浓度10 μg/mL],约8 h后换液,待细胞生长至90%融合后逐步扩增并使用嘌呤霉素筛选。通过蛋白质印迹法检验细胞中Musashi-1的过表达效果。
1.6 Sphere成球实验用6孔低黏附细胞培养板(每孔加入2 mL含10% BSA的DMEM培养液)培养过表达Musashi-1的SMMC-7721细胞。5%胰酶消化细胞后计数细胞,每孔内接种4 000个细胞,置37 ℃、5% CO2培养箱内培养10~14 d后,用倒置显微镜观察细胞球的形成数量。
1.7 肿瘤侵袭实验24孔细胞培养板每孔加700 μL含10% BSA的DMEM培养液,其上放置Transwell小室,小室内加入500 μL含有105个细胞的无血清DMEM悬液。培养12 h后固定,结晶紫染色,洗净后显微镜下观察,选取5个视野计数细胞取平均值。
1.8 统计学处理所有实验均重复3次以上。应用SPSS 22.0软件进行数据分析,计量资料以x±s表示,两组间比较采用t检验。采用Pearson χ2检验和Fisher精确检验对Musashi-1与HCC患者临床病理指标的关系进行单因素分析。使用Kaplan-Meier生存分析法绘制生存曲线。CD133与Musashi-1的相关性分析采用直线相关统计学方法。检验水准(α)为0.05。
2 结果 2.1 Musashi-1在HCC癌组织及癌旁组织中的表达免疫组织化学染色检测结果显示Musashi-1在癌组织中的表达主要集中在细胞质以及细胞核(图 1A)。所检测的138例样本中105例(76.1%)癌组织中Musashi-1的表达较癌旁组织升高,差异有统计学意义(5.50±0.26 vs 1.20±0.50, P < 0.05)。选取其中30例患者的癌组织与癌旁组织进行蛋白质印迹分析及qPCR,结果显示癌组织中Musashi-1蛋白和mRNA的表达水平均高于癌旁组织(P均 < 0.01,图 1B~1D)。以上结果表明HCC癌组织中Musashi-1的表达升高。
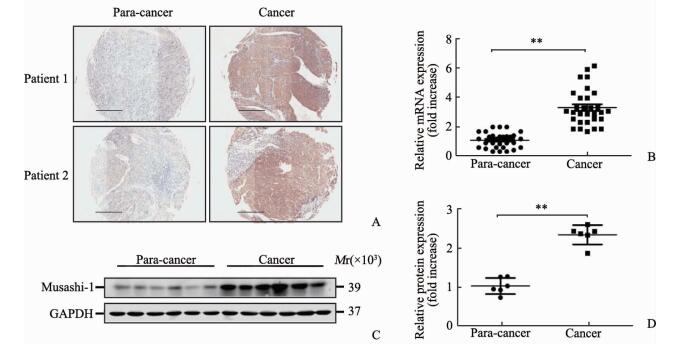
|
图 1 HCC患者癌组织和癌旁组织中Musashi-1的表达 Fig 1 Expression of Musashi-1 in tumor and adjacent non-tumor tissues of HCC patients A: Immunohistochemistry showed that Musashi-1 was highly expressed in tumor tissues than in adjacent non-tumor tissues. Scale bar=500 μm; B: The mRNA expression of Musashi-1 in 30 pairs HCC tissues and adjacent non-tumor tissues were analyzed by qPCR (**P < 0.01); C, D: Western blotting showed Musashi-1 protein expression in 6 pairs HCC tissues and adjacent non-tumor tissues (**P < 0.01). HCC: Hepatocellular carcinoma |
2.2 Musashi-1的表达与HCC患者临床病理指标的关系
Musashi-1表达水平的高低与患者的甲胎蛋白(α-fetoprotein,AFP)水平、腹水、远处转移有关(P < 0.05),而与性别、年龄、乙肝病史、肿瘤大小、子灶、门静脉癌栓、镜下癌栓等无关(P>0.05),见表 1。提示Musashi-1的高表达可能与肿瘤的转移以及恶性转化有关。
|
|
表 1 HCC组织中Musashi-1的表达与临床病理指标的关系 Tab 1 Correlation of Musashi-1 expression in HCC tissues with its clinical characteristics |
2.3 Musashi-1表达与HCC患者预后的关系
根据Musashi-1的差异表达绘制Kaplan-Meier生存曲线,统计分析结果表明Musashi-1高表达患者的总体生存率和无瘤生存率较低表达患者均降低(P < 0.05,图 2),说明Musashi-1的高表达与患者的总体生存呈负相关,与复发呈正相关。
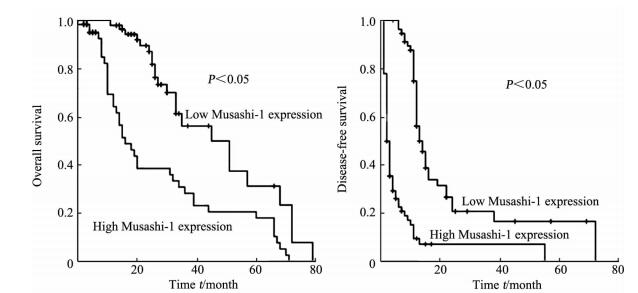
|
图 2 Musashi-1的表达与HCC患者预后的关系 Fig 2 Correlation of Musashi-1 expression with prognosis of HCC patients HCC: Hepatocellular carcinoma. n=60 in low Musashi-1 expression group; n=78 in high Musashi-1 expression group |
2.4 HCC癌组织和癌旁组织中CD133的表达及其与Musashi-1的相关性
通过qPCR检测30例HCC癌组织以及相应癌旁组织中CD133的mRNA表达水平,结果显示癌组织中的CD133 mRNA的表达高于癌旁组织,差异有统计学意义(P < 0.05)。将30例癌组织及癌旁组织中的CD133与Musashi-1行相关性分析后发现,Musashi-1的表达与CD133的表达呈正相关(R2=0.78, P < 0.001),见图 3。这一结果提示Musashi-1的高表达可能与HCC癌细胞的干性相关。
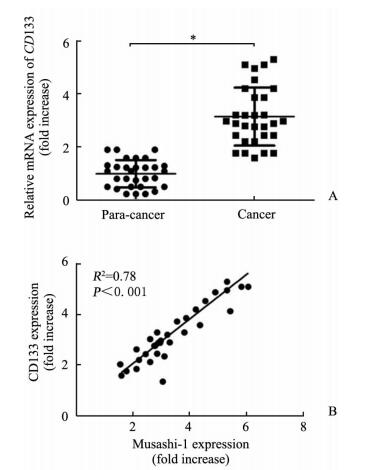
|
图 3 CD133在HCC癌组织中的表达(A)及其与Musashi-1表达的相关性(B) Fig 3 Expression of CD133 in HCC tissues (A) and its relationship with Musashi-1 expression (B) HCC: Hepatocellular carcinoma. *P < 0.05. n=30 |
2.5 过表达Musashi-1对SMMC-7721细胞干性及侵袭转移能力的影响
在体外利用人肝癌细胞系SMMC-7721细胞建立了稳定过表达Musashi-1的细胞系(图 4A)。利用该细胞系进行Sphere成球实验,结果显示:相较对照细胞,稳定过表达Musashi-1的SMMC-7721细胞的成球能力增强(图 4B)。通过Transwell实验对建立的Musashi-1过表达细胞进行肿瘤侵袭能力检测,结果显示过表达Musashi-1后,肿瘤细胞的侵袭能力增强(图 4C)。以上结果提示,Musashi-1的表达与肿瘤细胞的干性以及侵袭、转移能力存在密切的关系。

|
图 4 过表达Musashi-1 SMMC-7721细胞系的鉴定、Sphere成球实验以及肿瘤侵袭实验结果 Fig 4 Definition of SMMC-7721 ov-Musashi-1 cell line, Sphere formation assay and Transwell assay A: Musashi-1 in SMMC-7721 ov-Musashi-1 cell was overexpressed; B: Sphere formation assay showed that the sphere-forming potential of SMMC-7721 ov-Musashi-1 cell was increased; C: SMMC-7721 ov-Musashi-1 cell migrated more actively than control. Scale bar=500 μm. *P < 0.05. n=4, x±s |
3 讨论
研究发现在人中枢神经系统肿瘤中高表达的Musashi-1同样也是一种重要的神经干细胞或神经前体细胞标志物,也有越来越多的研究发现Musashi-1在TSC中高表达[15-18]。除此之外,Musashi-1可以作为转录调节因子调节相关mRNA的功能以及保持细胞的干性和自我更新能力,Musashi-1表达的高低也是一些恶性肿瘤预后评估的一个潜在因子[19-21]。有研究报道,作为TSC的标志物,Musashi-1可通过Notch-1信号通路对子宫内膜癌细胞的细胞周期以及细胞凋亡进行调节[22]。最近,Fox等[23]发现在胰腺癌的治疗耐受性的发生中Musashi-1起着重要的调节作用,即可促进胰腺癌对化疗及放疗产生耐受。
本研究发现,Musashi-1在HCC中的转录及翻译水平均升高,而且其高表达与HCC患者的预后密切相关。同时,Musashi-1的高表达与患者的AFP水平、腹水、远处转移均相关,而与性别、年龄、乙肝病史、肿瘤大小、子灶、门静脉癌栓和镜下癌栓等无明显相关性,提示Musashi-1与肿瘤的复发转移、恶性转化有关。另外,Musashi-1高表达的癌组织中TSC标志物CD133的表达也升高,并且二者具有相关性,说明Musashi-1对HCC的TSC自我更新能力的维持可能具有重要调节作用。体外实验也显示,慢病毒过表达Musashi-1的肝癌细胞系SMMC-7721细胞的成球能力和侵袭能力更强,说明Musashi-1对于肿瘤细胞干性的获得以及转移能力的增强具有促进作用。
总结实验结果以及对临床病理相关资料进行分析后,我们发现Musashi-1在HCC癌组织中高表达,高表达Musashi-1的HCC患者更容易发生复发转移并且预后更差。此外,Musashi-1在维持肝癌细胞干性和促进肝癌细胞转移中有着重要的调节作用。这些结果提示,Musashi-1可能是调节HCC恶性转化以及复发转移的重要因子,具体有待进一步的深入研究。
| [1] | JEMAL A, BRAY F, CENTER M M, FERLAY J, WARD E, FORMAN D. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61: 69–90. DOI: 10.3322/caac.v61:2 |
| [2] | SERAGH B, RUDOLPH K L. Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132: 2557–2576. DOI: 10.1053/j.gastro.2007.04.061 |
| [3] | 赵建军, 阎涛, 毕新宇, 赵宏, 黄振, 周健国, 等. 血清癌胚抗原水平与肝细胞肝癌预后的相关性分析[J]. 中华肿瘤杂志, 2014, 36: 430–434. DOI: 10.3760/cma.j.issn.0253-3766.2014.06.006 |
| [4] | 曲强, 芮静安, 王少斌, 陈曙光, 周立, 韩凯, 等. 肝细胞肝癌临床分期系统的比较[J]. 中华肿瘤杂志, 2006, 28: 155–158. DOI: 10.3760/j.issn:0253-3766.2006.02.022 |
| [5] | EL-SERAG H B, MARRERO J A, RUDOLPH L, REDDY K R. Diagnosis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2008, 134: 1752–1763. DOI: 10.1053/j.gastro.2008.02.090 |
| [6] | SAGARJ, CHAIB B, SALES K, WINSLET M, SEIFALIAN A. Role of stem cells in cancer therapy and cancer stem cells:a review[J/OL]. Cancer Cell Int, 2007, 7:9. doi:10.1186/1475-2867-7-9. |
| [7] | NAKAMURAM, OKANO H, BLENDY J A, MONTELL C. Musashi, a neural RNA-binding protein required for Drosophila adult external sensory organ development[J]. Neuron, 1994, 13: 67–81. DOI: 10.1016/0896-6273(94)90460-X |
| [8] | NAKANO A, KANEMURA Y, MORI K, KODAMA E, YAMAMOTO A, SAKAMOTO H, et al. Expression of the neural RNA-binding protein Musashi1 in pediatric brain tumors[J]. Pediatr Neurosurg, 2007, 43: 279–284. DOI: 10.1159/000103307 |
| [9] | SEIGELG M, HACKAM A S, GANGULY A, MANDELL L M, GONZALEZ-FERNANDEZ F. Human embryonic and neuronal stem cell markers in retinoblastoma[J]. Mol Vis, 2007, 13: 823–832. |
| [10] | CHEN H Y, LIN L T, WANG M L, LEE S H, TSAI M L, TSAI C C, et al. Musashi-1 regulates AKT-derived IL-6 autocrinal/paracrinal malignancy and chemoresistance in glioblastoma[J]. Oncotarget, 2016, 7: 42485–42501. DOI: 10.18632/oncotarget.v7i27 |
| [11] | WANG X, HU J F, TAN Y, CUI J, WANG G, MRSNY R J, et al. Cancer stem cell marker Musashi-1 rs2522137 genotype is associated with an increased risk of lung cancer[J/OL]. PLoS One, 2014, 9:e95915. doi:10.1371/journal.pone.0095915. |
| [12] | MOKROWIECKAA, VEITS L, FALKEIS C, MUSIAL J, KORDEK R, LOCHOWSKI M, et al. Expression profiles of cancer stem cell markers:CD133, CD44, Musashi-1 and EpCAM in the cardiac mucosa-Barrett's esophagus-early esophageal adenocarcinoma-advanced esophageal adenocarcinoma sequence[J]. Pathol Res Pract, 2017, 213: 205–209. DOI: 10.1016/j.prp.2016.12.018 |
| [13] | CHIOU G Y, YANG T W, HUANG C C, TANG C Y, YEN J Y, TSAI M C, et al. Musashi-1 promotes a cancer stem cell lineage and chemoresistance in colorectal cancer cells[J/OL]. Sci Rep, 2017, 7:2172. doi:10.1038/s41598-017-02057-9. |
| [14] | CHEN P X, LI Q Y, YANG Z. Musashi-1 expression is a prognostic factor in ovarian adenocarcinoma and correlates with ALDH-1 expression[J]. Pathol Oncol Res, 2015, 21: 1133–1140. DOI: 10.1007/s12253-015-9943-6 |
| [15] | WANG X Y, PENALVA L O, YUAN H, LINNOILA R I, LU J, OKANO H, et al. Musashi1 regulates breast tumor cell proliferation and is a prognostic indicator of poor survival[J/OL]. Mol Cancer, 2010, 9:221. doi:10.1186/1476-4598-9-221. |
| [16] | YODAA, SAWA H, OKANO H. MSI-1, a neural RNA-binding protein, is involved in male mating behaviour in Caenorhabditis elegans[J]. Genes Cells, 2000, 5: 885–895. DOI: 10.1046/j.1365-2443.2000.00378.x |
| [17] | HAN Y M, PARK J M, CHOI Y S, JIN H, LEE Y S, HAN N Y, et al. The efficacy of human placenta-derived mesenchymal stem cells on radiation enteropathy along with proteomic biomarkers predicting a favorable response[J/OL]. Stem Cell Res Ther, 2017, 8:105. doi:10.1186/s13287-017-0559-5. |
| [18] | FLVHC, HATTERMANN K, MEHDORN H M, SYNOWITZ M, HELD-FEINDT J. Differential expression of CXCR4 and CXCR7 with various stem cell markers in paired human primary and recurrent glioblastomas[J]. Int J Oncol, 2016, 48: 1408–1416. |
| [19] | LIU N, CHEN T, WANG X, YANG D, XUE B, ZHU H. Msi1 confers resistance to TRAIL by activating ERK in liver cancer cells[J]. FEBS Lett, 2015, 589: 897–903. DOI: 10.1016/j.febslet.2015.02.026 |
| [20] | CHEN K, GAO Q, ZHANG W, LIU Z, CAI J, LIU Y, et al. Musashi1 regulates survival of hepatoma cell lines by activation of Wnt signalling pathway[J]. Liver Int, 2015, 35: 986–998. DOI: 10.1111/liv.2015.35.issue-3 |
| [21] | SANCHEZ-DIAZ P C, BURTON T L, BURNS S C, HUNG J Y, PENALVA L O. Musashi1 modulates cell proliferation genes in the medulloblastoma cell line Daoy[J/OL]. BMC Cancer, 2008, 8:280. doi:10.1186/1471-2407-8-280. |
| [22] | GÖTTE M, GREVE B, KELSCH R, MVLLER-UTHOFF H, WEISS K, KHARABI MASOULEH B. The adult stem cell marker Musashi-1 modulates endometrial carcinoma cell cycle progression and apoptosis via Notch-1 and p21WAF1/CIP1[J]. Int J Cancer, 2011, 129: 2042–2049. DOI: 10.1002/ijc.v129.8 |
| [23] | FOX R G, LYTLE N K, JAQUISH D V, PARK F D, ITO T, BAJAJ J, et al. Image-based detection and targeting of therapy resistance in pancreatic adenocarcinoma[J]. Nature, 2016, 534: 407–411. DOI: 10.1038/nature17988 |
 2017, Vol. 38
2017, Vol. 38


