2. 中国科学院深圳先进技术研究院, 深圳 518055
2. Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, Guangdong, China
肿瘤严重威胁着人类健康,目前化疗是治疗肿瘤的有效手段之一,但化疗的不良反应大且会产生一定的耐药性。光热联合化疗成为当今肿瘤治疗的热点。本课题组前期研究已验证了IR-780光热效应对小鼠乳腺癌的治疗效果[1],然而,单纯光热效应难以彻底消灭肿瘤组织。本研究拟制备同时包封化疗药物多柔比星(doxorubicin, DOX)和光敏剂IR-780的温敏脂质体(DOX-IR-780 thermo-sensitive liposomes, DITSL),并采用激光照射释药,以探索光热联合化疗治疗肿瘤的新途径。
1 材料和方法 1.1 主要材料与仪器二棕榈酰磷脂酰胆碱(DPPC,美国Avanti Polar Lipids公司,纯度>99%,批号:63-89-8),单棕榈酰磷脂酰胆碱(MPPC,美国Avanti Polar Lipids公司,纯度>99%,批号:69525-80-0),二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000,美国Avanti Polar Lipids公司,纯度>99%,批号:474922-22-0);IR-780碘化物;DOX(美国Sigma-Aldrich公司);PBS(美国HyClone公司)。挤出仪(美国Avanti Polar Lipids公司);Zeta粒度仪(英国Malvern公司);激光器(由中国科学院深圳先进技术研究院医工所提供,自组装);DMI4000B型倒置荧光显微镜、TCSSP5型激光共聚焦显微镜、RM2255型石蜡切片机(德国Leica公司);BSA223S型电子天平(赛多利斯科学仪器北京有限公司);Ti27型红外热像仪(美国Fluke公司);LS55型荧光光谱仪、Lambda35型紫外-可见光光谱仪(美国PerkinElmer公司);FLS920型荧光分光光度计(英国Edinburgh Industries公司)。
1.2 DITSL的制备取DPPC、MPPC、DSPE-PEG2000(物质的量之比为86:10:4)与IR-780(IR-780:脂质=5:100,质量比)混溶于氯仿,边涡旋边氮气吹干成均匀薄膜,真空3 h抽去残留氯仿。加入250 mmol/L (NH4)2SO4溶液溶解脂质薄膜,在65 ℃水浴中超声振荡至澄清,制成IR-780脂质体(ITSL)。将ITSL用挤出仪从200 nm聚碳酸酯膜中反复挤出,制备成粒径均匀的ITSL。将ITSL装于透析袋中,放入PBS中透析4 h。将DOX溶液(1 mg/mL)逐滴加入ITSL中,边加边振荡,利用硫酸铵梯度法将DOX载入ITSL内核制备得DITSL。载DOX脂质体(DTSL)在成膜过程中只加入磷脂,其余制作方法如DITSL。使用Zeta粒度仪在室温下测粒径大小、粒径分布、多分散指数(PDI)和表面电位,用紫外-可见光光谱仪检测各脂质体的吸收光谱。
1.3 IR-780和DOX包封率的检测使用荧光分光光度计测得IR-780和DOX的荧光值-浓度标准曲线。将制备好的各脂质体放入超滤管,通过超速离心法(11 200×g,30 min)分离脂质体和游离的药物,荧光分光光度计结合IR-780和DOX的荧光值-浓度标准曲线检测包封在脂质体内部的药物浓度,计算包封率。包封率(%)=(包封的药物量)/(初始加入量)×100%。
1.4 激光诱导的体外升温分别取PBS、DTSL(DOX 15 μg/mL)、ITSL(IR-780 15 μg/mL)以及DITSL(IR-780 15 μg/mL, DOX 15 μg/mL)各1 mL加入小试管中。用近红外激光(808 nm,0.8 W/cm2)对每个样本照射5 min,每隔30 s用红外热像仪测量各脂质体溶液的温度并记录。
1.5 激光诱导DITSL药物释放取DITSL和DTSL分别置入含90%血清的PBS中, 用近红外激光(808 nm,0.8 W/cm2)分别照射20 s、40 s、1 min、2 min、3 min、4 min、5 min,检测辐照不同时间两种脂质体的DOX释放情况,同时设无激光辐照为对照,检测相同时间点DITSL的DOX释放量。
1.6 统计学处理应用SPSS 19.0软件行数据分析。所有数据均以x±s表示,两样本间比较采用t检验,多样本比较采用单因素方差分析,检验水准(α)为0.05。
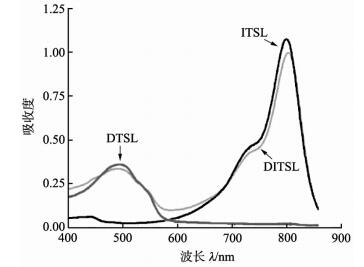
2 结果 2.1 DITSL的构建各脂质体的光学特性如图 1所示。ITSL在793 nm处有最大吸收峰,DTSL在492 nm处有最大吸收峰,DITSL在793 nm和492 nm均有显著吸收峰,表明DITSL成功构建。
|
图 1 载药脂质体的紫外-可见光光谱图 DITSL:载IR-780和多柔比星(DOX)温敏脂质体; ITSL:载IR-780温敏脂质体; DTSL:载DOX温敏脂质体 |
2.2 DITSL表征
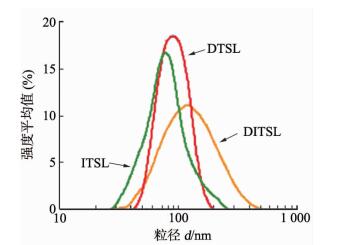
各脂质体的粒径分布如图 2所示,载单药脂质体平均粒径均小于100 nm,而DITSL平均粒径为139 nm左右。各脂质体的药物包封率均高于90%,提示温敏脂质体是良好的载药工具。DITSL粒径大小、PDI、zeta电位及包封率见表 1。
|
图 2 载药脂质体的粒径分布 DITSL:载IR-780和多柔比星(DOX)温敏脂质体; ITSL:载IR-780温敏脂质体; DTSL:载DOX温敏脂质体 |
|
|
表 1 各脂质体的性质表征 |
2.3 红外热像仪显示结果
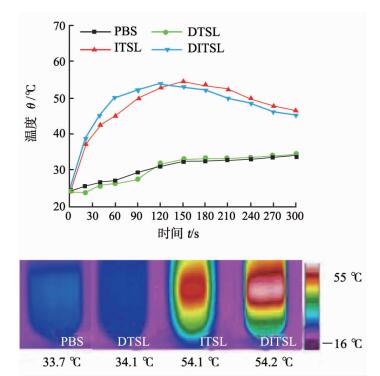
0.8 W/cm2激光照射5 min后,DITSL、ITSL、DTSL和PBS组的最高温度分别为54.2、54.1、34.1、33.7 ℃(图 3),各组在激光照射前的起始温度均为24.4 ℃。ITSL和DITSL组的温度升高一段时间后开始缓慢下降。单因素方差分析结果显示各组间差异有统计学意义(F=1 764.08,P < 0.05);多重比较结果显示,PBS和DTSL组为同类子集(P>0.05),ITSL和DITSL组为同类子集(P>0.05),两子集间比较差异有统计学意义(P < 0.05)。
|
图 3 DITSL、ITSL和DTSL在808 nm激光辐照下的光热升温效应和红外热像图 DITSL:载IR-780和多柔比星(DOX)温敏脂质体; ITSL:载IR-780温敏脂质体; DTSL:载DOX温敏脂质体. PBS组和DTSL组与ITSL组和DITSL组比较,P < 0.05 |
2.4 激光诱导DITSL的药物释放特性
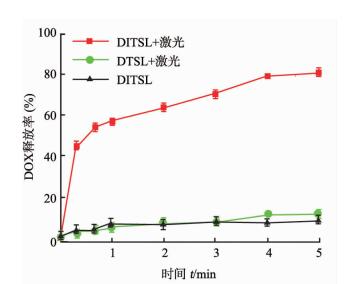
DITSL释药率随激光辐照时间延长而增加,照射1 min后达56.0%,照射5 min后达80.1%(图 4)。无激光辐照DITSL的药物释放率较低,5 min后约为8.9%。DTSL在激光辐照下的药物释放率与DITSL无激光情况相仿,5 min后的药物释放率约为11.2%。单因素方差分析结果显示各组间差异有统计学意义(F=490.30,P < 0.05);多重比较结果显示,DTSL+激光组和DITSL组为同类子集(P>0.05),DITSL+激光组与这两组比较差异均有统计学意义(P < 0.05)。
|
图 4 激光照射下DITSL中多柔比星(DOX)累计释放情况 DITSL:载DOX/IR-780温敏脂质体; ITSL:载IR-780温敏脂质体; DTSL:载DOX温敏脂质体. DITSL+激光组与DTSL+激光组和DITSL组比较,P < 0.05. n=5, x±s |
3 讨论
温度敏感脂质体是壳膜由双分子层脂质组成(主要是磷脂和胆固醇)、内部为水相的闭合囊泡,壳膜磷脂的疏水尾部相对,具有典型的双亲分子特性[2-5]。其包封范围广泛,亲水性药物、两性药物和疏水性药物均可被包封[6-8],且可在一定温度作用下释放包封的药物。因此,本研究采用温敏脂质体作为运载亲水性药物DOX和脂溶性光敏剂IR-780的载体,并利用IR-780的光热效应,采用激光激发升温释药。紫外-可见分光光度计检测结果表明ITSL在793 nm处有最大吸收峰,符合IR-780的吸收特征; DTSL在492 nm处有最大吸收,与DOX吸收峰相似; DITSL同时在793 nm和492 nm有显著吸收峰,表明亲水性的DOX和疏水性的IR-780被同时包封于脂质体内,DITSL构建成功。本研究制备的DITSL平均粒径为(138.98±8.74) nm,略带负电荷,PDI为0.32±0.02,说明粒径分布均匀,IR-780和DOX的包封率均高达90%以上。红外热像仪检测结果证实0.8 W/cm2激光照射5 min时,DITSL和ITSL最高温度分别升到54.2 ℃和54.1 ℃,而DTSL和PBS组的升高幅度低于DITSL和ITSL组。缺乏光热制剂时激光不能有效地转化成热能,因此DTSL和PBS组只有轻微的温度升高,而DITSL和ITSL组由于IR-780的存在温度明显升高,但升高一段时间后会缓慢下降,推测其原因可能是IR-780在光照一段时间后发生了分子之间的自猝灭。
本研究结果显示0.8 W/cm2激光照射1 min后DITSL的释药率达到56.0%,照射5 min时释药率约80.1%。而DTSL中由于不含IR-780,光热转换效率低,在激光辐照下的释药率与DITSL无激光情况相仿,5 min后的释药率约为11.2%;无激光辐照DITSL 5 min后的释药率也仅为8.9%。表明IR-780在激光作用下升温,温敏脂质体双分子膜由“凝胶”态转变到“液晶”态结构,膜的流动性增大,膜变薄,脂质体表面出现裂孔,导致包封药物的迅速释放[9]。
综上所述,本研究制备的DITSL可同时包封IR-780和DOX,包封率高、理化性质良好,并能在激光照射下高效释药,未来我们将开展细胞水平实验和动物实验研究其对肿瘤治疗的效果。
| [1] | 周群芳, 段琬璐, 黎国峰, 严飞, 刘锐洪, 李叶阔. IR-780光热治疗小鼠乳腺癌移植瘤的初步研究[J]. 临床肿瘤学杂志, 2015, 22: 303–306. |
| [2] | LEE B K, YUN Y H, PARK K. Smart nanoparticles for drug delivery:boundaries and opportunities[J]. Chem Eng Sci, 2015, 24: 158–164. |
| [3] | QIU Y, GUO L, ZHANG S, XU B, GAO Y, HU Y, et al. DNA-based vaccination against hepatitis B virus using dissolving microneedle arrays adjuvanted by cationic liposomes and CpG ODN[J]. Drug Deliv, 2016, 23: 2391–2398. |
| [4] | SCHWENDENER R A, SCHOTT H. Liposome formulations of hydrophobic drugs[J]. Methods Mol Biol, 2010, 605: 129–138. DOI: 10.1007/978-1-60327-360-2 |
| [5] | VENKATAHARSHA P, MAHESHWARA E, RAJU Y P, REDDY V A, RAYADU B S, KARISETTY B. Liposomal Aloe vera trans-emulgel drug delivery of naproxen and nimesulide:a study[J]. Int J Pharm Investig, 2015, 5: 28–34. DOI: 10.4103/2230-973X.147230 |
| [6] | WU H, YAO L, MEI J, LI F. Development of synthetic of peptide-functionalized liposome for enhanced targeted ovarian carcinoma therapy[J]. Int J Clin Exp Med, 2014, 7: 4809–4818. |
| [7] | THAMPHIWATANA S, GAO W, PORNPATTANANANGKUL D. Phospholipase A2-responsive antibiotic delivery via nanoparticle-stabilized liposomes for the treatment of bacterial infection[J]. J Mater Chem B Mater Biol Med, 2014, 2: 8201–8207. DOI: 10.1039/C4TB01110D |
| [8] | YU T, CHAN K W, ANONUEVO A, SONG X, SCHUSTER B S, CHATTOPADHYAY S, et al. Liposome-based mucus-penetrating particles (MPP) for mucosal theranostics:demonstration of diamagnetic chemical exchange saturation transfer (diaCEST) magnetic resonance imaging (MRI)[J]. Nanomedicine, 2015, 11: 401–405. DOI: 10.1016/j.nano.2014.09.019 |
| [9] | ANDERSON V C, THOMPSON D H. Triggered release of hydrophilic agents from plasmalogen liposomes using visible light or acid[J]. Biochim Biophys Acta, 1992, 1109: 33–42. DOI: 10.1016/0005-2736(92)90183-M |
 2017, Vol. 38
2017, Vol. 38


